新疆地区四种草莓病毒病原的检测
杨波,赵宝龙,郝小军,都业娟,何旺
(1.特色果蔬栽培生理与种质资源利用兵团重点实验室/石河子大学农学院,新疆石河子 832000;2.新疆绿洲农业病虫害治理与植保资源利用自治区普通高校重点实验室/石河子大学农学院,新疆石河子 832000)
0 引 言
【研究意义】草莓是蔷薇科(Rosaceae)草莓属(Fragaria)植物,其果实具有较高的营养及保健价值。草莓也已成为我国乃至世界广泛栽培的重要经济作物。截止到2015年,我国草莓栽培面积达12.93×104hm2,总产量达347.9×104t,种植面积和产量均居世界第一位[1]。新疆草莓栽培自20世纪30年代,草莓生产取得较大发展,南北疆各地区均有种植[2]。草莓为多年生常绿草本,主要靠匍匐茎进行无性繁殖,在长期无性分株过程中,很容易感染病毒并在植株内积累,造成草莓品种植株矮化,匍匐茎减少,结果能力减弱,果实品质变差,产量下降等种性退化。草莓一旦感染病毒,多是代代相传,病毒病可造成草莓减产30%~80%[3]。因此,调查与检测新疆草莓主栽区病毒病发生情况,对推进新疆草莓无病毒种苗的生产和应用具有实际意义。【前人研究进展】目前,世界上已报道的草莓病毒病多达 25 种,主要有草莓斑驳病毒病(strawberrymottlevirus,SMoV)、草莓镶脉病毒病(Strawberryveinbandingvirus,SVBV)、草莓轻型黄边病毒病(Strawberrymildyellowedgevirus,SMYEV)、草莓皱缩病毒病(Strawberrycrinklevirus,SCV)等[4,5]。我国于20世纪80年代末开始对草莓部分病毒进行调查和鉴定。郑巧兮、王国平等[6-9]分别通过电镜观察和嫁接指示植物方法,对上海、辽宁、山东、河北、陕西、甘肃各地草莓进行调查鉴定,主要有草莓斑驳病毒(strawberrymottlevirus,SMoV)、草莓轻型黄边病毒(Strawberrymildyellowedgevirus,SMYEV)、草莓镶脉病毒(Strawberryveinbandingvirus,SVBV)和草莓皱缩病毒(Strawberrycrinklevirus,SCV)四种病毒,带毒率最高达99%,并且多以复合感染为主。高庆玉等[10]对黑龙江省草莓病毒病种类进行研究,发现四种病毒也多以复合感染形式存在。韦石泉、吴元华等[11,12]对辽宁辽阳、沈阳、兴城、朝阳,吉林长春、四平、通化、大连、丹东、黑龙江哈尔滨、河北保定、江苏南京及湖北武汉草莓斑驳病毒以及草莓镶脉病毒调查发现,SMoV和SVBV的单独感染率也分别在90%和20%以上。王运生等[13]对北京、浙江、四川、河北等不同地区草莓进行初步调查及RT-PCR检测,SVBV、SMoV、SCV、SMYEV在不同品种间均有发生,并且SVBV发生最为普遍。【本研究切入点】调查检测范围有限,仅仅局限我国内地部分省市地区。近年来,随着新疆设施农业的发展,以草莓为主题的观光农业也迅速发展,病毒病是影响草莓产业发展的一个重要因素。但关于新疆该地区草莓病毒病发病情况以及病毒种类相关研究未见报道。研究检测与调查新疆地区四种草莓病毒病原。【拟解决的关键问题】利用草莓上4种主要病毒特异性引物,通过RT-PCR对南北疆主栽区的草莓进行检测,分析不同地区草莓病毒种类以及草莓带毒情况,为新疆草莓无病毒苗的生产和应用提供理论依据。
1 材料与方法
1.1 材 料
2017年4~5月,从新疆乌鲁木齐、伊犁、哈密、库尔勒、阿克苏和石河子等草莓主栽区15个采样地,随机采取450株草莓样品,采回的样品保存-80℃冰箱。
1.2 方 法
1.2.1 引物设计
根据相关文献[14,15]设计引物,委托生工生物工程(上海)有限责任公司合成。表1
表1 四对草莓病毒特定引物序列
Table 1 Specific primers sequences of four strawberry viruses
1.2.2 草莓总RNA提取和cDNA合成
应用艾德莱公司RN09-EASYspin 植物RNA快速提取试剂盒(RN0902)提取草莓总RNA。所提RNA通过 0.8% 的琼脂糖凝胶电泳检测总RNA的完整性。采用艾德莱公司PC18-TRUEscript 1st Strand cDNA Synthesis Kit(第一链反转录试剂盒)合成cDNA,步骤参考说明书,将得到的cDNA保存在-20℃冰箱待用。
1.2.3 草莓病毒病单一RT-PCR检测
反转录得到的cDNA作为模板,用含Taq酶的2×TaqPCR Master Mix(艾德莱)进行PCR。PCR反应体系中含2×TaqPCR Master Mix 10 μL,上、下游引物各1 μL,模板cDNA 2 μL,ddH2O补足到20 μL。反应程序如下:(1)B1/B2、Q1/Q2、A1/A2引物对:94℃预变性2 min;94℃变性30s,55℃退火40s,72℃延伸30s,35个循环,72℃终末延伸5 min,4℃保存。(2)X1/X2引物对:94℃预变性5 min;94℃变性30s,55℃退火60s,72℃延伸90s,35个循环,72℃终末延伸5 min,4℃保存。(3)Z1/Z2引物对:94℃预变性2 min;94℃变性30s,55℃退火40s,72℃延伸40s,35个循环,72℃终末延伸5 min,4℃保存。PCR产物通过2%琼脂糖凝胶进行检测。
1.2.4 三种病毒多重PCR体系建立
利用单一RT-PCR检测获得同时感染SMoV、SMYEV和SVBV的草莓样品cDNA为模板,同一体系加入三对引物进行多重PCR。反应采用20 μL体系,以退火温度和引物浓度为探索条件,退火温度设5个水平即53、54、55、56和57℃,使用引物(浓度均为 10 mM)按不同用量组合。对单一条件优化时,其他因素都不变。由于SVBV片段与SMoV和SMYEV扩增片段相比较长,多重PCR反应程序延伸时间以SVBV程序为主。经过多重PCR扩增好的产物用2%琼脂糖凝胶检测扩增产物。挑选出条带清晰、条带指示正确的最优组合为多重PCR反应体系和程序。用其他同时感染草莓斑驳病毒病、草莓轻型黄边病毒病和草莓镶脉病毒病的样品进行单一PCR对比,验证多重RT-PCR可靠性和实用性。表2
表2 多重RT-PCR扩增3种草莓病毒引物浓度设置
Table 2 Concentration of primers for 3 strawberry viruses amplified by multiplex RT-PCR
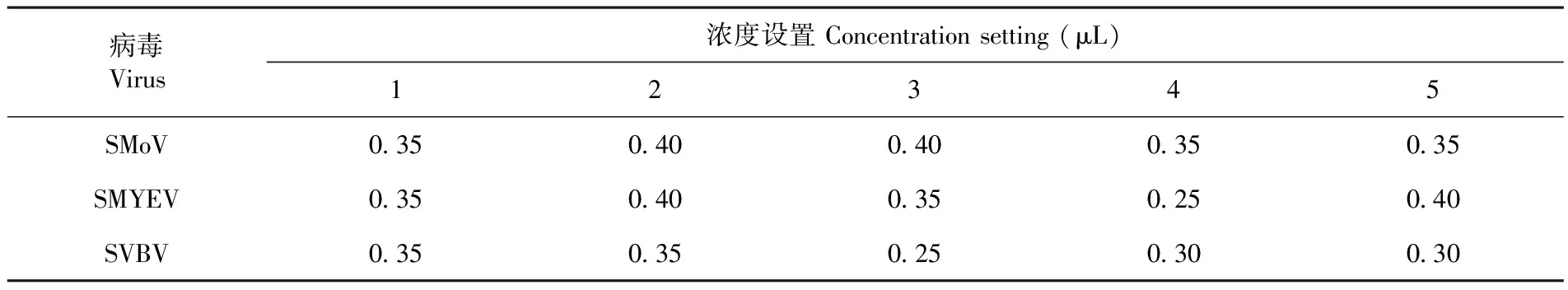
病毒Virus浓度设置 Concentration setting (μL)12345SMoV0.350.400.400.350.35SMYEV0.350.400.350.250.40SVBV0.350.350.250.300.30
1.2.5 新疆草莓主栽区病毒病调查
用单一RT-PCR和多重RT-PCR同时检测草莓斑驳病毒病、草莓轻型黄边病毒病和草莓镶脉病毒病,统计并分析新疆草莓主栽区病毒病感染情况。
2 结果与分析
2.1 草莓总RNA的提取和检测
应用试剂盒提取草莓总RNA,通过琼脂糖凝胶电泳检测可以看出28S和18S条带清晰可见,完整性较好。应用分光光度计测量RNA浓度在 500 ng/μL以上、OD260/OD280在2.0~2.2,所提RNA浓度和纯度较高。图1
2.2 单一RT-PCR检测草莓病毒病
应用四种病毒的特异性引物对反转录的cDNA进行扩增,对PCR产物进行凝胶琼脂糖电泳,SMoV、SMYEV和SVBV特异性引物扩增结果分别获得与目的条带大小(分别为219 bp、547 bp和271 bp)一致的条带。分别对目的片段进行凝胶回收、测序,测序结果在GenBack中进行相似性比对,序列结果显示与NCBI上已上传的的SMoV、SMYEV和SVBV序列相似性分别为96%、93%和95%以上,说明PCR扩增目标片段为相应的病毒基因片段。而用SCV特异性引物对所有样品进行检测,未扩增出目的片段,说明采集的样品中不含有草莓皱缩病毒。图2
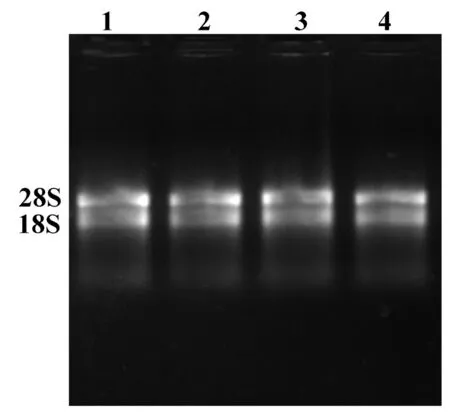
注:1~4: 4个不同草莓样品
Note: Lane 1-4: Four different strawberry samples
图1 草莓组培苗叶片总RNA
Fig.1TotalRNAofStrawberrytissueculture
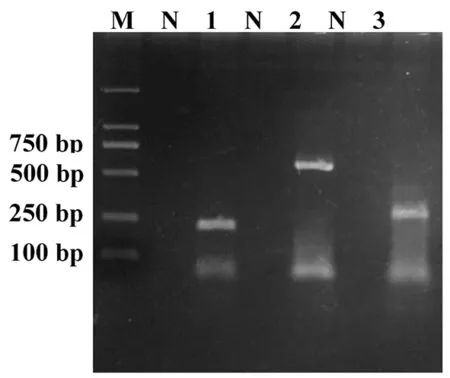
注:M:DL 2 000;N:阴性对照;1:SMoV;2:SVBV;3:SMYEV
Note: Lane M:DL 2,000; Lane N:Negative control; Lane 1:SMoV; Lane 2:SVBV; Lane 3: SMYEV
图2 草莓三种病毒单一PCR
Fig.2 Simple PCR detection of three strawberry viruses
2.3 多重RT-PCR检测草莓病毒病检测体系建立
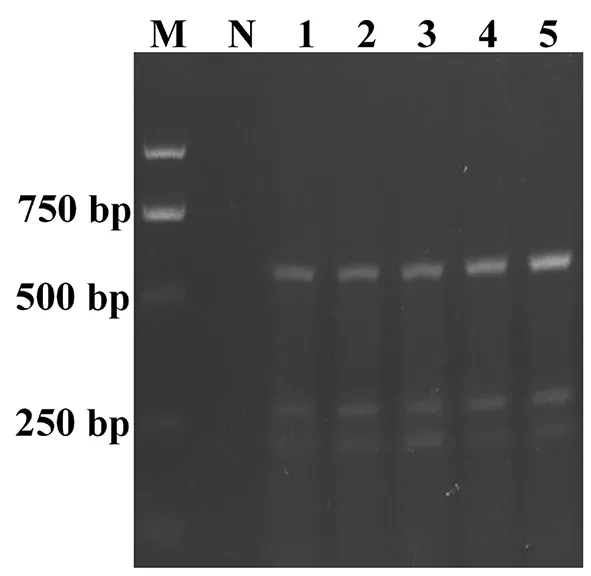
根据单一RT-PCR的检测结果,利用现有引物尝试建立同时检测三种病毒的多重RT-PCR,主要对多重RT-PCR检测体系引物退火温度和引物用量进行优化。其他反应因素不变条件下,对退火温度(53~57℃)进行筛选,PCR扩增产物进行琼脂糖凝胶电泳。研究表明,随着退火温度增加SMYEV和SVBV条带逐渐清晰;而SMoV随着退火温度(53~55℃)的增加条带逐渐清晰,当温度超过55℃时,则SMoV条带逐渐模糊。综合考虑三种病毒引物扩增结果,研究选择最适退火温度为55℃。
同时也对三对引物(SMoV、SMYEV、SVBV)依次加入量进行优化,当分别加入0.35、0.35和0.35 μL时,研究表明,SMYEV和SMoV的条带较弱(泳道1);当SVBV不变,SMYEV和SVBV引物各增加0.05 μL结果显示SMYEV和SVBV条带都亮,SMoV较弱(泳道2);增加SMoV的引物量,SMYEV引物量不变并减少SVBV引物量,结果显示,SMYEV、SVBV和SMoV条带亮度基本相近(泳道3);减少SMYEV和SVBV引物量,SMoV和SMYEV条带都较弱(泳道4);增加SMYEV并减少SVBV的引物量,SMoV仍然较弱(泳道5)。因此,研究使用多重PCR体系SMoV、SMYEV和SVBV三种引物配比为0.4∶0.35∶0.25。图3,图4
注:M:DL 2 000;N:阴性对照;1~5:53、54、55、56和57℃
Note: Lane M:DL 2,000; Lane N:Negative control; Lane 1-5:53, 54, 55, 56 and 57℃
图3 多重RT-PCR退火温度优化
Fig.3 Optimization of anneal temperature of the multiplex RT-PCR
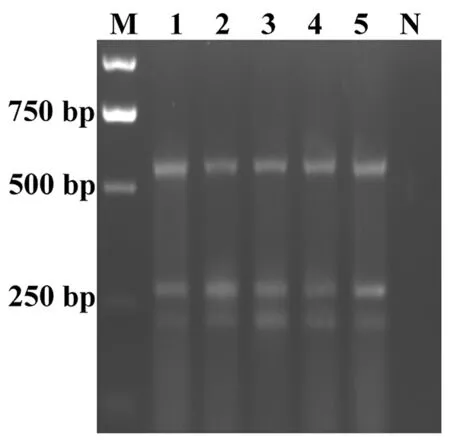
注:DL 2 000;N:阴性对照;1~5:不同浓度组合
Note: Lane M:DL 2,000; Lane N:Negative control, Lane 1-5:Different concentration combinations
图4 多重RT-PCR引物浓度优化
Fig.4 Optimization of primer concentration of the multiplex RT-PCR
2.4 多重RT-PCR检测
对采集的新疆草莓主栽区样品进行SoMV、SMYEV和SVBV多重RT-PCR检测。对多重RT-PCR检测同时单一RT-PCR检测,检测结果进行比较,多重RT-PCR和单一RT-PCR检测结果一致,说明建立的多重RT-PCR体系快速、特异地检测3种病毒。图5
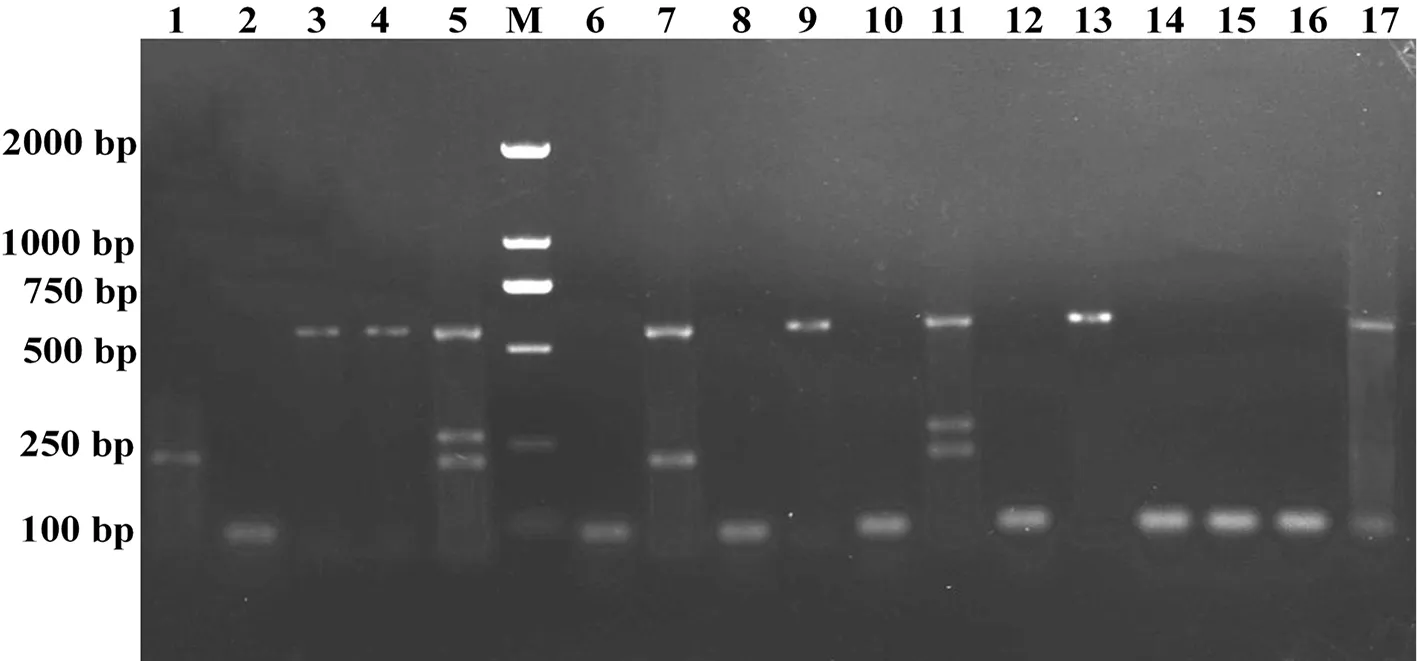
注:M:DL 2 000;1~17:17个草莓样
Note: Lane M: DL 2,000; Lane 1-17: Seventeen strawberry samples
图5 17个草莓样品检测结果
Fig.5 Test results of 17 strawberry samples
2.5 新疆草莓主栽区草莓病毒病检测
利用4种病毒病的特异性引物对采自新疆草莓主栽区的 450 份样品进行检测,并对结果进行统计分析。南北疆各地区采集的样品均检测出含有SMoV、SMYEV和SVBV三种病毒,SCV病毒未检出,病毒总检出率为 64.22%,总检出率达 90% 以上的采集地有安宁渠镇、巩留县以及和静县;检出率较低的十三师各团场和一师各团场,病毒总检出率也在25%以上。在所有样品检测的3种病毒中,SVBV总检出率最高,为51.78%,检出率较高的采集地有安宁渠镇、巩留县与和静县,检出率分别为76.67%、76.67%和73.33%;所有采集地均能检测出SMoV,总检出率为23.78%,安宁渠镇、青格达湖乡、巩留县以及和静县检出率均在40%以上;SMYEV总检出率9.33%只有阿瓦提县、十三师各团场与一师各团场三个采集地未检出SMYEV。三种病毒在南北疆分布没有规律,不同采集地病毒检出率差异明显,同一采集地三种病毒检出率差异较大。表3
表3 各地不同品种病原病毒检出率
Table 3 Detection rates of various pathogenic viruses in different regions and varieties
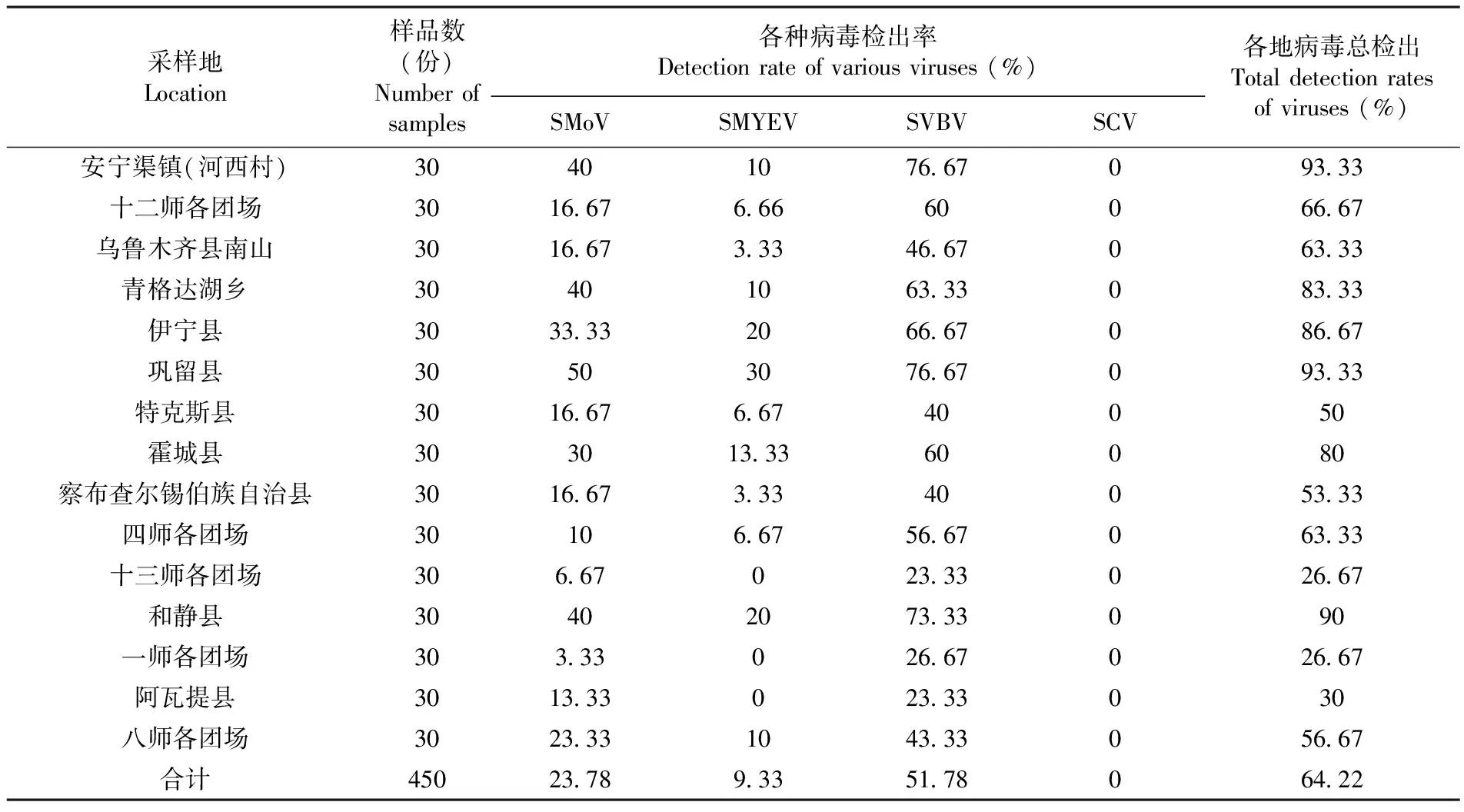
采样地Location样品数(份)Number of samples各种病毒检出率Detection rate of various viruses (%)SMoVSMYEVSVBVSCV各地病毒总检出Total detection rates of viruses (%)安宁渠镇(河西村)30401076.67093.33十二师各团场3016.676.6660066.67乌鲁木齐县南山3016.673.3346.67063.33青格达湖乡30401063.33083.33伊宁县3033.332066.67086.67巩留县30503076.67093.33特克斯县3016.676.6740050霍城县303013.3360080察布查尔锡伯族自治县3016.673.3340053.33四师各团场30106.6756.67063.33十三师各团场 306.67023.33026.67和静县30402073.33090一师各团场303.33026.67026.67阿瓦提县3013.33023.33030八师各团场3023.331043.33056.67合计45023.789.3351.78064.22
通过对所有样品感染三种病毒的复合侵染情况进行统计,检测结果显示,感染两种及两种以上病毒检出率为18.45%,其中,SMoV和SVBV复合侵染最为普遍,总检出率为10.89%;SMYEV与SVBV以及SMoV与SMYEV复合侵染检测率分别为4.22%和1.56%;同时感染SMoV、SVBV和SMYEV三种病毒的采集地只有安宁渠镇、伊宁县、巩留县、霍城县、和静县和八师各团场,总检出率为1.76%。表4
表4 各病原病毒复合侵染率
Table 4 Complex infection rates of various pathogenic viruses
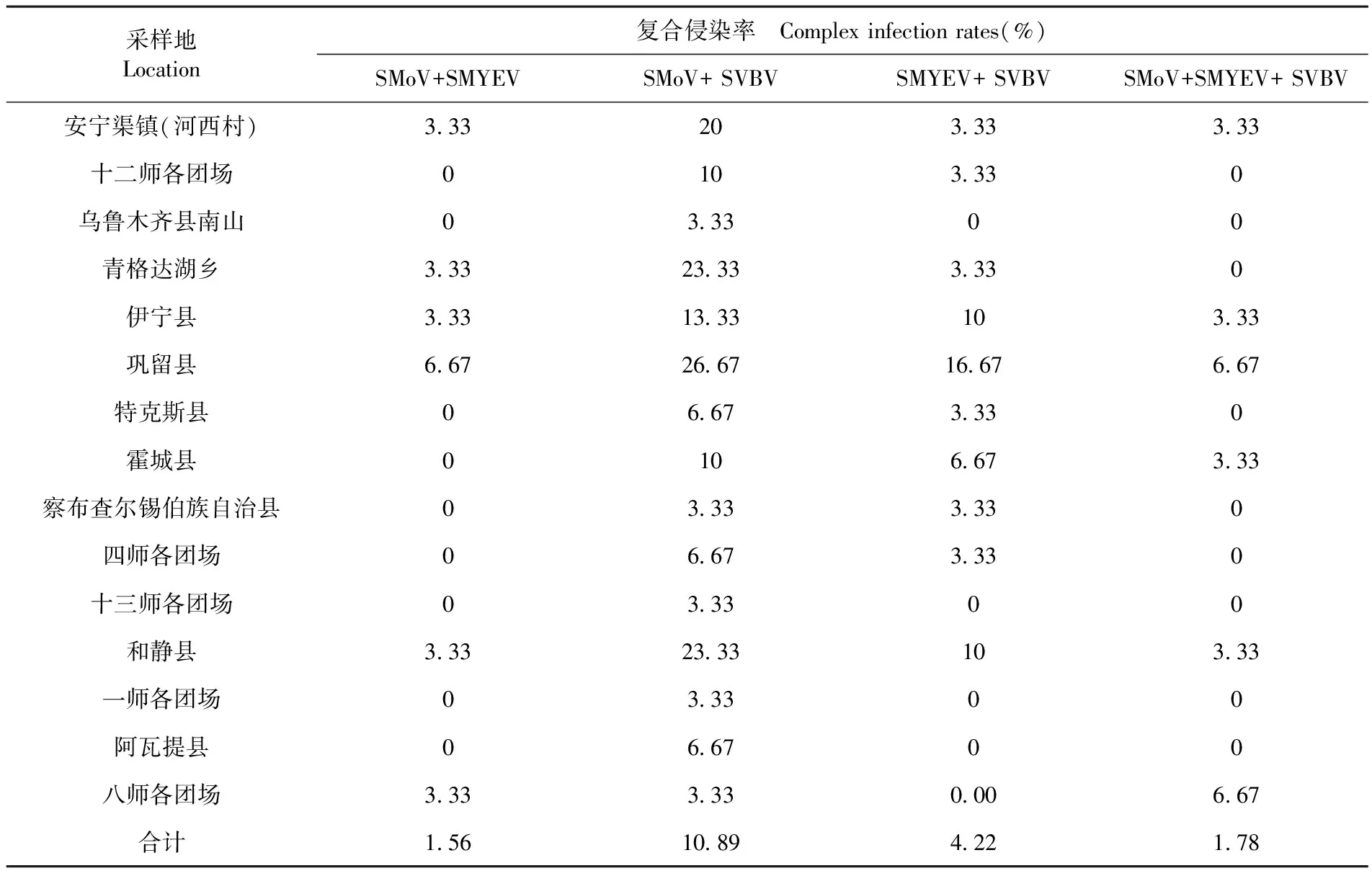
采样地Location复合侵染率 Complex infection rates(%)SMoV+SMYEVSMoV+ SVBVSMYEV+ SVBVSMoV+SMYEV+ SVBV安宁渠镇(河西村)3.33203.333.33十二师各团场0103.330乌鲁木齐县南山03.3300青格达湖乡3.3323.333.330伊宁县3.3313.33103.33巩留县6.6726.6716.676.67特克斯县06.673.330霍城县0106.673.33察布查尔锡伯族自治县03.333.330四师各团场06.673.330十三师各团场03.3300和静县3.3323.33103.33一师各团场03.3300阿瓦提县06.6700八师各团场3.333.330.006.67合计1.5610.894.221.78
3 讨 论
草莓在长期无性繁殖过程中,很容易感染病毒,并且感染草莓的病毒大多具有潜隐特点,单一病毒侵染时一般不表现症状,只有多种病毒复合侵染时植株叶片才表现花叶、皱缩、褪绿黄化以及植株矮化等典型症状[16,17]。因此,田间诊断很难确定病原。
目前,草莓病毒鉴定的方法主要有指示植物小叶嫁接法、电镜检测法、血清法检测法和分子生物学检测法[18]。分子生物学因其灵敏度高(能检测到pg甚至fg水平的病毒)、特异性强、快速、简便等特点,尤其RT-PCR和多重RT-PCR在草莓病毒鉴定方面应用及其广泛[14-15,19,20]。研究利用RT-PCR和多重PCR方法对新疆草莓主要种植区样品,发生最普遍以及危害最为严重的四种病毒进行检测,结果显示,该地区草莓感染多种病毒,4种病毒的检出率SVBV较多,SMoV次之,SMYEV较少,SCV未检出。南北疆不同地区样品带毒率差异较大,同一地区不同采集地样品带毒率也比较明显,并且发病率较高的地区草莓多为自繁苗,如乌鲁木齐安宁渠镇、伊犁巩留县、南疆和静县;引进外地脱毒苗的种植区如十三师各团场、阿克苏第一师各团场、阿瓦提县等草莓病毒种类较少带毒率较低。因此,推广使用脱毒种苗是减少草莓病毒病原最有效的手段。新疆草莓主要栽培品种多从北京、山东等省(市)引进[21,22],研究对新疆草莓病毒病原的检测与调查结果,却和北京、山东等地的调查结果存在差异,内地调查结果多发现SVBV、SMoV、SMYEV以及SCV共同感染草莓,而此次对南北疆15个不同地区采集的草莓样品进行检测,并没有发现SCV[7,9,13]。新疆由于其独特的地理位置以及草莓病毒病种类与分布的复杂性,在新疆草莓种植区栽培的草莓是否感染其它种类的草莓病毒有待进一步研究。
4 结 论
2017年,新疆草莓主栽区病毒病发生率较高,病毒总检出率64.22%,其中镶脉病病毒病检出率最高,总检出率为51.78%;斑驳病毒病和轻型黄边病毒病检出率分别为23.78%和9.33%。南北疆不同草莓栽培区以及相同栽培区不同采集地样品病毒检出率差异较大,无明显的地域特征。在危害草莓最为严重的4种病毒SMoV、SMYEV、SVBV和SCV中,SMoV、SMYEV和SVBV这三种病毒在全疆主栽区均有发生,并且病毒复合侵染率较高。
——关于团场林业发展的思考

