海蜇4个自然群体遗传多样性的微卫星标记分析
狄明玉,周遵春,李云峰,田梅琳,侯红漫,李玉龙,鲍相渤,赫崇波
( 1.大连工业大学 食品学院,辽宁 大连 116034; 2.辽宁省海洋水产科学研究院,辽宁 大连 116023 )
海蜇(Rhopilemaesculenta)广泛分布在中国的东海、黄海、渤海海域,是经济价值最高的可食用水母,具有较高的膳食、医药价值[1-3]。中国作为最早开发利用海蜇的国家,在1700年前就对其进行商业开发。海蜇生长周期短,生长速度快,能够在较短的时间内带来较大的经济效益,亚洲国家海蜇相关产业每年有数百万美元的收益[4]。近几年来,海蜇市场需求持续增大,渔民的过度捕捞、生态环境的破坏及灾害水母的频发等,导致海蜇自然种群结构被破坏,种质退化严重,资源量大幅度下降[5-6]。因此,需要加强对海蜇自然群体种质资源保护的重视,将海蜇种质资源保护的相关研究列为重要研究方向。
分子标记是进行群体遗传学研究的重要工具[7]。其中,微卫星分子标记具有分布范围广、呈共显性遗传、多态性高和重复性好等特点[8-9],在群体遗传多样性分析、种质资源评价、遗传图谱的构建等方面的研究中具有明显的优势[10-11]。本试验利用筛选出的30对多态微卫星位点,对位点采用荧光标记,应用毛细管电泳技术精准检测,对海蜇4个不同地理种群的种质资源现状和亲缘关系进行分析,旨在为海蜇优良种质资源保护和分子遗传育种提供理论基础和数据支持。
1 材料与方法
1.1 材料来源
试验所用的4个海蜇自然群体于2015年7—9月分别采自天津大港[体质量(4.23±0.64) kg]、辽宁盘锦[体质量(3.91±0.65) kg]、江苏射阳[体质量(3.89±0.58) kg]和山东烟台[体质量(4.09±0.54) kg]附近的海域,每个群体随机采集30只活体成蜇,取其伞部组织以及口腕部组织置于95%的酒精中固定,-20 ℃冰箱冷冻保存,用于后续的基因组DNA提取。
1.2 DNA提取
各群体的海蜇个体各称取30 mg组织,采用CTAB法[12]提取基因组DNA,DNA样品用含量为1%的琼脂糖凝胶电泳检测其完整性,用ThermoNanoDrop 2000 分光光度计检测DNA的质量浓度与纯度,将DNA质量浓度稀释到100 ng/μL用于后续的PCR扩增。
1.3 微卫星引物的筛选和PCR扩增
本试验所用的微卫星引物序列获得是基于实验室前期工作[13],由苏州泓迅生物科技有限公司合成。用120对引物进行PCR扩增,PCR反应体系为10 μL,其中包括: 2×Multiplex PCR Master Mix(天根,北京,中国)5 μL,上、下游引物各0.5 μL,15~30 ng的模板DNA,其余体积用超纯水补齐。PCR扩增条件:95 ℃变性5 min;95 ℃热变性30 s,引物各自退火温度下复性30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min。以10个个体为模板,进行PCR扩增,先用1%的琼脂糖凝胶电泳初筛,筛选出有目的条带的引物,之后用8%的聚丙烯酰胺凝胶电泳复筛,筛选出多态性丰富的位点。详细引物信息见表1。
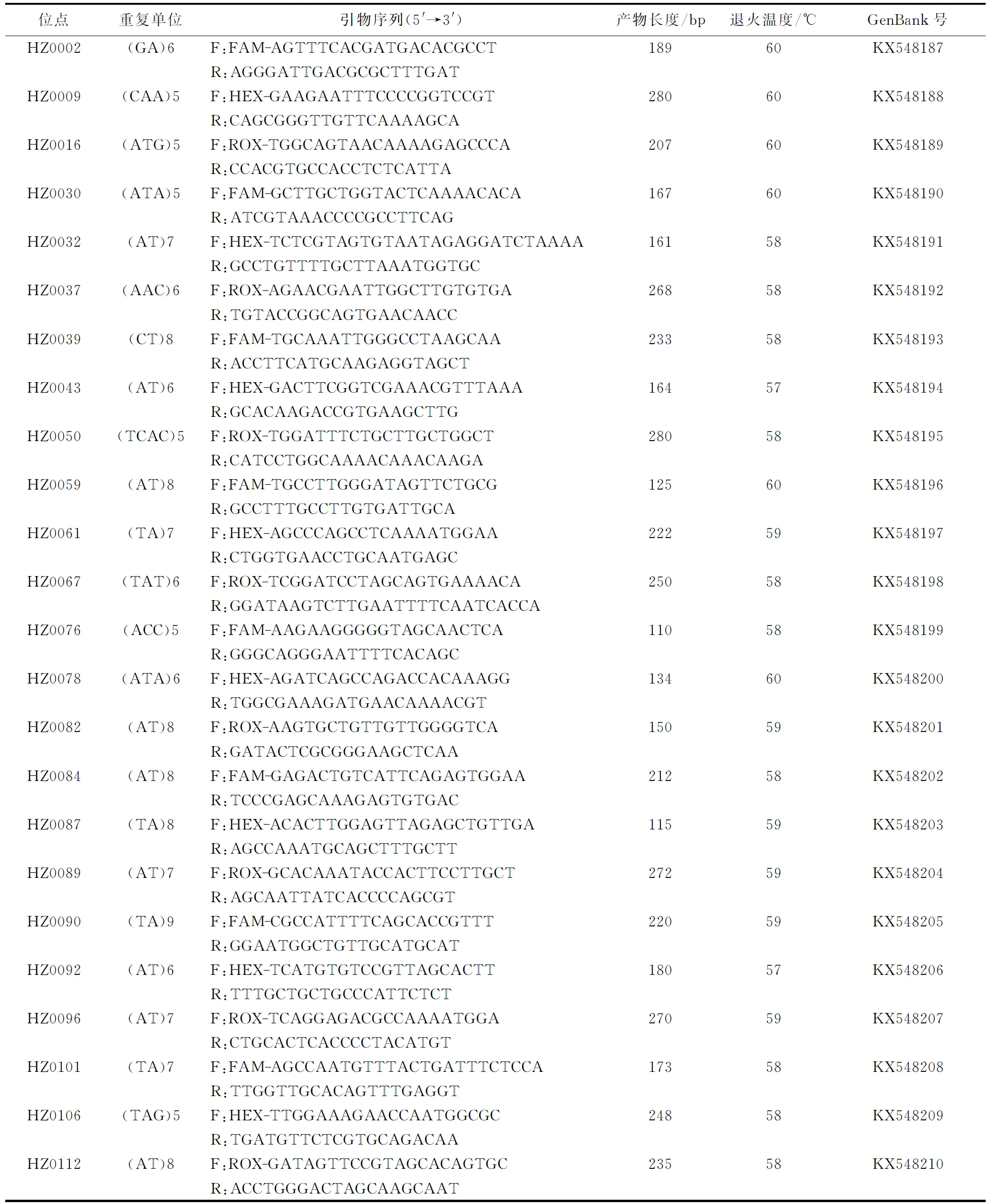
表1 30对海蜇微卫星位点信息

续表1
1.4 荧光标记毛细管电泳分析
根据已筛选出的多态性位点,合成荧光引物。在每对引物上游5′端添加不同的荧光基团(FAM、HEX、ROX),下游为常规碱基序列。将合成的荧光引物溶解,稀释至浓度为2 μmol/L。对4个海蜇群体的120个样品逐一进行每对引物的PCR扩增,之后向ABI3739XL上样进行毛细管电泳分析,通过软件Genemapper输出扩增产物长度图。
1.5 种群遗传性统计分析
根据各微卫星多态性位点的基因片段长度进行基因分型,利用Popgen 3.2计算4个海蜇群体在30个微卫星位点上的等位基因数、观测杂合度、期望杂合度、遗传分化指数、基因流、群体间的遗传距离和遗传相似系数,采用软件Genepop对4个海蜇群体在各个位点进行Hardy-Weinberg平衡检验,利用软件PIC_Calc 0.6计算多态信息含量,基于Popgen 3.2 计算的各个群体间的遗传距离,采用软件Mega 6.0绘制系统进化树。
2 结果与分析
2.1 微卫星位点遗传多样性
从4个海蜇群体整体来看,30个微卫星位点共检测到304个等位基因,每个位点的等位基因个数为4~17个,所有位点的平均等位基因数为10.133,其中位点HZ0009和HZ0067的等位基因均为17个,等位基因数量最多;位点HZ0122的等位基因为4个,数量最少。观测杂合度为0.0252~0.7667,平均值为0.4103;期望杂合度为0.0251~0.8163,平均值为0.5205。30个多态位点的多态信息含量为0.0248~0.7888,平均值为0.4909。通过以上数据可知,这些位点可以有效的进行群体间遗传多样性的分析(表2)。
2.2 4个海蜇群体的遗传多样性分析
由4个海蜇群体的遗传多样性统计信息可知,4个群体的平均等位基因数差距较小,依次为烟台群体(6.8333)、大港群体(6.20)、盘锦群体(4.6333)、射阳群体(4.0333);大港群体的观测杂合度(0.5059)、期望杂合度(0.5986)和多态信息含量(0.5497)均为最高;而盘锦群体的期望杂合度(0.4353)和多态信息含量(0.3902)均为最低;观测杂合度以烟台群体(0.3906)最低。综合这些参数得知,大港群体的遗传多样性最高(表3)。
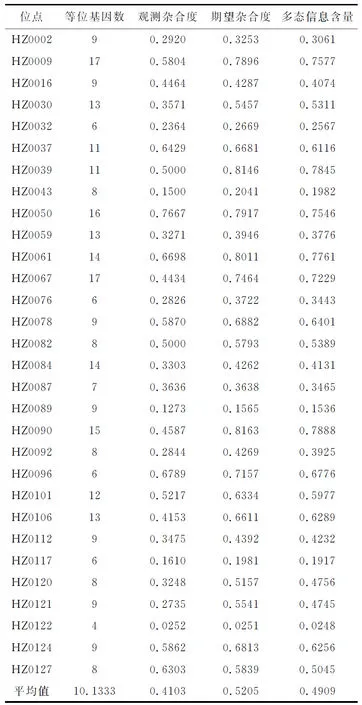
表2 海蜇30个微卫星位点的遗传多样性指数
在120个位点组合(4个群体×30个引物)中,HZ0032和HZ0043在盘锦群体中为单态位点,HZ0122在射阳群体显示为单态位点。对其他的位点进行Hardy-Weinberg平衡检测,发现有83个(70.9%)位点符合Hardy-Weinberg平衡(P>0.05),有34个(29.1%)位点显著偏离Hardy-Weinberg平衡(P<0.05)。
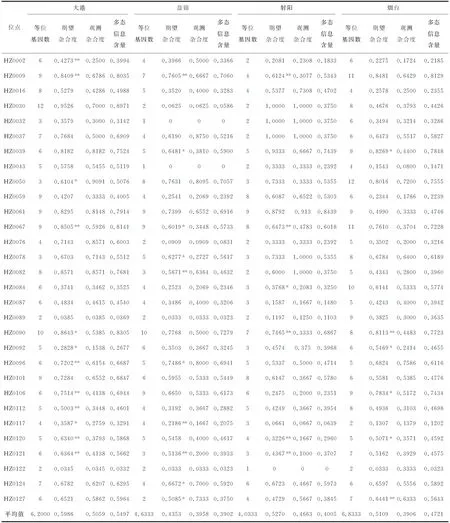
表3 30个微卫星位点在4个海蜇群体中遗传多样性信息
注:*,显著偏离Hardy-Weinberg平衡,P<0.05;**,极显著偏离Hardy-Weinberg平衡,P<0.01.
2.3 群体间遗传结构分析
4个海蜇群体间的遗传分化指数与基因流见表4。群体间的遗传分化指数为0.043~0.068,其中大港群体与射阳群体遗传分化指数最高,为0.068,其次为烟台群体与射阳群体,为0.067,之后为盘锦群体与射阳群体,为0.063,烟台群体与盘锦群体的遗传分化指数最低, 为0.037。群体间的基因流为3.446~6.556,其中盘锦群体与烟台群体的基因流最大,为6.556;其次为大港群体与烟台群体,基因流值为5.528;大港群体与射阳群体间的基因流值最小,为3.446。
由4个群体间的Nei′s标准遗传距离得知,盘锦群体与射阳群体间的遗传距离最远(0.1629),盘锦群体与烟台群体间的遗传距离最近(0.0653)(表5)。系统进化树显示,盘锦群体与烟台群体首先聚成一支,之后与大港群体聚为一支,最后再与射阳群体聚为一类(图1)。
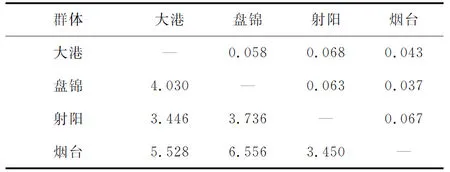
表4 海蜇群体间基因流(对角线以下)和遗传分化指数(对角线以上)
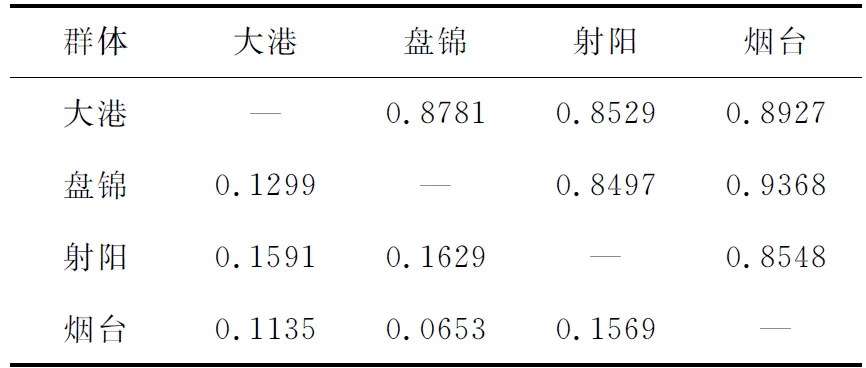
表5 海蜇群体间遗传相似系数(对角线以上)和遗传距离(对角线以下)
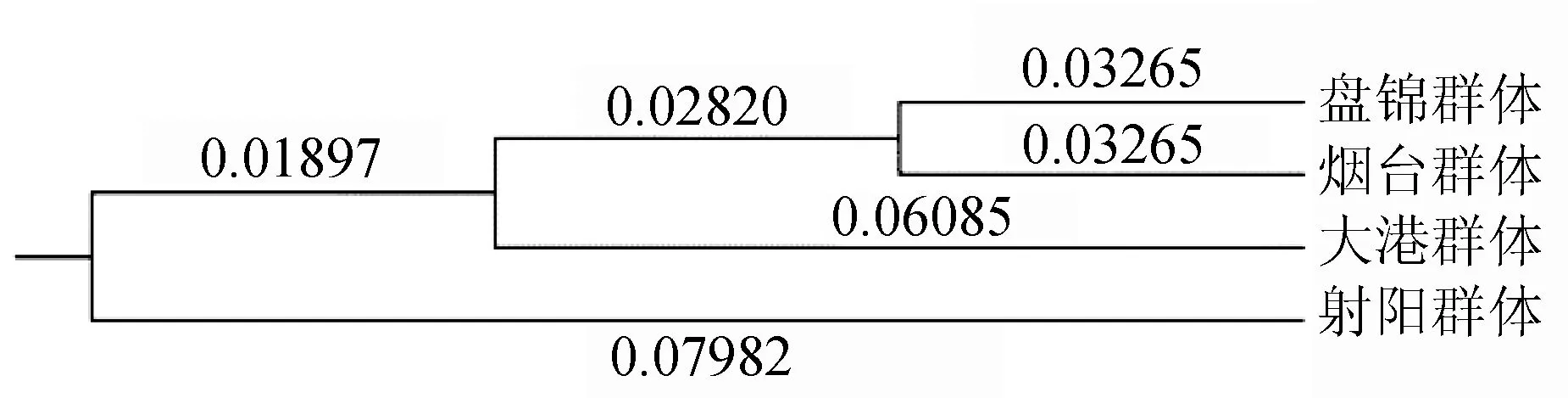
图1 基于Nei′s无偏遗传距离构建的4个海蜇群体的系统进化树分支上的数字代表分支长度.
3 讨 论
3.1 群体遗传多样性分析
遗传多样性是群体维持长期生存和发展进化的前提,也是衡量群体抵御不良环境能力强弱的标准[14]。等位基因数和群体杂合度是对群体遗传多样性水平进行评估的重要参数。有研究指出,对于微卫星位点的选择,等位基因数>4时,可以较好的反映出群体遗传多样性水平[15],本研究中,4个群体的平均等位基因为4.0333~6.8333,该数据能够有效的用于4个群体遗传多样性分析。4个群体的平均观测杂合度为0.3906~0.5059,平均期望杂合度为0.4353~0.5986,表明4个群体的遗传多样性较为丰富。与前期自然海蜇群体、养殖海蜇群体的遗传多样性研究结果相比,本试验4个群体的平均等位基因数均高于前期研究的自然群体(3.120)和养殖群体(2.360);平均观测杂合度也高于自然群体(0.302)和养殖群体(0.180)[13]。造成这一现象的原因可能为,本试验采用的荧光标记毛细管比前期使用的聚丙烯酰胺凝胶电泳的分辨率高,减少了等位基因少读的情况;此外,两个试验所用群体样本不同也可能导致这种现象产生。其中,大港群体的平均观测杂合度(0.5059)和平均期望杂合度(0.5986)均高于其他3个群体,说明大港群体具有较高的变异度,遗传多样性较其他3个群体丰富,抵御不良环境的能力较强,可以用于海蜇分子遗传育种中,可能对种质改良有很大帮助。
多态信息含量是衡量基因位点群体多态性的重要指标之一,可以反映出群体的遗传变异程度[16]。当位点的多态信息含量>0.5时,该位点为高度多态位点;当0.25<多态信息含量<0.5时,该位点为中度多态位点;当多态信息含量<0.25时,该位点为低度多态位点[17]。本研究30个微卫星位点中,有15个位点表现为高度多态位点,11个位点表现为中度多态位点,4个位点表现为低度多态位点。总体来说位点多态性较高,并且位点个数大于25,在群体遗传多样性分析中,得出的结果可靠性较高[18]。对4个群体的多态信息含量计算结果表明,群体的平均多态信息含量为0.3902~0.5497,除大港群体表现为高度多态性外,其他3个群体均表现为中度多态性。
在4个地理群体中均观测到部分位点偏离Hardy-Weinberg平衡,其中大港群体有12个位点,盘锦群体有10个位点,射阳群体和烟台群体均有6个位点。在卢彦先等[13]的自然海蜇群体和养殖海蜇群体的遗传多样性研究中,也存在这种偏离平衡的现象,在两个群体中均有超过50%的微卫星位点偏离Hardy-Weinberg平衡。偏离平衡的原因可能是,海蜇特殊的生长和繁殖方式易造成近亲繁殖,导致群体中杂合子缺失;也可能是无效等位基因的存在引起的。相关的研究表明,微卫星位点偏离Hardy-Weinberg平衡的现象普遍存在于海洋生物中,如鱼类、虾类、贝类等[19-20]。
3.2 群体间遗传分化及遗传距离分析
本研究用遗传分化指数来判断群体间的遗传分化程度,再结合群体间的基因流来分析4个群体间遗传分化的内在机制。根据评价标准,0<遗传分化指数<0.05时,表现为低等分化水平;0.05<遗传分化指数<0.15时,表现为中等分化水平;遗传分化指数>0.15时,表现为高等分化水平[21]。基因流<1,表明分化程度较大;1<基因流<4,表明分化程度中等;基因流>4,表明分化程度较低[22]。本研究的4个群体间遗传分化指数为0.037~0.068,群体间遗传分化指数的均值为0.056,分化水平处于中等以下。除了烟台和盘锦、烟台和大港群体间的遗传分化处于低等分化水平外,其余两两群体间的遗传分化均处于中等分化水平。群体之间遗传分化的存在,对于物种资源的恢复具有重要意义[23]。本研究中,海蜇各个群体之间均存在着不同水平的遗传分化,增加了海蜇自然资源恢复的可能性。4个群体间的基因流为3.446~6.556,均值为4.458。研究发现,一定程度的基因流可以抵制由遗传漂变引起的种群遗传资源的衰退[24]。本研究中,大港与射阳群体间的遗传分化指数最大,基因流最小;在烟台和盘锦两群体间的遗传分化指数最小,基因流最大。
4个群体的Nei′s无偏遗传距离聚类分析结果表明,地理位置较近的盘锦和烟台群体首先聚为一支,再与相对较近同为渤海区域的大港群体聚为一支,最后才与相对较远的射阳群体聚为一类,这与实际的地理分布差距成正相关,即随着距离的变大,遗传距离也随之增大,遗传相似度减小。由此可见,地理距离对海蜇自然群体的遗传分化程度有较大的影响,烟台、盘锦群体相差距离较小,相互之间的基因交流较多,遗传分化程度较低。此结论与群体间遗传分化程度的分析结果一致。
4 结 论
试验结果表明,4个不同地理位置的自然海蜇群体的遗传多样性处于中等偏上水平,同时,各个群体均存在着Hardy-Weinberg平衡的偏离和杂合子缺失现象。为缓解Hardy-Weinberg平衡偏离和杂合子缺失现象,在进行增殖放流时,应对其遗传结构多做了解,尽可能地减少人为因素对海蜇自然种质资源的影响。在海蜇的增养殖工作中,选择遗传潜力大、遗传距离较远的群体作为人工繁殖的亲本,通过优质群体间的交配提高养殖海蜇的经济效益,促进海蜇增养殖产业绿色、健康、可持续发展。

