银杏内生菌对苹果链格孢霉的抑制作用
徐 志 超, 王 璐, 李 静, 孙 铭 琦, 叶 淑 红
( 大连工业大学 食品学院, 辽宁 大连 116034 )
0 引 言
链格孢霉菌能侵染苹果叶片引起叶片黑斑病和落叶病,同时在苹果植株中定殖,在花期侵染花朵从而导致后期果实患霉心病[1]。患有霉心病的苹果在贮藏过程中易出现霉变腐烂现象,造成严重的经济损失[2]。目前常用的苹果霉心病的防治措施主要包括物理套袋和使用化学制剂,但物理套袋方法处理不当会导致雨季果实腐烂,而化学药剂防治存在农残的弊端,故生物防治无毒害等优势越来越引起人们的关注。
内生菌是从植物组织中分离出的内生细菌或真菌,能够产生与宿主相同或相似的生理活性成分[3]。研究表明,多数植物内生菌具有抑菌、抗氧化、抗肿瘤等生理功能[4-5],考虑筛选具有抑菌效果的植物内生菌作为生防菌株,应用于苹果霉心病的防治。银杏是一种药食同源的植物,其提取物中的化学成分有200多种,主要包括黄酮类、萜内酯类、有机酸类等生物活性成分[6]。王祖华等[9]筛选的银杏内生细菌拮抗菌株次级代谢产物对灰霉菌具有明显的抑制作用。对银杏内生真菌的拮抗作用已有研究,但对内生细菌的研究还不够深入。课题组前期从不同区域银杏分离得到银杏内生细菌,实验结果表明其具有广谱的抑菌能力[8]。本实验旨在研究银杏内生菌对苹果链格孢霉的抑制作用机理。
1 材料与方法
1.1 材料与仪器
银杏内生细菌、苹果链格孢霉菌,实验室前期分离保存;肉汤培养基,PDA、PD培养基;超氧化物歧化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)/丙二醛(MOA)试剂盒,南京建成生物工程研究所有限公司。
PHS-3C pH计,TGL-16M高速冷冻离心机,DDS-307A电导率仪,Thermo酶标仪。
1.2 方 法
1.2.1 目标菌株的筛选
选取实验室保藏的10株银杏内生菌,活化制备菌液(106~108CFU/mL),接种于肉汤培养液体发酵,取发酵上清液涂布于PDA平板;接种培养5 d的苹果链格孢霉菌菌饼(直径6 mm)于30 ℃培养3 d,用十字交叉法测定链格孢霉菌落直径[9]。
1.2.2 目标菌株的形态及生理生化鉴定
分别通过淀粉水解实验、油脂水解实验、石蕊牛乳实验检测生理生化指标[10-11]。
1.2.3 发酵液的制备
目标菌株Q7活化培养12 h后,以2%接种量接入肉汤培养基,28 ℃、120 r/min培养3 d。发酵液于8 000 r/min低温离心15 min,取上清液于0.22 μm滤膜过滤,4 ℃备用。
1.2.4 菌株Q7对苹果链格孢霉的抑制作用
1.2.4.1 对苹果链格孢霉细胞膜通透性的影响
称取5 g菌丝体接入100 mL PD培养液中,处理组为PD培养基中加入2 mL发酵液,对照组中加等量无菌水,于30 ℃、20 r/min培养,测定不同时间的电导率[12]。
1.2.4.2 对苹果链格孢霉细胞膜丙二醛含量的影响
称取1.5 g菌丝体接入100 mL PD培养基,30 ℃、120 r/min培养3 d,加入菌株Q7发酵液2 mL,加入等量无菌水作对照,于不同时间测定丙二醛含量[13]。
1.2.4.3 对苹果链格孢霉细胞内代谢酶的影响
发酵液制备同“1.2.4.1”,于不同时间取适量菌体用蒸馏水冲洗后,用滤纸吸干表面水分,准确称量湿菌体质量,按质量比1∶9加入生理盐水,并加石英砂研磨,4 000 r/min 离心,上清液即为10%组织匀浆,加入等量无菌水作对照。使用试剂盒测定相关代谢的酶活力。
2 结果与讨论
2.1 目标菌株的筛选
考察10株银杏内生细菌的抑菌性,如表1所示。选定的内生菌对苹果链格孢霉均表现出较高的抑制效果,其中Q7的抑制效果最强,因此将Q7作为目标菌株进行生理生化鉴定并研究其对苹果链格孢霉的抑制作用。


表1 10株内生菌对苹果链格孢霉的抑制作用
2.2 目标菌形态及生理生化鉴定
镜检结果如图1所示,Q7革兰氏染色呈阴性,菌体形态呈杆状。平板培养菌落形态呈规则圆点,表面光滑,较透明。
生理生化结果表明,Q7对淀粉和油脂的水解能力弱,石蕊牛乳颜色变暗,发酵液呈偏碱性。初步鉴定银杏内生菌Q7属于芽孢杆菌属B.subtilis。

图1 菌体B. subtilis Q7的镜检结果
2.3 B. subtilis Q7对苹果链格孢霉的抑制性
2.3.1B.subtilisQ7对苹果链格孢霉细胞膜通透性的影响
生物细胞膜是一种具有选择性的半透膜,有些抗菌物质能够破坏细胞膜的通透性,从而干扰细胞正常的物质运输[12]。
由图2可知,处理组电导率远高于对照组,说明B.subtilisQ7对链格孢霉细胞膜的破坏较严重。处理组前2 h电导率迅速升高,说明链格孢霉细胞膜遭到严重破坏,胞内电解质外泄,培养液电导率升高[14]。随后链格孢霉出现应激反应,修护被破坏的细胞,表现在4 h后电导率略有降低,随着时间的延长电导率略有升高至基本趋于稳定。
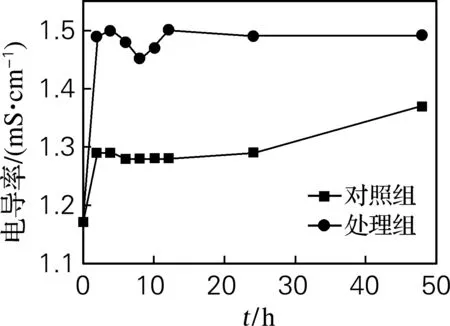
图2 B. subtilis Q7对细胞膜通透性的影响
2.3.2B.subtilis. Q7对苹果链格孢霉脂质过氧化的影响
丙二醛(MDA)是细胞遭受逆境伤害时膜脂过氧化程度大小的主要指标之一[15]。处理组菌丝体中MDA含量明显提高。如图3所示,在9 h达到峰值,比对照组高50%,说明此时处理组菌丝体膜脂过氧化程度最严重,MDA积累量达到最大。9 h后,处理组MDA含量降低,说明苹果链格孢霉对逆境胁迫的抵御作用减弱,细胞活性降低,在24 h后基本处于稳定状态。

图3 B. subtilis Q7对细胞膜MDA质量摩尔浓度的影响
2.3.3B.subtilisQ7对苹果链格孢霉SOD的影响
如图4所示,前3 h处理组SOD酶活力变化与对照组变化趋势基本相同,3 h后处理组SOD活力显著提高,这表明链格孢霉在逆境胁迫下,机体做出应答反应,通过协调酶的活性来保护细胞不受外界环境的影响[13]。随着时间的延长,SOD活力开始减低,在20 h低于正常水平。可能是由于逆境胁迫下机体产生氧自由基含量增加,且细胞膜被破坏,导致酶蛋白外泄,相对SOD活力降低。

图4 B. subtilis Q7对SOD酶活力的影响
2.3.4B.subtilisQ7对苹果链格孢霉POD的影响
如图5所示,处理组的POD酶活力在前6 h迅速提高,说明在逆境胁迫下,机体产生的过氧化物含量升高,从而导致机体POD分泌水平提高。随着时间的延长,细胞膜损伤程度增加,通透性增大,导致胞内蛋白酶的外泄,细胞内POD活力降低,24 h后POD活力趋于稳定,但其活性仅为对照组的一半。

图5 B. subtilis Q7对POD酶活力的影响
2.3.5B.subtilisQ7对苹果链格孢霉PPO的影响
如图6所示,处理组的PPO酶活力迅速降低,在9 h左右,PPO酶活力出现短暂且小幅恢复,但仍远低于正常酶活水平,说明链格孢霉在逆境胁迫下,机体做出应答反应,但其抗逆性较差。12 h后趋于稳定,其活力仅为正常酶活的1/3。

图6 B. subtilis Q7对PPO酶活力的影响
B.subtilisQ7代谢产物对胞内代谢酶活的影响可能有两方面的原因:一是由于B.subtilisQ7代谢产物对苹果链格孢霉细胞膜的破坏,加剧膜脂过氧化程度,使细胞膜的通透性增加,导致胞内酶的外泄;另一方面,B.subtilisQ7代谢产物干扰或抑制酶的合成途径,从而导致整体酶活的降低。
3 结 论
银杏内生菌芽孢杆菌B.subtilisQ7发酵液对苹果链格孢霉具有明显的抑制作用。实验发现,B.subtilisQ7代谢产物提高了苹果链格孢霉细胞膜透性,加剧细胞膜脂质过氧化,影响其体内代谢酶SOD、POD以及PPO的酶活力。B.subtilisQ7 代谢产物所表现的抑菌性质可能与宿主银杏的活性成分(如黄酮、多糖等)相关,今后将继续深入研究B.subtilisQ7发酵液中对链格孢霉起抑制性作用的主要活性物质的类别及生理生化特性,完善银杏内生细菌拮抗作用机制的理论基础。

