海带多酚的提取分离纯化及其体外活性
杨玉莹,王 倩,郝豪奇,赵文英
(青岛科技大学 化工学院,山东 青岛 266042)
随着社会和经济的发展,动脉粥样硬化(atherosclerosis,AS)已成为威胁人类健康的重要杀手之一,但其发生机制仍不明确,目前被人们认可的发生机制主要有内皮损伤学说、脂质侵润学说等[1-3]。因此,临床上常用的治疗AS的药物主要是采用抗氧化来防止内皮损伤,降血脂来预防脂质浸润,而他汀类等药物是临床广泛应用的抗动脉粥样硬化药物,但长期服用对肝功能有一定危害,其他临床常用药物大多为合成药,存在不良反应多或有一定的肝、肾毒性等弊端[4-5],因此,相关天然药物的开发已迫在眉睫。
海带是一种经济和营养价值兼具的多年生海藻植物,食用及药用历史悠久,海带预防和治疗甲状腺肿、降血脂及降血糖等作用在《本草纲目》等著作中均有记载[6]。海带中含有海带多糖、海带多酚等多种物质,有关海带多糖的抗动脉粥样硬化作用研究较多[7-8],而海带多酚仅抗氧化、抗肿瘤、抗菌以及化学防御等作用被研究[9-11],其抗动脉粥样硬化的作用尚未见报道。
因此,本文中,笔者对海带多酚进行提取分离纯化,并对海带多酚的体外抗氧化和降血脂活性进行初步研究,以期为海带资源的综合应用研究以及海带多酚用于抗动脉粥样硬化的治疗提供一定的参考。
1 材料与方法
1.1 材料与仪器
硅胶GF254(化学纯),青岛海洋化工有限公司;无水乙醇(医用级试剂),天津博迪化工股份有限公司;AB-8型大孔树脂及其他试剂,均为市售分析纯。硅胶G254薄层板(自制,硅胶GF254与0.8%羧甲基纤维素钠溶液1∶ 3(g/L)搅匀铺板)。
干海带,购于青岛水产市场,清洗,晾晒烘干,粉碎至0.250 mm后备用。
LG16型雷勃尔高速离心机,北京雷勃尔离心机有限公司;LabTech型紫外分光光度仪,北京莱伯泰科仪器有限公司;RE-5型旋转蒸发仪,上海亚荣生化仪器厂;Q6J3-W1000A型高速万能粉碎机,天津泰斯特仪器有限公司;
1.2 海带多酚的提取、分离与纯化
1.2.1 海带总多酚的提取
取适量粉碎过筛的海带粉,经乙醚脱脂后过滤,滤渣按预实验确定的条件进行超声提取(按料液比1∶ 20,使用体积分数70%的乙醇于30 ℃提取40 min),提取液抽滤,所得滤液经碱沉、酸沉后得中性提取液,使用FeCl3反应[12]对所得海带多酚粗品进行定性鉴别。然后置于-4 ℃冰箱中放置24 h,于3 000 r/min离心5 min,上清液浓缩干燥至恒质量,得海带总多酚浸膏。
1.2.2 海带多酚的薄层色谱鉴别
使用硅胶G254薄层板,以没食子酸D为对照品,以海带多酚提取液(精确配制质量浓度为10.0 g/L)为供试品,展开剂为氯仿-甲醇-甲酸-水(体积比为65∶ 25∶ 3∶ 4),以香草醛-盐酸试液为显色剂,120 ℃烘箱内加热数分钟后,于自然光下检视。
1.2.3 海带总多酚的含量测定
海带总多酚含量采用Folin-Ciocalteu(FC)法[13]测定。取海带多酚样品溶液,依次加入蒸馏水、FC显色剂,摇匀后加入Na2CO3溶液,室温下避光放置,于765 nm处测定吸光度。以没食子酸为标准品建立标准曲线,即Y=0.012 5X+0.046 0 (R2=0.999 2),质量浓度范围为12.26~65.23 mg/L,根据此标准曲线计算多酚含量。平行测定3次。
1.2.4 海带多酚成分的分离和纯化
采用大孔树脂AB-8型柱吸附法对海带中多酚成分进行分离纯化。
以体积分数30%乙醇溶液为溶剂,将海带多酚样品配制成0.1 g/mL的样品液。以1 mL/min的流速向树脂柱中加入样品液,吸附饱和后,先使用去离子水洗掉大部分水溶性杂质,再使用不同体积分数的乙醇溶液作为洗脱剂进行梯度洗脱。分段收集洗脱液于已编号的小玻璃管中(每管20 mL),当收集到的液体无FeCl3颜色反应后,换洗脱液(流速1 mL/min)。以各玻璃管编号(洗脱体积)为横坐标,多酚含量为纵坐标,绘制解吸曲线。
1.3 海带多酚体外活性研究
1.3.1 清除DPPH·能力
精密称取20 mg海带多酚各组分样品,以30%乙醇定容至100 mL,配制质量浓度分别为0.1、1.0和5.0 mg/mL的样品溶液。
参照文献[14]方法并进行适当修改。移取各样品溶液2 mL以及同体积DPPH·溶液(5×10-5mol/L,溶解于无水乙醇)混合,摇匀,静置30 min,517 nm处测其吸光度(A)。以相应溶液作为空白对照(A空白),各样品各浓度An设3组平行,计算各组分清除DPPH·的清除率,见式(1)。
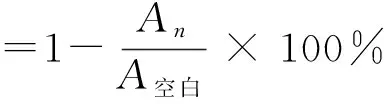
(1)
1.3.2 清除·OH的能力
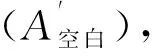
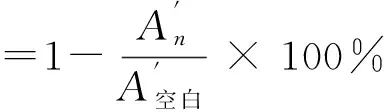
(2)
1.3.3 抗亚油酸氧化能力
采用硫代巴比妥酸反应物(TBARs)法[16]衡量海带各组分抑制脂质过氧化的能力。
配制质量浓度1.0 mg/mL的样品溶液。海带各组分样品溶液中,依次加入亚油酸溶液、磷酸盐缓冲液(PBS,0.05 mol/L,pH=7.4)及去离子水,混匀,避光培养,以无水乙醇作为空白对照。
每隔24 h,从上述溶液中精确取样1.0 mL,加入三氯乙酸溶液,静置,加入硫代巴比妥酸溶液,混匀,沸水浴加热。室温下冷却后加入正丁醇,摇匀并离心,上清液在532 nm处测定吸光度,连续测定10 d。设3组平行,计算各组分的抗亚油酸氧化能力。
1.3.4 体外降血脂活性初步研究
配制质量浓度1.0 mg/mL的样品溶液。向模拟体内肠环境的溶液中加入1 mL各样品溶液,各样品溶液中分别加入牛磺胆酸钠溶液(1 mmol/L,以pH 6.24的PBS配制),37 ℃振荡消化,离心,取上清液以备分析。以同浓度考来烯胺的60%乙醇(体积分数)溶液为阳性对照,60%乙醇溶液为空白对照。

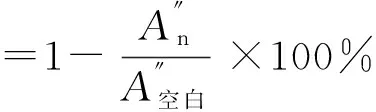
(3)
2 结果与讨论
2.1 海带多酚的提取、分离与纯化
2.1.1 海带多酚粗品的薄层色谱(TLC)鉴别
点样、显色后的薄层板如图1所示。由图1可知:样品相应斑点与没食子酸斑点的位移相同,结合酚类物质在加入FeCl3后特有的蓝绿色颜色反应,可以判定所提取出的海带多酚粗品具有酚类物质的共性。

A—没食子酸标准品;B—海带总多酚样品1;C—海带总多酚样品2图1 海带多酚的薄层色谱Fig.1 TLC of polyphenols in Laminaria japonica
2.1.2 海带多酚成分的分离和纯化
使用AB-8型大孔吸附树脂,不同体积分数的乙醇溶液作为洗脱剂进行梯度洗脱,分段收集洗脱液于接收管中并依次编号(每管20 mL),洗脱液的淋洗顺序依次为15%乙醇、30%乙醇、45%乙醇、60%乙醇、75%乙醇和90%乙醇。大孔树脂洗脱液中,海带多酚含量随接收管编号(洗脱液体积)变化曲线见图2。结合TLC实验,将相同斑点位置的各管样品收集液合并,并分别命名为Fr1、 Fr2、 Fr3、 Fr4和 Fr5。

15%乙醇(1~16号);30%乙醇(17~45号);45%乙醇(46~96号);60%乙醇(97~143号);75%乙醇(144~183号);90%乙醇(184~202号)图2 海带多酚解吸曲线Fig.2 Desorption curve of polyphenol compositions in Laminaria japonica
由图2可知:随着洗脱液极性的变化,不同极性的海带多酚依次被洗脱出来,呈现出5个较为明显的峰。根据大孔树脂分离原理,先被洗脱下来的多酚成分具有较大的极性及分子量,而多酚的极性及分子量受多酚聚合度的影响,聚合度越大,其极性和分子量越大。随着洗脱液中乙醇比例的增大(即流动相极性的减小),洗脱下来的多酚成分极性和分子量逐渐减小,聚合程度逐渐降低,最终多酚按照分子量大小的差异以及不同极性组分容量因子的不同先后被洗脱出来,从而实现多酚组分的相互分离。
2.2 海带多酚体外活性研究
2.2.1 海带多酚各组分清除DPPH·能力
考察海带多酚各组分对DPPH·的清除率,结果如图3所示。由图3可知:在所考察的质量浓度范围(0.1~5.0 mg/mL)内,海带多酚组分Fr5的抗氧化能力最强,其对DPPH·的清除率分别为5.74%、12.79%和13.64%,其次为Fr4(4.89%、9.12%和11.35%),Fr3(4.58%、6.99%和6.53%),Fr2(1.20%、1.65%和2.44%),Fr1(0.68%、0.87%和2.04%),且海带多酚各组分的抗氧化能力随着浓度的升高而增强。海带多酚提取物Fr1、Fr2在低、中浓度时几乎无DPPH·清除能力,在高浓度时有微弱的抗氧化能力,而Fr3、Fr4和Fr5即使在低浓度仍具有较明显的抗氧化能力。因此可以推测,海带多酚的分子量或极性越小,抗氧化能力越强,这可能是由于多酚聚合程度影响了其空间构象,从而影响了酚羟基的活性。
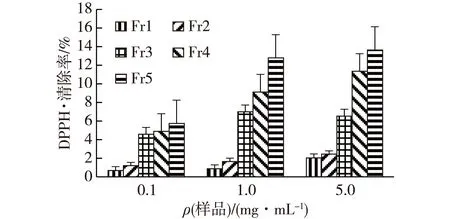
图3 海带多酚组分的DPPH·清除能力Fig.3 DPPH· scavenging activities of different poly- phenols compositions in Laminaria japonica
2.2.2 海带多酚各组分清除·OH能力
考察海带多酚各组分对·OH的清除率,结果如图4所示。由图4可知:海带多酚组分Fr5的抗氧化能力最强并且其对·OH的清除率与样品浓度呈正相关,在所考察的范围(0.1~5.0 mg/mL)内,对·OH的清除率依次为5.74%、12.79%和15.64%,其次为Fr4(4.89%、9.12%和12.35%),Fr3(5.47%、8.17%和11.01%),Fr2(0.28%、2.27%和2.66%),Fr1(0.23%、0.54%和0.92%)。本实验得出的海带多酚·OH清除能力结果与上述DPPH·清除率的测定结果几乎一致,即同种浓度下,海带多酚组分清除·OH能力大小顺序为Fr5、Fr4、Fr3、Fr2、Fr1。

图4 海带多酚组分的·OH清除能力Fig.4 ·OH scavenging activities of different polyphenol compositions in Laminaria japonica
2.2.3 海带多酚各组分抗亚油酸氧化能力
生物膜脂质中含有较多的多不饱和脂肪酸,易发生脂质过氧化而产生有细胞毒性的脂质过氧化物,损伤膜的功能与结构,破坏人体细胞正常生理功能,引起动脉粥样硬化等多种疾病。因此,以含共轭双键的亚油酸为模型,实现海带多酚的抗脂质过氧化能力大小的测定具有重要意义。
采用硫代巴比妥酸反应物(TBARs)法测定海带多酚各组分抗亚油酸氧化活性,结果如图5所示。由图5可知:海带多酚各组分均具有一定的抗亚油酸氧化能力,且在实验考察的前5天,抗亚油酸氧化能力与时间呈正相关,各组分抗氧化能力大小的顺序为Fr3、Fr5、Fr4、Fr1和Fr2。在第5~8天,各组分的抑制能力变化趋于平缓,从第8天开始,所有组分的抗亚油酸氧化能力均呈下降趋势,这说明随着样品消耗量的增多,亚油酸自身氧化的速度和程度高于各组分抗亚油酸氧化的速度和程度,亚油酸被继续氧化。因此,海带多酚各组分可连续7 d保持抗亚油酸氧化作用。
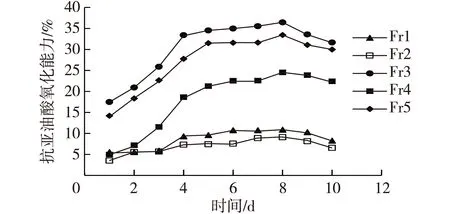
图5 海带多酚组分抗亚油酸氧化活性测定Fig.5 Anti-linoleic acid oxidation of different polyphenol compositions in Laminaria japonica
2.2.4 海带多酚体外降血脂活性的初步研究
通过测定海带多酚各组分结合牛黄胆酸钠的能力,对其体外降血脂活性进行初步研究,结果如图6所示。由图6可知:在相同条件下,Fr1及Fr2与牛磺胆酸钠无结合能力(分别为0.73%、0.93%),Fr3结合能力较微弱(4.58%),而Fr4和Fr5虽具有结合能力且结合能力基本相近(分别为15.26%、17.11%),但仍不及阳性对照药物考来烯胺(48.56%)。这说明经AB-8型大孔树脂的分离纯化,高极性的多酚组份(Fr1、Fr2及Fr3)不含有结合牛磺胆酸钠的有效成分,而中低极性的多酚组分(Fr4、Fr5)则含有相应的有效成分,这可能是由于海带多酚的聚合程度影响了其酚羟基的数目,从而影响了其空间作用力,进而影响了它们与牛磺胆酸钠的结合能力。此结论在Zhou等[17]的研究中也得到证实,牛磺胆酸钠的3个羟基能以离子键或氢键的形式与酚羟基相互作用。

图6 海带多酚组分结合牛磺胆酸钠能力的比较Fig.6 Comparition of the binding capacity of different polyphenol compositions in Laminaria japonica to sodium taurocholate
3 结论
使用超声法对海带多酚进行提取,经AB-8型大孔树脂洗脱后,可将海带多酚按照聚合度或极性大小分成5个不同的组分(分别命名为Fr1、Fr2、Fr3、Fr4和Fr5),初步实现了海带多酚的分离纯化,说明AB-8型大孔树脂适于海带多酚的分离和纯化。在对海带多酚体外活性的研究中,聚合度大(分子量大或极性大,如Fr1、 Fr2)的多酚组分几乎没有抗氧化(0.68%、0.28%)或降血脂(0.73%、0.93%)活性,而聚合度小(分子量小或极性低,如Fr5)的多酚组分作用能力较强(抗氧化及降血脂活性分别可达15.64%、17.11%),说明海带多酚的体外活性随其聚合程度的降低而呈现升高的趋势。
本研究为海带资源的应用研究以及海带多酚抗动脉粥样硬化的作用研究提供了一定的参考,其他与海带多酚成分发挥药理活性的作用机制有待进一步进行多酚构效关系的探究。

