一株耐盐酵母的分离、鉴定及其生物学特性
韦元琪,钱 旭,雍晓雨,2,贾红华,2,周 华,蔡 恒
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京工业大学 生物能源研究所,江苏 南京 211800)
在现代发酵工业中,浓醪发酵在生产中的应用越来越受到关注[1]。例如,越来越多的以生产酱油、面酱、辣酱等食品的生产企业在生产后期常采用高盐稀态发酵[2],然而,在高盐条件下发酵,会导致发酵菌株细胞内水活度降低、细胞质的组成发生变化并伴随细胞膜损伤等,从而抑制了发酵的后续工艺[3-4]
van der Sluis等[5]在酱油酿造过程中通过后期添加耐盐酵母进行高盐稀态发酵,显著改善了酱油的风味。谢韩等[6]将含有耐盐酵母的生酱油接入低盐固态原油中再发酵1个月,检测发现,酱油中还原糖含量下降30%,乙醇含量上升到0.50%~0.86%,酱油明显变得酯香浓郁、鲜甜适口、口味绵长。因此,从自然界中筛选出具有耐盐性能的优良酵母具有良好的工业应用前景[7]
Na+在高浓度条件下对细胞具有毒害作用,可致细胞死亡[8],而耐盐酵母的高盐耐受性的机制已得到广泛研究。有研究指出,耐盐酵母在高盐条件下会合成一些兼容性物质,如海藻糖,或提高一些酶的活力,以此来抵抗外界不良环境[9]。其中,海藻糖具有“生命之糖”的美称,它能增加生物膜、蛋白质和核酸等生物大分子的结构稳定性,使耐盐酵母能够抵抗外界不利环境。Hottlgerh等[10]认为海藻糖是通过与蛋白表面亲水基团结合,抑制蛋白质疏水基团的暴露,进而抑制热激所致的蛋白质非特异性凝聚,达到增加蛋白质稳定性的效果。Simola等[11]认为海藻糖可与变性蛋白结合,维持其半折叠状态,协助Hsp104(热休克蛋白104)重新折叠变性蛋白,赋予耐盐酵母对高渗环境的耐受性。此外,ATPase的活性也是衡量酵母是否具有耐盐性的1个指标。ATPase是一种重要的膜蛋白,位于细胞膜内侧,主要功能是催化细胞内三磷酸腺苷(ATP)水解并伴随将胞内H+泵出胞外,建立跨膜电化学梯度,用以驱动菌体生长所需营养物质的主动运输,对维持细胞结构稳定具有重要的作用[12]。此外,膜上一些有毒离子的转运蛋白(如ENA1-5p)也需要ATP的水解提供能量才能发挥作用,因此,ATPase活性的大小对酵母耐盐性也具有一定的作用。细胞抗高盐的机制研究虽然取得了诸多成果,但仍有一些不明之处,例如,液泡的区隔化作用是一个大液泡还是分裂成几个小液泡耐盐效果更好[13]?是海藻糖还是海藻糖合成途径中关键基因TPS1对酵母的耐盐性影响更大[14]?
本研究中,笔者从酒曲中筛选出1株具有高盐耐受性的酵母菌株,采用26S rDNA对其进行分子鉴定,并对其生物学基本特性及耐盐性进行初步研究,以期为后续酵母细胞耐盐机制的研究及应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品
酒曲由南京洋河酒厂提供。
1.1.2 培养基
富集培养基:麦芽汁培养基,广东环凯微生物有限公司。
YPD培养基:酵母膏 5 g/L,蛋白胨 10 g/L,葡萄糖 20 g/L,自然pH,去离子水定容至1 000 mL,灭菌待用。
盐浓度梯度培养基:共设置3个盐浓度梯度,分别为含1.0、1.2和1.4 mol/L NaCl的YPD培养基。
氯化三苯四唑(TTC)显色培养基:上层培养基为TTC 0.005 g/L,葡萄糖0.05 g/L,琼脂0.15 g/L,调pH至6.0;下层培养基为YPD培养基。
发酵培养基:葡萄糖200 g/L,蛋白胨20 g/L,(NH4)2SO41 g/L,KH2PO41 g/L,MgSO4·7H2O 1 g/L,pH自然,灭菌待用。
1.2 筛选方法
1.2.1 预处理与富集
样品的预处理:称取10 g酒曲样品,加入50 mL 装有适量灭菌玻璃珠的无菌水中,200 r/min处理6 h混匀样品。
酵母菌的富集:取2 mL样品悬液接入酵母富集培养基中,于30 ℃、180 r/min条件下培养过夜,之后采用梯度培养,最终在NaCl为1.4 mol/L的条件下30 ℃、180 r/min培养,以富集其中的耐盐酵母。
1.2.2 耐盐酵母的一级筛选
将菌株富集液逐级接种于1.0、1.2、1.4和1.6 mol/L NaCl 液体培养基中,在1.6 mol/L条件下,其生长受到显著抑制,所以选择1.4 mol/L为筛选条件,并在该条件下培养过夜后将菌悬液稀释涂布于1.4 mol/L NaCl的YPD平板上,30 ℃培养72 h,待长出菌落后倒入TTC上层培养基,避光放置2~3 h。比较各菌落颜色的深浅,颜色呈深红色的说明具有较好的呼吸能力。挑选显色明显的酵母菌落,多次划线分离纯化后甘油管保存[15]。
1.2.3 二级筛选
将一级筛选获得的酵母菌分别接入带有杜氏小管的不同YPD液体试管中,分别在12、24、36和48 h 时观察杜氏小管中的产气情况,产气越多说明菌株生长越旺盛。
1.2.4 三级筛选
将二级筛选获得的18株酵母过夜培养后,按体积分数10%的接种量转接到发酵培养基中,30 ℃厌氧培养48 h后,用生物传感仪测量发酵液中的残糖量,根据残糖量的多少来判定发酵的好坏。
1.3 酵母的鉴定
1.3.1 形态与培养特征
菌株接种到 YPD 液体培养基中,30 ℃培养过夜,制水浸片于显微镜下观察酵母细胞形态。同时将该菌株在YPD琼脂培养基上涂布,30 ℃培养 3~4 d后,观察其菌落形态。
1.3.2 分子生物学鉴定
使用TaKaRa公司的Yeast DNA Kit 试剂盒提取酵母的基因组DNA,利用通用引物(上游:5′-T-C-C-T-C-T-A-A-A-T-G-A-C-C-A-A-G-T-T-T-G-3′,下游:5′ -GG-A-A-G-G-G-A-T-G-T-A-T-T-T-A-T-T-A-G -3′)进行26S rDNA基因的PCR扩增,PCR产物经纯化后送南京金斯瑞生物科技有限公司测序,最后将测序结果进行 BLAST比对,并用MEGA5软件进行系统发育树的构建。
1.4 酵母生物学特性研究
1.4.1 生长曲线的测定
以2%(体积分数)的接种量接种于普通YPD培养基中,在30 ℃、180 r/min条件下培养,每隔2 h取1次样,以蒸馏水做空白对照,测量OD600,每组3次平行实验。以时间为横坐标,OD600为纵坐标绘制目标菌株生长曲线。
1.4.2 温度对酵母菌生长的影响
以2%的接种量接种于普通YPD培养基中,分别在25、28、30、32和35 ℃条件下,180 r/min培养过夜后测量OD600。以时间为横坐标,OD600为纵坐标绘制曲线。
1.4.3 pH对酵母菌生长的影响
以2%的接种量接种于普通YPD培养基中,分别在pH 3.5、4.0、4.5、5.0、5.5、6.0、6.5和7.0条件下,180 r/min培养过夜后测量OD600。以时间为横坐标,OD600为纵坐标绘制曲线。
1.5 测定方法
1.5.1 发酵液中残糖量的测定
利用SBA-40E型生物传感仪(山东省科学院生物研究所) 进行测定,根据操作说明,用进样针对发酵液进行进样,待读数稳定后直接读数。
1.5.2 胞内海藻糖含量的测定
参照文献[16]方法绘制出海藻糖标准曲线,结果为y=0.040 6x-0.007 4,R2=0.998 7,并根据这一曲线测出待测样品中海藻糖的含量。
1.5.3 酵母细胞质膜ATPase活性的测定
1)无机磷标准曲线的绘制。参照文献[17],采用无机磷标曲法测定ATPase的活性。首先测出标准曲线,结果为y=0.737 2x+0.017 5,R2=0.997 8。
2) 质膜提取物的制备。参照文献[18-19]中的方法对酵母质膜进行提取以及膜蛋白含量的测定。
3) 酶活测定。反应体系为1 mL,50 mmol/L MES缓冲液(用Tris调pH为5.5)(10 mmol/L MgSO4、50 mmol/L KCl、5 mmol/L叠氮化钠、0.2 mmol/L钼酸铵、100 mmol/L KNO3,加入0.5 mL 质膜提取物)。体系于30 ℃恒温水浴保温6 min,然后加入底物 ATP 2 mL(使其在反应体系中的浓度为2 mol/L)启动酶促反应,加入终浓度为4 mmol/L 的 ATP启动酶促反应,反应10 min。后加入2 mL 含0.5% SDS和0.5% 钼酸铵的2% H2SO4溶液以终止酶促反应。然后离心取上清,加入40 μL 10% 维生素C以还原磷钼酸,30 ℃中保温5 min后,于750 nm 波长处测定以定量酶促反应释放出的无机磷光密度。
2 结果与讨论
2.1 耐盐酵母的筛选
2,3,5-氯化三苯基四氮唑(TTC)是一种显色剂,它可以与酵母的代谢产物发生显色反应,因此,可以通过TTC反应后颜色的深浅判断酵母中呼吸酶的活力。首先,通过NaCl浓度梯度富集培养和TTC的显色反应(一级筛选),共筛选出18株颜色较红、菌落较大的酵母菌株;接着,将这18株菌株进行杜氏小管产气实验(二级筛选),结果见表1。
由表1可知:18株待选酵母菌株中,有6株产气能力较强,即生长较快,分别为14号、17号、18号、23号、49号和58号,将这6株菌株纯化后保存待用。
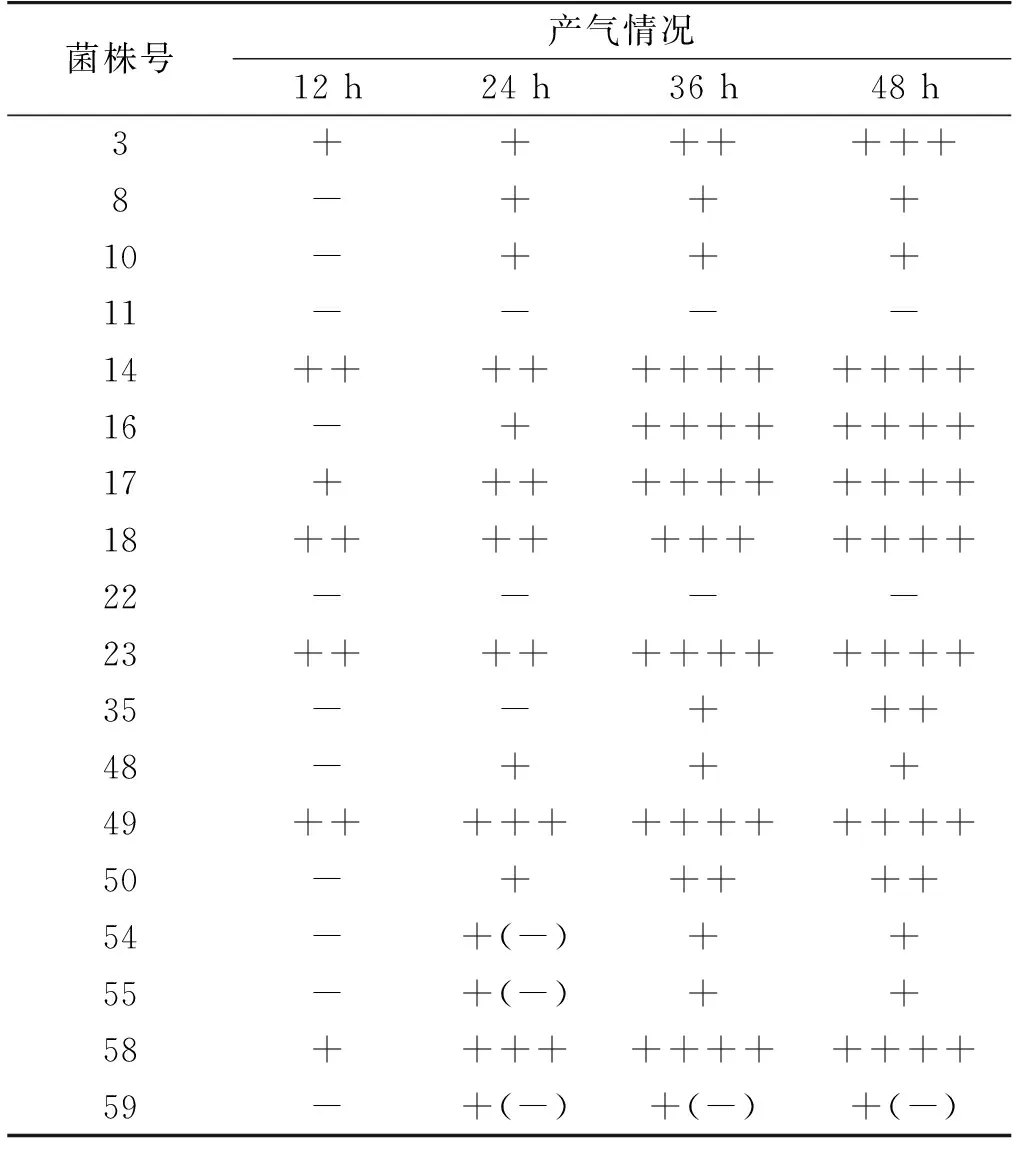
表1 产气实验结果
注:“+”是指杜氏小管的1/4容量,“-”是指没有气体产生,“+(-)”是指不足杜氏小管1/4容量。
2.2 发酵试验
将二级筛选获得的6株酵母菌株进行葡萄糖发酵实验,测量其发酵后的残糖,挑选出葡萄糖利用效率最高且发酵性能最佳的酵母菌株,结果见表2。

表2 发酵液中的残糖量
由表2可知:摇瓶发酵结束后,发酵液中残糖浓度最低的是菌株W58(0.46 mg/mL),说明其葡萄糖利用率最高,发酵性能最好,其葡萄糖利用率比菌株W18高69%。因此,本研究选取菌株W58进行种属鉴定及生物学特性研究。
2.3 菌种鉴定
2.3.1 形态观察以及镜检结果
将菌株W58稀释涂布于普通YPD平板,置于30 ℃培养箱中培养2 d,观察菌落形态,结果见图1。由图1可知,菌株W58的菌落呈乳白色、毛绒状,在显微镜下观察该菌株呈椭圆型。

图1 酵母菌株W58的平板菌落形态观察及镜检结果Fig.1 Morphological observation and microscopic examination results of strain W58
2.3.2 分子生物学鉴定
在真菌的鉴定工作中,对菌株的26S rDNA基因进行测序和比对分析是一种常用的分子鉴定方法,其中用于扩增26S rDNA 基因片段的PCR引物对是根据真菌26S核糖体亚基编码基因的保守区域设计的。对菌株W58进行26S rDNA基因进行测序,并将其26S rDNA 基因序列上传至NCBI数据库进行BLAST比对,下载相关的基因序列构建进化树,结果如图2所示。由图2可知:菌株W58与库德里阿兹威氏毕赤酵母(Pichiakudriavzevii)具有最高的同源性,同源性达到97%,因此将其鉴定并命名为PichiakudriavzeviiW58。

图2 菌株W58基于26S rDNA基因序列构建的系统发育树Fig.2 Phylogenetic tree based on partial 26S rDNA gene sequences of W58 and reference strains
2.4 生物学特性
2.4.1 生长曲线
测定菌株W58生长性能并绘制生长曲线,结果见图3。
由图3可知:菌株W58的生长周期分为明显的延滞期、对数期、平稳期和衰亡期。该菌大约有4 h的延滞期,在这一时期细胞数无明显变化;4 h之后进入对数期,细胞开始快速生长,细胞数呈指数增长;12 h后细胞进入稳定期,在这一时期细胞数量变化不大;28 h后,细胞开始进入衰亡期,细胞数目开始下降。这一特性与大部分已报道酵母的生长特性相似。

图3 菌株W58的生长曲线Fig.3 Growth curve of strain W58
2.4.2 温度对酵母菌生长的影响
温度在酵母的生产及发酵过程中有着至关重要的作用,其影响具体表现在对细胞内酶活性的影响、对细胞质及细胞膜流动性的影响以及对物质溶解度的影响等方面。酵母的活动最适温度为 20~30 ℃。当温度达到 20 ℃时,酵母菌的繁殖速度加快,在 30 ℃时达到最大值,而当温度继续升高达到 35 ℃时,其繁殖速度迅速下降,酵母菌呈疲惫状态,酒精发酵有停止的危险[20]。考察不同温度下培养酵母的OD600,结果见图4。
由图4可知:当温度低于30 ℃时,酵母菌的生长速度随着温度的升高而增长;当温度达到30 ℃时,其生长值达到最大;温度继续升高之后,生长又出现下降的趋势。

图4 温度对菌株W58生长的影响Fig.4 Effect of temperature on the growth of strain W58
2.4.3 pH对酵母菌生长的影响
酵母细胞的生长和胞内酶促反应都需要在一定的 pH 环境中进行,pH过高或过低都会影响酵母细胞膜所带电荷状态,使酵母生长代谢受阻。在不同pH条件下,将菌株W58过夜培养,结果见图5。
由图5可知:在pH<6.0的培养条件下,随着pH的升高,酵母菌的生长速度逐渐加快;而在pH>6.0的培养条件下,酵母菌的生长开始出现下降的趋势。因此pH 6.0为菌株W58的最适生长pH。

图5 pH对菌株W58生长的影响Fig.5 Effect of different pH on the growth of strain W58
2.5 海藻糖含量的测定
许多生物在胁迫环境下所表现出的耐受力与胞内海藻糖的含量有直接的关系,也是酿酒酵母在各种环境压力下的生存保护剂。陈丽君等[21]以存活率为指标,考察了不同时期不同酿酒酵母对多种不良环境的耐受性,并且测定了不同时期菌体胞内海藻糖含量,结果表明胞内海藻糖含量与酵母的耐受性之间存在一定的相关性,海藻糖含量越高,酵母的环境耐受性越好。所以笔者在高渗即1.4 mol/L NaCl条件下,分别测定其胞内海藻糖含量,考察所筛耐盐菌和不耐盐的对照菌毕赤酵母KM71对盐的耐受性,结果见图6。

图6 高渗胁迫下菌株W58胞内海藻糖含量Fig.6 Effects of salt concentration on trehalose content in strain W58
由图6可以看出:在普通YPD的培养条件下,2种酵母菌株胞内积累的海藻糖含量较为接近,而在高渗条件下,耐盐的库德里阿兹威氏毕赤酵母W58能积累更高的海藻糖,其胞内海藻糖含量能达到0.02 g/L,比对照菌KM71高出28.6%。Herrera等[22]研究发现汉逊酵母作为耐盐酵母,它在高渗的外界环境能刺激海藻糖合成途径增加海藻糖的积累来抵抗外界环境,本实验所筛菌与之相符,说明在一些极端环境中,酵母能积累更多的海藻糖这种兼容性物质来作为渗透保护剂维持菌株的正常生长和生理代谢。
2.6 ATPase酶活的测定
质膜H+-ATPase是细胞生命活动过程中的主宰酶,对细胞生长、发育以及各种环境变化都有影响。质膜 H+-ATPase为“P-型”,主要功能是转运质子出细胞产生跨质膜电化学梯度,激发溶质的次级转运。这种酶活性的调节与耐盐性之间存在一定的联系[23],杨颖丽等[24]研究发现,在过盐胁迫下,小麦根质膜ATPase酶活性出现明显的下降。基于之前的一些研究,考察不同盐条件下对ATPase活性进行测定,结果见图7。
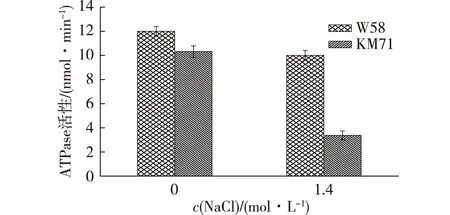
图7 高渗条件下ATPase活性变化Fig.7 Effects of salt concentration on plasma membrane ATPase activities of yeast
由图7可知:在正常生理生长状态下,对照菌(KM71)和待试菌株(W58)的ATPase酶活差异较小;但在高渗条件下对照菌的ATPase活性显著下降,仅为耐盐菌W58的1/3左右,这与文献[23]报道的ATPase参与了酵母的耐盐性相一致。较高的ATPase活性就能较快地水解ATP提供能量,形成质子梯度,与转运蛋白共同作用,将有毒阳离子运出,从而提高酵母的耐盐性。
3 结论
本研究通过多级筛选,分离获得1株发酵性能及耐盐性能较好的酵母菌株,经形态学观察和分子生物学检测,将其鉴定为1株库德里阿兹威氏毕赤酵母,并命名为PichiakudriavzeviiW58,该菌株的最适生长温度和pH分别为30 ℃和6.0。在高渗条件下培养发现,菌株W58能通过在胞内积累海藻糖以及维持一定的ATPase活性来抵抗外界环境压力。

