黑芝菌发酵产生胞外多糖的工艺优化及其抗氧化活性
王储炎,程俊文,祝 超
(1.合肥学院生物与环境工程系,安徽合肥230601;2.浙江省林业科学研究院,浙江 杭州310023;3.浙江省森林食品研究重点实验室,浙江杭州310023)
黑芝(Fructificatio amaurodermatis Rudae)属真菌门、担子菌亚门、层菌纲、非褶菌目、灵芝科、灵芝属高等真菌,分布于福建、广东、湖南、浙江、广西、云南、西藏等地野外林中地上和地下的腐木上[1-2]。黑芝表面紫黑色至近黑色或紫褐色,菌盖呈近圆形、半圆形或近小马蹄形,菌柄侧生或背侧生,形状为圆柱形或近念珠状,直径大小不一、粗细不等[3-5]。《神农本草经》上把黑芝列为上品,认为黑芝“味咸平,主耳聋,利关节,益肾气,通九窍,聪察,久食轻身不老延年仙”。中医认为,黑芝具有滋补强壮、扶正固本、延年益寿、增强免疫力等功效。江西黑芝含有人体所需要的微量元素铁、锌、铜、锰等,而且能够清除DPPH自由基,具有较强抗氧化活性,其抗氧化能力强于赤芝[6-10]。
目前,关于黑芝的研究主要集中在发酵工艺方面,廖伟等[5]开展了黑芝菌菌丝体液体培养基的优化研究,唐兴国等[2]选用了果糖、蔗糖和乳糖作为碳源,探讨了黑芝菌丝体发酵中不同水平的无机盐与碳源之间的交互作用,叶明等[11]研究了黑芝多糖的提取工艺条件,廖婷婷等[12]研究了不同发酵时间、pH值和基础培养基对黑芝菌丝体液态发酵的影响。利用黑芝菌发酵产生胞外多糖的发酵工艺研究尚未有报道。本研究以野生黑芝菌作为供试菌种,通过液体发酵技术来生产胞外多糖,采用响应面法来优化其发酵条件,并对胞外多糖的抗氧化活性进行探究,从而为黑芝菌液体发酵胞外多糖以及多糖的开发利用提供依据和参考。
1 材料与方法
1.1 材料与试剂
菌种从浙江省野外黑芝中分离纯化而得,经鉴定为黑芝菌(Fructificatio amaurodermatis Rudae),菌种编号FA003,目前保存于浙江省林业科学院生物技术研究所。
斜面培养基:马铃薯 200 g·L-1,葡萄糖 15 g·L-1,琼脂15 ~20 g·L-1,自然 pH。
种子培养基:马铃薯 100 g·L-1,葡萄糖 15 g·L-1,酵母粉 5 g·L-1,KH2PO41 g·L-1,MgSO40.5 g·L-1。
摇瓶发酵基础培养基:葡萄糖20 g·L-1,酵母粉 5 g·L-1,KH2PO41 g·L-1,MgSO40.5 g·L-1。
玉米粉、小麦粉、豆饼粉、麦麸来自上海三丰粮油有限公司。酵母粉、蛋白胨、牛肉浸膏购自武汉华辰生物技术有限公司。1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)来自美国Sigma公司。葡萄糖、蔗糖、麦芽糖、苯酚、浓硫酸、乙醇、水杨酸、FeSO4、维生素C均为分析纯。马铃薯市售。
1.2 仪器与设备
ZHWY-211B摇床发酵箱,上海智城分析仪器制造有限公司;752PC紫外可见分光光度计,上海光谱仪器有限公司;YXQ-LS-75SⅡ立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;GZX-9140 MBE数显鼓风干燥箱,上海博迅实业有限公司医疗设备厂;Anke DL-4000B冷冻离心机,上海安亭科学仪器厂。
1.3 试验方法
1.3.1 菌种培养
参照文献[13-14]的方法,先从母种试管中切出蚕豆状的菌丝块,接种在斜面培养基,置于25℃恒温培养箱中培养7 d;然后从活化的斜面菌种中取种接于液体培养基,25℃、150 r·min-1振荡培养7 d;最后在三角瓶中装入摇瓶发酵基础培养液150 mL,按照10%的比例接入液体培养菌种,25 ℃、150 r·min-1振荡培养。
1.3.2 胞外多糖含量测定
收集深层发酵培养液,3 000 r·min-1离心15 min,将上清液进行旋转蒸发浓缩,加入3~4倍体积的75%乙醇进行醇析,4℃冰箱醇沉24 h,4 000 r·min-1离心15 min 得到沉淀物,60 ℃烘干至恒质量,即得胞外多糖(extracellular polysaccharides,EPS),然后采用苯酚硫酸法测定其含量[15]。
1.3.3 单因素试验
碳源试验:以蔗糖、麦芽糖、葡萄糖、小麦粉、玉米粉分别取代摇瓶发酵培养基中的葡萄糖,按1.3.1节方法进行发酵培养7 d,选择产生多糖含量最高的碳源开展10、15、20、25、30 g·L-1共5 个浓度的碳源梯度试验,检测胞外多糖的含量。
氮源试验:以酵母粉、豆饼粉、麦麸、蛋白胨、牛肉浸膏,分别取代摇瓶发酵培养基中的酵母粉,按1.3.1节方法进行发酵培养7 d,选择产生多糖含量最高的氮源开展 2、4、8、12、16 g·L-1共5个浓度的氮源梯度试验,检测胞外多糖的含量。
发酵时间试验:采用含20 g·L-1最高碳源和5 g·L-1最高氮源的摇瓶发酵基础培养基,按照1.3.1 节方法,培养2、3、4、5、6、7、8 d,适时取样检测胞外多糖的含量。
1.3.4 响应面设计
在单因素试验基础上,选择蔗糖、酵母粉、发酵时间3个因素,运用Box-Behnken中心组合进行试验设计,利用Design Expert 8.05软件对实验数据进行回归分析[16-18]。各试验因素及水平编码表见表1。
1.3.5 胞外多糖抗氧化活性测定
DPPH自由基清除能力的测定:参照Nsimba等[19]、张娜等[20]的方法,在波长 517 nm 处测定多糖溶液的吸光度,计算DPPH清除率。
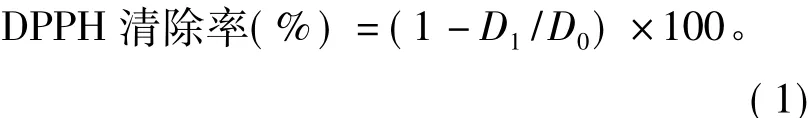
式中:D1为多糖溶液的吸光度;D0为蒸馏水的吸光度。
·OH自由基清除能力的测定:参照WANG等[21]、徐怀德等[22]的方法,反应体系中含 1.0 mL 8.8 mmol·L-1H2O2、1.0 mL 9.0 mmol·L-1FeSO4、1.0 mL 9.0 mmol·L-1水杨酸-乙醇溶液和1.0 mL不同浓度的多糖溶液。加H2O2启动反应,37℃反应30 min,以蒸馏水为参比,在510 nm下测定吸光度。考虑到样品本身吸光值,以1.0 mL 9.0 mmol·L-1FeSO4、1.0 mL 9.0 mmol·L-1水杨酸-乙醇溶液、1.0 mL不同浓度多糖溶液和1.0 mL蒸馏水作为样品的本底吸收值,计算样品对·OH 的清除率[23]。

表1 试验因素及水平编码表Table 1 Experimental factors and horizontal code
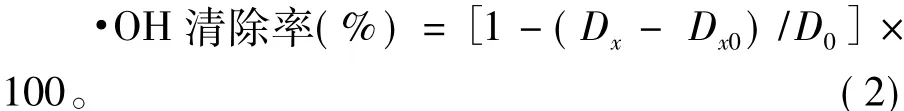
其中:D0为空白对照吸光度;Dx为加入样品溶液后吸光度;Dx0为不加显色剂H2O2样品溶液本底吸光度。
2 结果与分析
2.1 单因素试验结果
2.1.1 碳源
从图1可看出,蔗糖、葡萄糖、小麦粉和玉米粉都是黑芝菌发酵所需要的优质碳源,以蔗糖为碳源时,黑芝胞外多糖含量为218.66 mg·L-1,高于其他碳源,故后续试验选择蔗糖作为碳源。由图2可知,多糖含量随着蔗糖浓度的增加呈先升高后保持稳定的趋势,在蔗糖浓度为20 g·L-1时,黑芝胞外多糖的含量达到最大值218.78 mg·L-1。
2.1.2 氮源
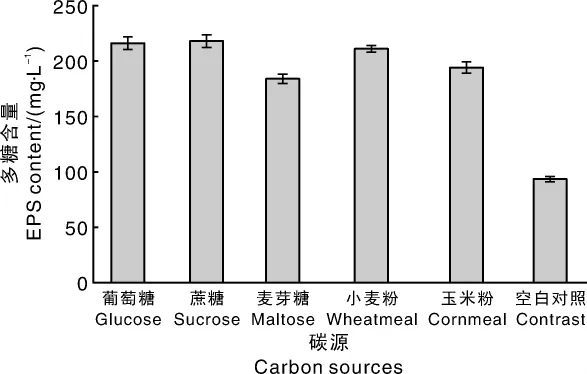
图1 不同碳源对液体发酵胞外多糖的影响Fig.1 Influence of different carbon sources on EPS yield
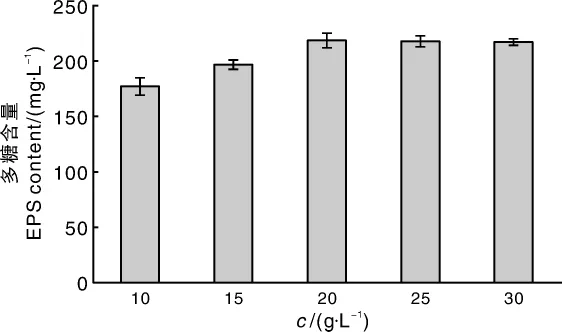
图2 蔗糖浓度对胞外多糖产量的影响Fig.2 Influence of sucrose concentrations on EPS yield
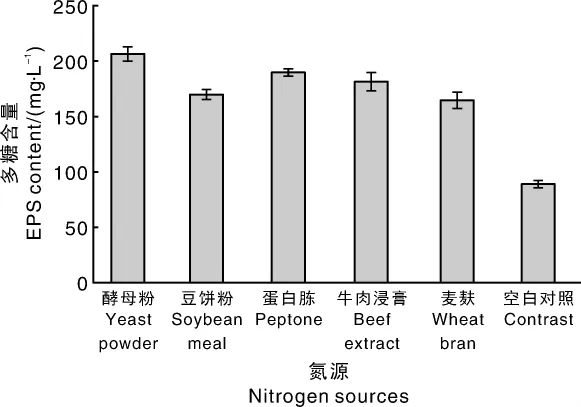
图3 不同氮源对液体发酵胞外多糖的影响Fig.3 Influence of different nitrogen sources on EPS yield
由图3可知,酵母粉、蛋白胨和牛肉浸膏都是较好的氮源。以酵母粉作为氮源时,黑芝胞外多糖含量为206.80 mg·L-1,高于蛋白胨以及其他氮源,故后续试验选择酵母粉作为氮源。由图4可知,随着酵母粉浓度的增加,胞外多糖的积累量也逐渐增加,酵母粉浓度超过8 g·L-1后,多糖的积累量趋于平稳。
2.1.3 发酵时间
由图5可知,发酵前期,随着发酵时间的延长,黑芝胞外多糖含量显著增大,发酵6 d以后,胞外多糖的产量开始趋于平稳。综合考虑时间、产出比、影响效率等因素,选取5、6、7 d作为响应面试验中发酵时间的3个水平。
2.2 响应面优化试验
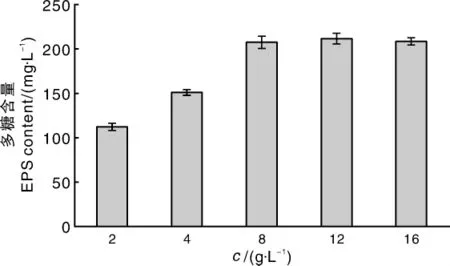
图4 酵母粉浓度对胞外多糖产量的影响Fig.4 Influence of yeast powder concentrations on EPS yield
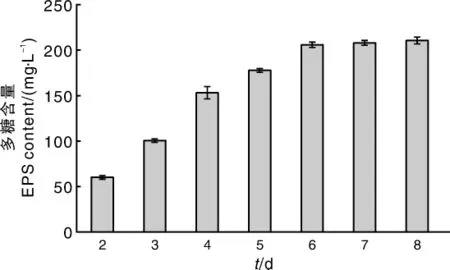
图5 发酵时间对胞外多糖产量的影响Fig.5 Influence of fermentation time on EPS yield
根据中心组合试验设计原理,设计3因素3水平的响应面分析试验,共有17个试验组合,具体试验结果见表2。

表2 黑芝液体发酵培养响应面试验结果Table 2 Response surface test results of liquid submerged fermentation
2.2.1 模型建立和显著性分析
利用Design expert软件对响应面实验数据进行分析和多元回归拟合,建立以EPS为函数的二次回归方程,并对回归方程进行方差分析和显著性检验,结果见表3。EPS(Y)与蔗糖(X1)、酵母粉(X2)和发酵时间(X3)的二次回归方程为:9.96X3+227.18 。
从表3可知,本试验所选用回归模型具有良好的显著性(P<0.05),失拟项 P=0.1013>0.05,表明该模型失拟项不显著。模型决定系数R2为0.954 6,表明此模型拟合度较好,校正系数Adj R2=0.896 2,说明该模型方程能够解释89.62%的响应值变化,可用该回归方程代替试验真实点对实验结果进行分析[24],同时可以运用该模型方程进行黑芝菌液体发酵培养基优化的理论预测。另外,X1、X2、X3以及 X21、X22均比较显著,说明它们对胞外多糖的合成有显著影响。
2.2.2 响应面分析
将模型中蔗糖、酵母粉及发酵时间的其中一个因素固定在0水平,得到另外2个因素的交互影响结果(图6、图7、图8)。蔗糖和发酵时间的交互作用对胞外多糖得率影响最为显著,相比而言,发酵时间和酵母粉、蔗糖和酵母粉的交互作用对胞外多糖得率影响较小,说明酵母粉对胞外多糖得率的协同作用不如蔗糖和发酵时间。
2.2.3 验证性实验
通过对回归方程进行一阶偏导,得到以下3个方程:
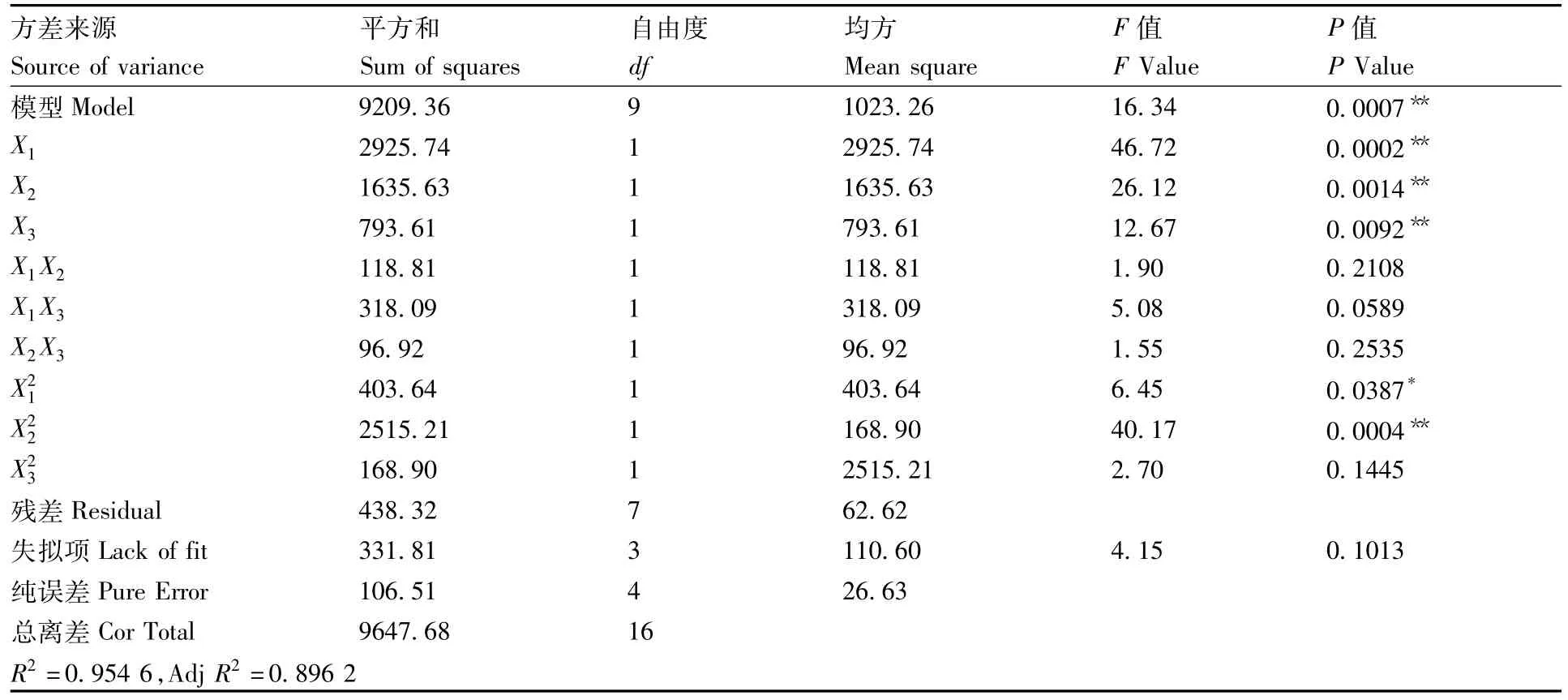
表3 响应面试验回归模型方差分析Table 3 Variance analysis of regression model for response surface test
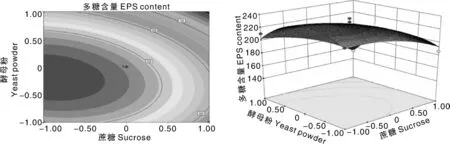
图6 蔗糖和酵母粉交互作用对黑芝胞外多糖含量的影响Fig.6 Influence of sucrose and yeast powder on EPS yield

图7 蔗糖和发酵时间交互作用对黑芝胞外多糖含量的影响Fig.7 Influence of sucrose and fermentation time on EPS yield

图8 酵母粉和发酵时间交互对黑芝胞外多糖得率的影响Fig.8 Influence of yeast powder and fermentation time on EPS yield
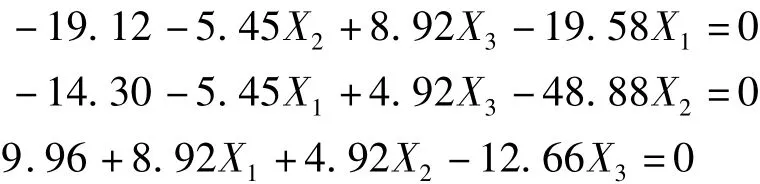
求解得出最佳培养条件为:蔗糖20.60 g·L-1,酵母粉 11.22 g·L-1,发酵时间 6.09 d。在此条件下,胞外多糖产量理论值可达230.06 mg·L-1。考虑到实际操作,培养条件调整为:蔗糖
20.6 g·L-1,酵母粉 11.2 g·L-1,发酵时间 6 d。在此条件下,胞外多糖产量理论值可达237.35 mg·L-1。通过实验证实,此时胞外多糖含量为236.83 mg·L-1,与理论值十分接近,实验结果与模型符合良好,说明该模型能较好地预测黑芝胞外多糖产量。
2.3 抗氧化活性分析
由图9和图10可知,随着黑芝胞外多糖浓度的增加,其对DPPH和羟基自由基的清除能力逐渐增强。多糖浓度为0.5 mg·mL-1时,对DPPH清除率达到63.87%,对羟基自由基清除率达到67.73%。多糖浓度超过0.5 mg·mL-1后,对自由基的清除率增加比较缓慢。总体上,胞外多糖对DPPH的清除率强于羟基,但低于阳性对照维生素C(VC)。黑芝胞外多糖的热稳定性高于VC,便于在食品加工中运用。
3 结论
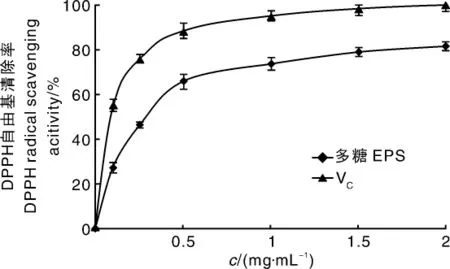
图9 黑芝胞外多糖对DPPH自由基的清除能力Fig.9 DPPH free radical scavenging ability of EPS
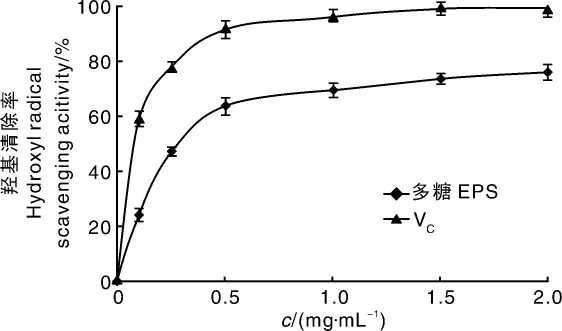
图10 黑芝胞外多糖对羟基自由基的清除能力Fig.10 ·OH free radical scavenging ability of EPS
采用响应面法优化黑芝菌液体发酵产生胞外多糖工艺,结果表明,适当增加碳源和氮源含量,能有效提高多糖含量。优化的黑芝菌发酵产生胞外多糖的工艺参数为蔗糖20.6 g·L-1,酵母粉11.2 g·L-1,发酵时间 7 d。在此条件下,胞外多糖的含量可达到236.83 mg·L-1。浓度0~0.5 mg·mL-1时,黑芝菌胞外多糖对DPPH和羟基自由基的清除能力逐渐增强。此研究结果可为后续开展黑芝液体发酵技术研究提供一定的参考。

