脐带间充质干细胞对脓毒症小鼠的器官保护作用及其机制
姜琳瑞,王小燕,张群,张书勤,杨静,王红,胡华钟
脓毒症(sepsis)是由感染引起的病原体与宿主免疫细胞之间复杂的相互作用及其伴随的全身炎症状态[1],其特征为感染反应失调所致的危及生命的器官功能障碍[2]。免疫反应作用对于抗感染至关重要,同时也是炎症组织浸润和器官严重损伤的主要原因[3-4]。调节促炎因子和抗炎因子有助于抑制免疫效应细胞,减轻全身炎症反应,并缓解内毒素造成的组织损伤[5]。间充质干细胞(mesenchymal stem cells,MSCs)具有调节先天免疫和适应性免疫反应的能力[6],有潜在的抗炎特性,可用于治疗炎症和组织损伤相关的疾病[7-8]。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)具有高自我更新、高分化潜能、低免疫原性和调节免疫的特点,来源广泛,便于取材,可大规模获取、培养,且无伦理限制[9],在细胞移植治疗方面优于其他来源的MSCs,有更高的临床应用价值。本研究采用hUCMSCs进行脓毒症小鼠的细胞移植治疗,探讨hUCMSCs对细菌脂多糖(lipopolysaccharide,LPS)刺激的脓毒症模型炎症反应的调节作用,以及对受损器官的保护作用,以期为探索hUCMSCs治疗脓毒症的机制提供依据。
1 材料与方法
1.1 实验动物及主要试剂 6~8周龄C57BL/6小鼠,体重25~30g,由南方医科大学实验动物中心提供,自由进食、饮水,常温环境饲养。白细胞介素10(interleukin-10,IL-10)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫检测试剂盒购自欣博盛生物科技有限公司;IL-10多克隆抗体、TNF-α多克隆抗体购自美国ABclonal公司;LPS(大肠埃希菌O111:B4提取物)购自美国Sigma公司;Synergy HTX多功能酶标仪购自美国BioTek公司。
1.2 脓毒症小鼠模型的建立 腹腔注射LPS建立脓毒症小鼠模型。取80只C57BL/6小鼠,随机均分为4组,分别于腹腔注射5、10、20mg/kg LPS及等剂量PBS。于0h、6h、12h、24h、2d、3d、4d、5d时间点测量各组小鼠体温并观察其活动状态,确定最佳建模条件。最终确定造模用LPS剂量为10mg/kg。
1.3 hUCMSCs的培养与鉴定 脐带获取自所在医院正常新生儿,签署知情同意书,且经该医院伦理委员会批准。取脐带华通氏胶基质,剪碎为2.0mm3的组织块,加入终浓度为0.05%的胶原酶Ⅱ,于37℃恒温振荡器中消化0.5h;消化完成后,加入PBS稀释并过滤;滤液离心,用DMEM/F12完全培养基重悬,以1×106/cm2接种于T-25cm培养瓶中;3d后全量换液;待细胞汇合度达到80%~90%时,用0.25%胰酶消化处理,按1:3比例传代。采用流式细胞仪检测所得细胞表面标志(CD105、CD90、CD73/CD34、CD19、CD45、CD11b、HLA-DR)及成骨(茜素红染色)和成脂(油红O染色)诱导分化鉴定。按照国际细胞治疗学会间充质及组织干细胞委员会提出的阳性标志物表达率≥95%、阴性标志物≤2%的标准对检测结果进行鉴定。选取第3代细胞用于实验。
1.4 分组及样本采集 另取C57BL/6小鼠29只,随机分为对照组(n=5)、LPS组(n=12)和hUCMSCs组(n=12)。对照组腹腔注射生理盐水0.5ml,1h后尾静脉注射PBS 0.5ml;LPS组腹腔注射LPS 10mg/kg,1h后尾静脉注射PBS 0.5ml;hUCMSCs组腹腔注射LPS 10mg/kg,1h后尾静脉注射2.5×105个hUCMSCs。分别在给予细胞治疗后3、6、12、24h采用5%水合氯醛麻醉小鼠,心脏采血,取血清保存于–80℃。迅速开胸、开腹摘取肝脏、肾脏和肺组织,置于4%多聚甲醛溶液(pH 7.4)中固定,制成石蜡切片。
1.5 病理形态观察 细胞治疗后6h,进行肺、肾、肝组织切片并行HE染色,观察病理形态学变化。
1.6 炎症因子表达水平测定 对以上各时间点肝组织切片进行IL-10、TNF-α免疫组化检测,应用Image J软件分析肝组织炎症因子表达情况。采用ELISA法测定血清TNF-α和IL-10水平,按照试剂盒说明书操作,根据450nm处吸光度(OD)值计算炎症因子血清浓度。
1.7 统计学处理 采用SPSS 20.0和Graphpad Prism 5.0进行统计处理和构图。计量资料用±s表示,验证方差齐性。多组间比较采用单因素方差分析(oneway ANOVA);两个独立样本的比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 hUCMSCs的培养与鉴定 倒置显微镜下可见细胞大小均一,折光性强,贴壁率高,呈长梭形漩涡状排列,生长特征稳定,符合MSCs特性(图1A)。MSCs的阳性表面标志物(CD73、CD105、CD90)和阴性表面标志物(CD11b、CD19、CD34、CD45、HLA-DR)检测结果见图1B。hUCMSCs经成脂分化诱导培养基诱导培养3周后,油红O染色鉴定结果如图1C所示,与未经诱导的细胞比较,诱导后的hUCMSCs染色后出现大小不一的小脂滴,表明hUCMSCs经诱导后可形成脂肪细胞,具有成脂分化潜能。hUCMSCs经成骨分化诱导培养基诱导培养4周后,茜素红染色鉴定结果如图1D所示,与未经诱导的细胞比较,诱导后的细胞可形成钙结节,被茜素红染成深红色,表明hUCMSCs经诱导后可形成成骨细胞,具有成骨分化潜能。上述结果均符合间充质干细胞的鉴定要求。

图1 人脐带间充质干细胞的鉴定Fig.1 Identification of human umbilical cord mesenchymal stem cells (hUCMSCs)
2.2 hUCMSCs对脓毒症小鼠肺、肝、肾病理结构的影响 HE染色结果显示,对照组小鼠肝脏、肾脏、肺组织未见明显异常改变。LPS组小鼠肺部有肺泡毛细血管充血、肺泡腔炎性细胞渗出浸润和肺泡壁增厚,肺泡间隔变粗,纤维增生;肝组织肝索紊乱,肝小叶结构不清晰,大量炎症细胞聚集在门脉区和肝窦内,可见炎性细胞浸润和肝细胞空泡变性等异常改变;肾脏有炎性细胞浸润,肾小球毛细血管扩张、充血,球囊间隙变窄,肾小管上皮细胞有水肿。hUCMSCs组小鼠上述症状均得到有效缓解,提示hUCMSCs对脓毒症小鼠的多器官损伤有保护作用(图2)。
2.3 hUCMSCs对脓毒症小鼠肝组织炎症因子分泌的影响 与对照组比较,LPS组各时间点小鼠肝组织促炎因子TNF-α表达明显升高,经hUCMSCs治疗后TNF-α表达与LPS组比较明显降低(P<0.05,图3)。与对照组比较,LPS组肝组织抗炎因子IL-10表达在3h达峰值,此后逐渐降低,但6h时仍明显高于对照组,而12、24h时明显低于对照组;经hUCMSCs治疗后IL-10表达与LPS组比较明显升高(P<0.05,图4)。
2.4 hUCMSCs对脓毒症小鼠外周血清炎症因子水平的影响 与对照组比较,LPS组小鼠血清TNF-α有上升趋势,于12h差异有统计学意义(P<0.05);血清IL-10也存在上升趋势,且于6、12、24h时差异有统计学意义(P<0.05)。经hUCMSCs治疗后3、6、12、24h,TNF-α水平均下降,但与同时间点LPS比较,仅24h时差异有统计学意义(P<0.05)。hUCMSCs组IL-10水平在治疗后各时间点均高于对照组,且在3、6、12h明显高于LPS组(P<0.05,表1)。

图2 小鼠肺、肾、肝组织的病理学改变(HE ×200)Fig.2 Pathological changes of lung, kidney and liver in mice (HE ×200)Bar=5μm
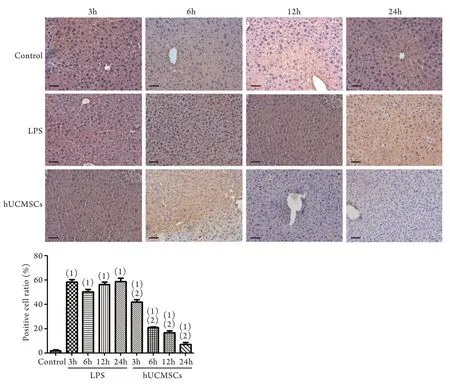
图3 小鼠肝脏组织TNF-α表达的免疫组化分析Fig.3 Immunohistochemical analysis of TNF-α expression in liver tissue of mice

图4 小鼠肝脏组织IL-10表达的免疫组化分析Fig.4 Immunohistochemical analysis of IL-10 expression in liver tissue of mice
表1 小鼠血清IL-10、TNF-α水平的变化(pg/ml,±s,n=3)Tab.1 Changes of IL-10 and TNF-α levels in serum of mice(pg/ml, ±s, n=3)

表1 小鼠血清IL-10、TNF-α水平的变化(pg/ml,±s,n=3)Tab.1 Changes of IL-10 and TNF-α levels in serum of mice(pg/ml, ±s, n=3)
(1)P<0.05 compared with control group, (2)P<0.05 compared with LPS group
Group TNF-α IL-10 Control 88.183±4.359 60.344±27.057 LPS 3h 89.806±27.775 1026.821±300.728 6h 83.404±26.694 2103.175±131.424(1)12h 104.534±17.336(1) 310.745±16.234(1)24h 78.300±4.338 655.099±53.343(1)hUCMSCs 3h 75.340±9.687(1) 2805.620±300.728(1)(2)6h 67.511±8.668(1) 602.620±2.319(1)(2)12h 62.675±2.136(1) 465.411±14.213(1)(2)24h 88.183±4.359(1)(2) 293.763±21.646(1)
3 讨 论
脓毒症的特点是感染引起全身炎症状态,巨噬细胞被激活,释放大量的促炎细胞因子,如TNF-α和IL-1β,内源性促炎细胞因子过度活跃且促炎和抗炎细胞因子失衡,伴随凝血途径的广泛激活,导致多器官衰竭、循环系统崩溃甚至死亡[10-11]。多器官功能衰竭是脓毒症患者最主要的死亡原因,而肝、肾、肺组织是脓毒症早期最常见的受损器官[12-13]。因此,针对性治疗器官衰竭和炎症因子紊乱是纠正脓毒症的关键。
有研究表明,MSCs可调节血液中促炎/抗炎因子的水平,从而改善局部和全身炎症反应,提高脓毒血症小鼠的生存率[14]。不同来源的MSCs可减轻内毒素诱导的啮齿类动物的肺脏损伤,主要通过抑制IL-1β、IL-6、TNF-α等促炎细胞因子发挥治疗作用,同时,MSCs可以迁移至肺部受损组织,并在受损部位分化为肺细胞表型[15-17]。研究发现,骨髓MSCs可促进免疫细胞产生抗炎细胞因子,如IL-10和TGF-1等,从而影响免疫细胞的分化、成熟和功能。而IL-10是公认的抗炎细胞因子,且已被证明在保护身体免受炎症过度伤害方面发挥重要作用[18]。
与其他来源的MSCs相比,hUCMSCs不仅具有较高的自我更新能力和较低的免疫原性,还可通过非侵入性程序获得,且易于培养,这使其在细胞移植治疗方面优于其他来源的MSCs。本研究表明,静脉注射hUCMSCs可以减轻脓毒症小鼠的肝、肾、肺组织损伤,调节肝组织及外周血中抗炎因子IL-10和促炎因子TNF-α的表达,从而起到一定的改善脓毒症的作用。本研究结果与相关文献报道一致,提示hUCMSCs可有效纠正脓毒症小鼠的免疫系统紊乱及减轻组织损伤,对脓毒症具有一定的治疗作用。
有研究认为,骨髓MSCs在缺乏单核细胞和巨噬细胞的小鼠中不再有效[19]。但根据本实验结果,hUCMSCs可对肝脏中促炎/抗炎因子起到明显的调节作用,结合相关文献,肝脏内巨噬细胞是介导天然免疫和获得性免疫的关键免疫细胞,它的激活可释放大量的促炎细胞因子,如TNF-α和IL-1β,并且与侵袭后的炎症反应有关,在全身炎症反应综合征和多器官功能障碍综合征的发生过程中起着关键作用[18],因此hUCMSCs作用的发挥可能是基于与肝脏巨噬细胞的相互作用;而MSCs可通过与局部组织间的接触和可溶性因子的旁分泌作用来保护组织[20]。hUCMSCs是通过自身迁移到达受损器官中分化而发挥作用,还是注入体内后通过旁分泌作用发挥疗效还需探究,其对脓毒症的具体作用机制也尚未明确,均有待进一步研究。

