3D打印的多聚甲醛硅氧烷仿生纳米银复合材料及性能研究
施高强,罗高兴,陈希炜,谭江琳,刘梦龙,刘腾飞,谢小蓉,吴军
目前临床上可供选择的伤口敷料,包括天然材料和合成材料两大类,其中合成材料常用的有壳聚糖[1]、藻酸盐[2]、硅胶[3]、聚丙烯酰胺[4]、聚乳酸[5]等。这些材料不仅具有柔韧性好、安全、生物相容性好、无毒等特性,而且还能吸收大量的创面分泌物,使创面保持理想的湿度,从而提供一个令人满意的创面愈合环境,但在抵抗细菌感染、抑制细菌黏附和杀灭细菌方面仍存在明显不足[6-7]。解决此问题的思路是将抗菌剂整合到创面敷料中,使之获得抗感染能力。典型的局部抑菌剂有碘酒[8]、三氯苯氧氯酚[9]、季铵盐[10]、纳米银[11]、氯胺[12]等。多聚甲醛硅氧烷(polydimethylsiloxane,PDMS)是一种具有疏水性、无毒、生物相容性好及橡皮样弹性的聚合物,在医用敷料的制备中具有良好的应用前景[13-14]。近年来,有学者提出通过对PDMS灌注大量润滑液,从而获得一个光滑面,使之具有抗黏附作用[15-16]。本研究旨在以硅油灌注的聚二甲基硅氧烷(oil-infused polydimethylsiloxane,iPDMS)为基础,整合纳米银使之获得良好的抗感染能力,制备出一种兼具抗黏附和抗感染的硅油灌注的多聚甲醛硅氧烷仿生纳米银复合材料(oil-infused polydimethylsiloxane with anti-bacterial nanosilver,iPDMS/AgNPs)[17-18]。
1 材料与方法
1.1 PDMS 和多聚甲醛硅氧烷仿生纳米银复合材料(oil-infused polydimethylsiloxane with anti-bacterial nanosilver,PDMS/AgNPs)的墨水准备 将预聚物和固化剂按照质量比1:1混合制成可打印的墨水;彻底搅拌,添加质量比为0.5%和2.5%的纳米银;将混合物在冰浴下超声处理1h;置于60℃热水浴中30min,形成最后的墨水。
1.2 3D打印 所有创面敷料均采用3D打印机(HKable 3D)构建。将墨水注入推出注射器(通过一个20G平头电极针固定在传送机上)。打印期间,不同需求的3D形状依据计算机辅助设计装在一个载玻片上。打印后,样品放在热水浴中保持2h,直到完全固化。
1.3 iPDMS和iPDMS/AgNPs的准备 完全固化后,3D打印的PDMS和PDMS/AgNPs膜片首先用乙醇漂洗并干燥,转移至一个充满5cst硅油的玻璃容器中,浸泡18h。准备足够量的6组膜片用于后续实验,分别为PDMS、iPDMS、PDMS+0.5%AgNPs、PDMS+2.5%AgNPs、iPDMS+0.5%AgNPs和iPDMS+2.5%AgNPs。
1.4 扫描电子显微镜和能谱检查 通过扫描电子显微镜和能谱(Hitachi,S-3400N,Japan)观察iPDMS/AgNPs纳米复合材料的形态特征。将样品用去离子水小心清洗、干燥并进行金包被;在真空条件下通过扫描电子显微镜观察;将iPDMS和iPDMS/AgNPs的膜片添加到200目碳膜包被的铜网上,样品在空气中自然干燥后,采用能谱仪检测材料的成分。
1.5 实验动物 健康雄性BALB/c小鼠购于陆军军医大学动物研究所,共12只,体重25g左右,饲养于SPF级饲养间,室温25℃,相对湿度50%,昼夜节律12h/12h。实验开始前小鼠分单笼适应性饲养1周。本研究所有实验操作均符合陆军军医大学实验动物伦理委员会的相关伦理要求。
1.6 细胞毒性实验
1.6.1 成纤维细胞原代培养 取新生绿色荧光蛋白转基因小鼠,75%乙醇消毒,PBS漂洗3次,超净工作台内剥取新生鼠皮肤,尽量去除皮下组织后,剪成约0.5cm×0.5cm大小的皮片,表皮面向上、真皮面向下漂浮浸泡于预先配制好的0.5% DispaseⅡ溶液中(注意DispaseⅡ溶液尽量不要接触到表皮面),4℃过夜。次日取浸泡后的皮片,使用眼科镊轻柔分离皮肤的表皮和真皮并收集真皮组织,PBS漂洗后,于无菌三角锥瓶中将真皮组织尽量剪碎,加入0.25%胰酶溶液后用封口膜封口,置于37℃恒温摇床内轻柔摇晃消化10min。加入预先配制好的DMEM培养基终止消化后,转移至15ml离心管内,1000r/min离心10min,弃上清,重悬细胞,接种至25cm培养瓶内,每个培养瓶内补充培养基至5ml,置37℃、5%CO2孵箱内培养。接种后第1天进行细胞换液,此后每隔2~3d换液1次,视细胞生长密度进行传代。后续实验使用第2和第3代的细胞。普通小鼠的成纤维细胞原代培养采用相同的方法。
1.6.2 CCK-8试验 膜片置于96孔板内,每孔一张膜片并置于底部。配制含1%胎牛血清的DMEM培养基,更换原培养基培养48h以同步细胞周期。制备1×104/ml浓度的成纤维细胞悬液,接种到96孔板内,每孔100μl。接种后的第1~6天,每天使用CCK-8试剂检测膜片上的细胞数量。检测步骤如下:将膜片转移到新的96孔板中,PBS缓冲液轻柔漂洗3次,加入新鲜的DMEM培养基100μl,再加入10μl CCK-8试剂后,37℃孵育1h,采用酶标仪于450nm处检测溶液的吸光度(OD)值。
1.7 抗黏附试验 使用临床上常见的标准耐药菌金黄色葡萄球菌和大肠埃希菌,先扩增细菌(摇菌过夜)至1×109cfu/ml,然后将菌液稀释至1×104cfu/ml。材料预处理(n=3):75%乙醇室温浸泡20min灭菌,PBS洗3次。细菌黏附及培养:向含膜片的孔内加入200μl稀释后的菌液,37℃孵育1.5h;PBS漂洗1次;将膜材料贴于平皿的底部,展平,倒入预热冷却至45℃的LB琼脂,凝固后37℃培养过夜。最后取出平皿,拍照、计数。
1.8 体外抗菌活性实验
1.8.1 细菌准备 采用临床上常见的标准耐药菌金黄色葡萄球菌和大肠埃希菌,先扩增细菌(摇菌过夜)至1×109cfu/ml后冻存,取200μl冻存菌液加入10ml LB培养基中,200r/min离心30min,37℃过夜培养至对数生长期,稀释菌液至OD值=0.07。
1.8.2 材料预处理(n=3) 将材料剪切成1cm×1cm大小,75%乙醇室温浸泡20min灭菌,PBS洗3次,每次5min。
1.8.3 共培养及检测 向含一片材料的24孔板孔内加入500μl稀释后的菌液,37℃下50r/min振荡孵育24h,测定菌液OD值。
1.9 iPDMS/AgNPs在小鼠全层皮肤感染创面中的应用 构建小鼠全层皮肤感染创面模型,观察iPDMS/AgNPs对创面愈合率、新生上皮长度和肉芽组织厚度的影响。
1.9.1 材料准备 将材料分为8组,分别为阴性对照(A)组(无菌,只贴负压膜)、阳性对照(B)组(既滴菌又贴负压膜)、PDMS(C)组、iPDMS(D)组、PDMS+0.5%AgNPs(E)组、PDMS+2.5%AgNPs(F)组、iPDMS+0.5%AgNPs(G)组、iPDMS+2.5%AgNPs(H)组,均用打孔器制成6mm直径圆片,酒精消毒、PBS漂洗后烤干。
1.9.2 细菌准备 制备菌液浓度为1×108cfu/ml的临床上常见的标准耐药菌金黄色葡萄球菌和大肠埃希菌混合液。
1.9.3 动物准备 12只8~10周BALB/c雄性小鼠用剃发器剃毛、脱毛膏清除干净毛发后,在背部对称打两个直径为6mm的圆形皮肤全层创面。
1.9.4 实验过程 分别于创面上滴加15~20μl的细菌悬液,稍微晾干,分别采用1.9.1中准备的8组材料覆盖创面。于第1、3、5、7天揭开创面拍照,每组更换对应的敷料,外层贴固定膜,分析创面大小并进行统计分析。
1.10 创面愈合率评价 在伤后第1、3、5、7天对创面拍照后,采用IPP 6.0软件进行测量,应用以下公式计算创面愈合率:创面愈合率(%)=(原始创面面积-残余创面面积)/原始创面面积×100%。
1.11 病理组织学观察 在伤后第3天和第7天处死小鼠,每组各3只,提取创面组织,4%多聚甲醛固定,石蜡包埋、切片,常规HE染色,Image J软件测量新生上皮的长度和肉芽组织厚度。
1.12 统计学处理 采用SPSS 11.0软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 iPDMS/AgNPs的制备及形态学观察结果 通过一台全能3D打印机获得可调的iPDMS/AgNPs创面敷料(图1A);iPDMS/AgNPs可以轻易地折叠和拉伸(图1B1、B2);硅油修饰的PDMS膜片表面光滑无凸起(图1C),纳米银点缀的iPDMS膜片表面有较为均匀的凸起存在,平均直径为14.8nm(图1D);iPDMS/AgNPs的能谱观察显示含有1.1%银元素(图1E)。
2.2 iPDMS/AgNPs对小鼠成纤维细胞的毒性作用观察 CCK-8法检测结果显示,不同纳米银浓度的iPDMS/AgNPs对培养1~7d的小鼠成纤维细胞均无明显细胞毒性(P>0.05,图2)。
2.3 iPDMS/AgNPs对细菌的抗黏附作用 6组膜片与金黄色葡萄球菌和大肠埃希菌共培养后的肉眼观见图3。与金黄色葡萄球菌共培养的6组膜片细菌菌落数分别为(10.3±2.5)cfu/皿、(2.0±2.0)cfu/皿、(50.7±3.5)cfu/皿、(46.3±2.1)cfu/皿、(9.7±3.1)cfu/皿、(0.3±0.6)cfu/皿,与大肠埃希菌共培养的6组膜片细菌菌落数分别为(9.3±2.5)cfu/皿、(1.0±1.0)cfu/皿、(43.7±3.5)cfu/皿、(37.7±3.2)cfu/皿、(10.3±1.5)cfu/皿、(0.7±1.2)cfu/皿。统计学分析结果显示,硅油修饰的膜片细菌菌落数明显少于其他组(P<0.05,图4),即iPDMS/AgNPs膜片可有效抵抗金黄色葡萄球菌和大肠埃希菌的黏附。
2.4 iPDMS/AgNPs的体外抗菌活性观察 6组膜片与金黄色葡萄球菌共培养时,OD值分别为1.220±0.018、1.133±0.035、0.948±0.031、0.744±0.053、0.781±0.046、0.587±0.045,与大肠埃希菌共培养时,OD值分别为0.611±0.017、0.597±0.014、0.538±0.023、0.392±0.011、0.392±0.014、0.278±0.040。统计学分析结果显示,纳米银修饰的膜片组OD值明显低于其他组(P<0.05,图5),即iPDMS/AgNPs膜片可抑制金黄色葡萄球菌和大肠埃希菌的生长。
2.5 iPDMS/AgNPs对小鼠全层皮肤感染创面愈合的影响 伤后第1、3、5、7天各组膜片创面愈合的肉眼观见图6。在伤后第3天,8组膜片的创面愈合率分别为18.97%±0.73%、6.30%±0.49%、10.50%±0.40%、14.30%±1.02%、24.43%±0.73%、28.93%±1.07%、28.00%±1.11%、32.73%±1.45%,而伤后第7天分别为58.53%±2.43%、19.93%±0.96%、27.63%±1.10%、40.12%±1.03%、61.57%±1.01%、73.17%±2.07%、73.03%±1.15%、82.60%±1.42%,统计学分析结果显示,在伤后第3天和第7天,E、F、G和H组创面愈合率高于B组(P<0.05),在伤后第
7天,H组的创面愈合率高于A组(P<0.05,图7),即iPDMS/AgNPs能有效提高创面的愈合率。
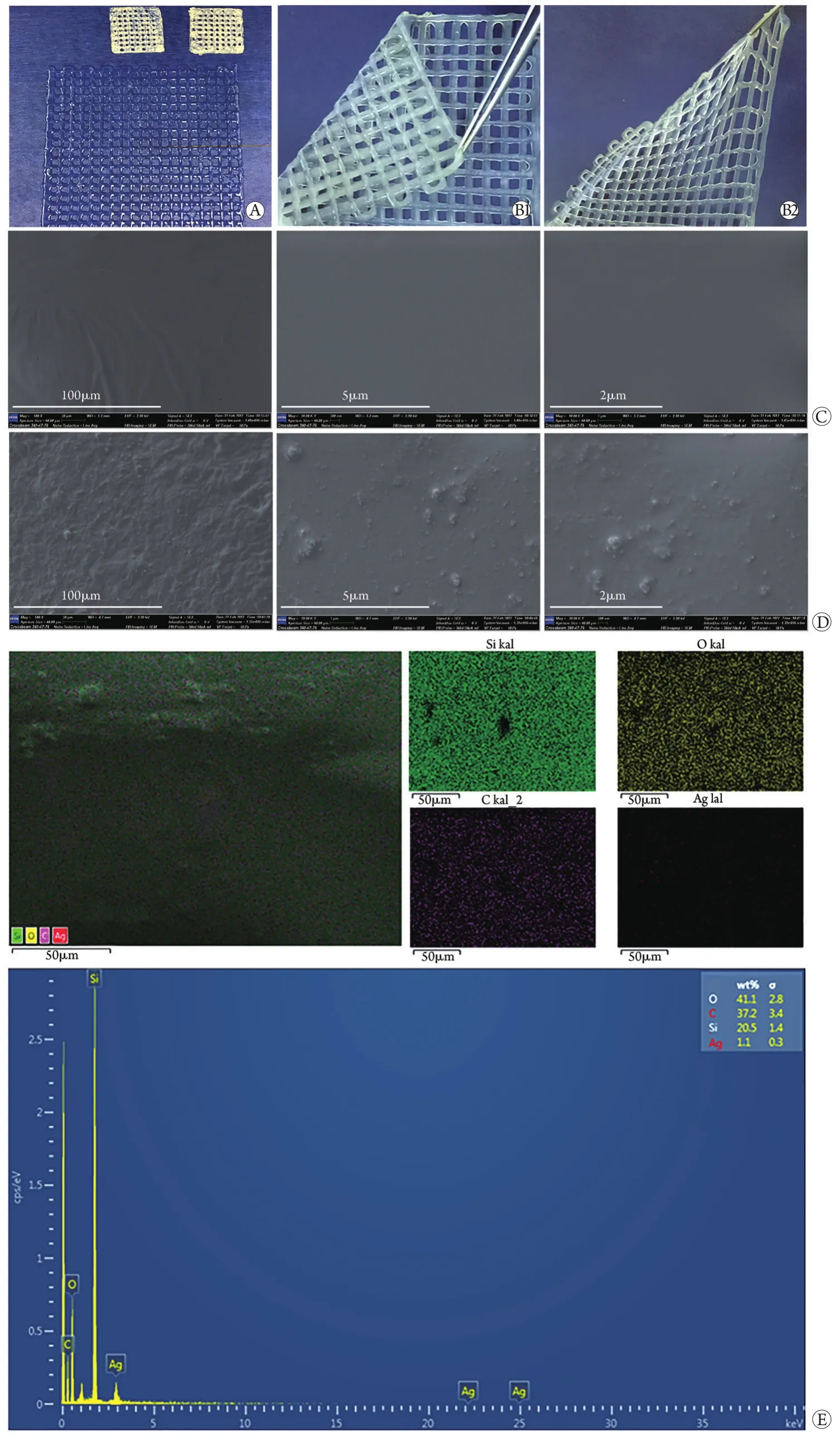
图1 iPDMS/AgNPs的特征Fig.1 Micrographs of 3D-printed mesh and nonosilver dotting
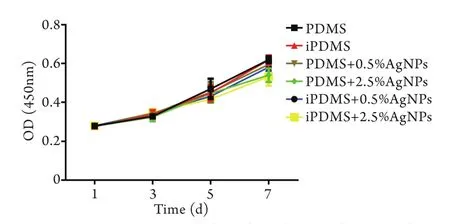
图2 iPDMS/AgNPs对小鼠成纤维细胞增殖的影响Fig.2 Effects of iPDMS/AgNPs on fibroblast proliferation in mice
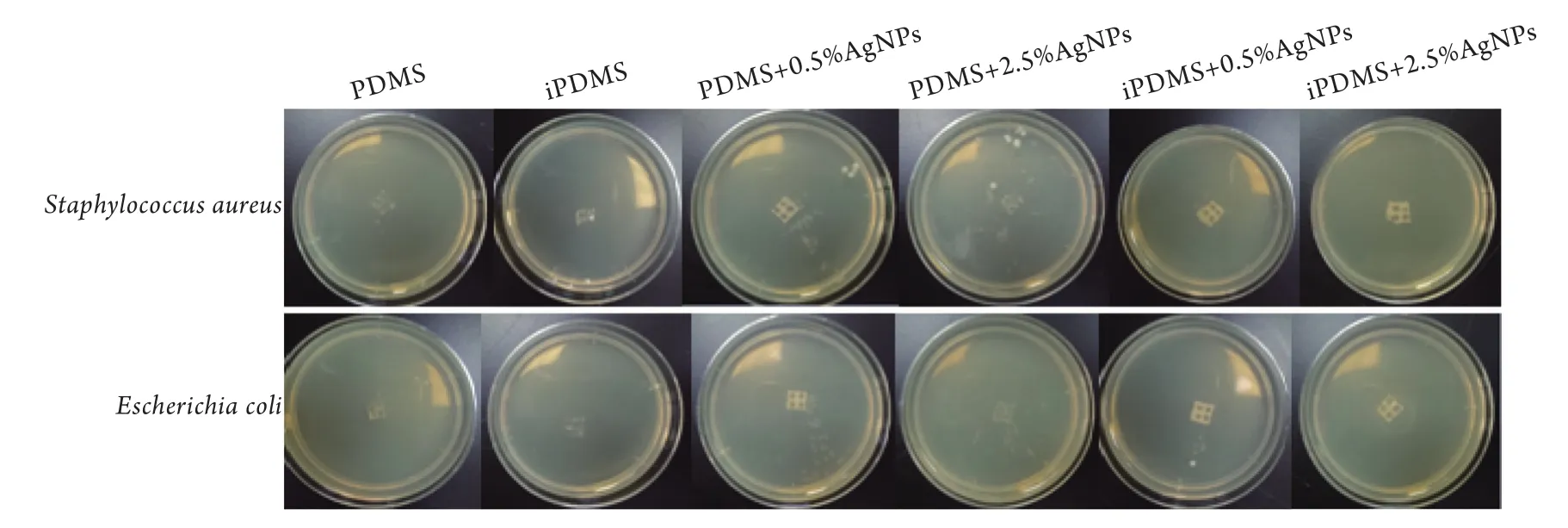
图3 6组膜片与金黄色葡萄球菌和大肠埃希菌共培养后的肉眼观Fig.3 Gross appearance of six groups of iPDMS/AgNPs films co-cultured with Staphylococcus aureus or Escherichia coli

图4 6组膜片与金黄色葡萄球菌和大肠埃希菌共培养的细菌菌落数比较Fig.4 Colony count of six groups of iPDMS/AgNPs films co-cultured with Staphylococcus aureus or Escherichia coli
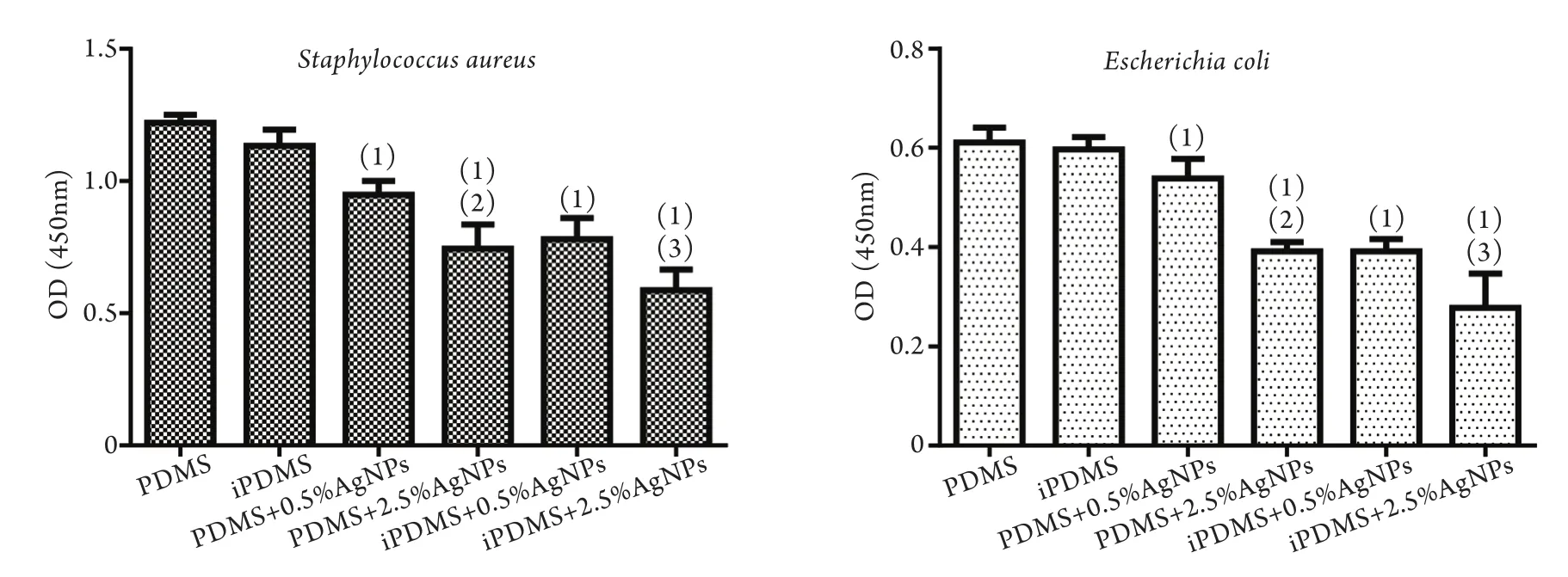
图5 6组膜片分别与金黄色葡萄球菌和大肠埃希菌共培养的OD值比较Fig.5 Comparison of OD value of 6 groups of iPDMS/AgNPs films co-cultured with Staphylococcus aureus or Escherichia coli
2.6 iPDMS/AgNPs对小鼠全层皮肤感染创面新生上皮长度的影响 本研究应用伤后第3天和第7天肉芽组织上新生上皮的长度作用新生上皮再生的指标,其肉眼观见图8。伤后第3天各组新生上皮长度无明显差异;伤后第7天8组膜片新生上皮长度分别为(727.10±27.99)μm、(422.47±28.90)μm、(444.13±33.03)μm、(573.33±41.97)μm、(754.53±30.36)μm、(816.30±37.68)μm、(958.80±54.02)μm、(1173.53±88.74)μm。统计学分析结果显示,在伤后第7天,E、F、G和H组的新生上皮长度长于B和C组(P<0.05,图9),即制备的复合材料膜片iPDMS/AgNPs可明显增加再生上皮长度。
2.7 iPDMS/AgNPs对小鼠全层皮肤感染创面肉芽组织厚度的影响 伤后第7天8组膜片肉芽组织厚度分别为(515.93±52.14)μm、(241.13±40.72)μm、(317.83±24.77)μm、(503.97±45.50)μm、(639.80±48.76)μm、(748.87±40.54)μm、(833.20±33.93)μm、(964.23±64.33)μm,统计学分析显示,E、F、G和H组的平均肉芽组织厚度明显大于B组(P<0.05),且G和H组的平均肉芽组织厚度明显大于A组(P<0.05,图10、11)。
3 讨 论
皮肤烧伤在平战时较为常见,其伴随细菌感染可同时损害人皮肤的表皮和真皮层,导致创面加深甚至死亡[19]。因此,对于烧伤患者而言,避免创面感染对于促进其愈合至关重要[20]。临床上使用的烧伤创面敷料不仅应具有抗感染能力,还需具有抗黏附能力,因为更换敷料时如果敷料黏附于伤口可能会引起患者的疼痛,而且对新生上皮也是一种损害[21]。
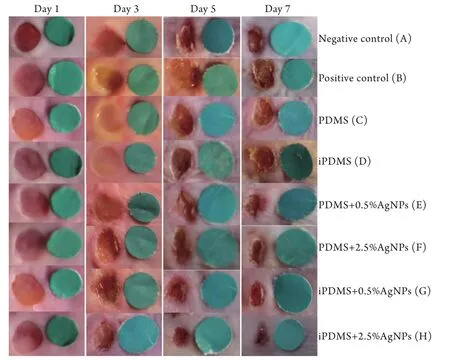
图6 伤后各组创面愈合情况肉眼观Fig.6 Gross appearances of eight groups of wound healing

图7 各组感染创面愈合率比较Fig.7 Comparison of the wound healing rate of each groups

图8 伤后第3天和第7天各组创面新生上皮长度(HE)Fig.8 Wound tissue sections obtained at day 3 and 7 post-wounding (HE)

图9 伤后第3天和第7天各组再生上皮长度比较Fig.9 Comparison of the neo-epithelial length on day 3 and 7 post- wounding
本研究采用3D打印技术设计出能够满足不同伤口需求的iPDMS/AgNPs膜片,该膜片可以轻易地折叠和拉伸,表明其具有良好的弹性。另外,硅油修饰的PDMS膜片表面光滑无凸起,但纳米银点缀的iPDMS膜片表面有较为均匀的凸起存在,其平均直径为14.8nm,该数值与纳米银的大小(<100nm)一致[22]。此外,能谱观察显示,本研究制备的iPDMS/AgNPs含有1.1%银元素,参考既往文献和其他研究结果[22],证实了纳米银的存在,表明成功制备了iPDMS/AgNPs纳米银复合材料。

图10 伤后第7天各组创面肉芽组织厚度(HE)Fig.10 Wound tissue sections obtained at day 7 post-wounding (HE)
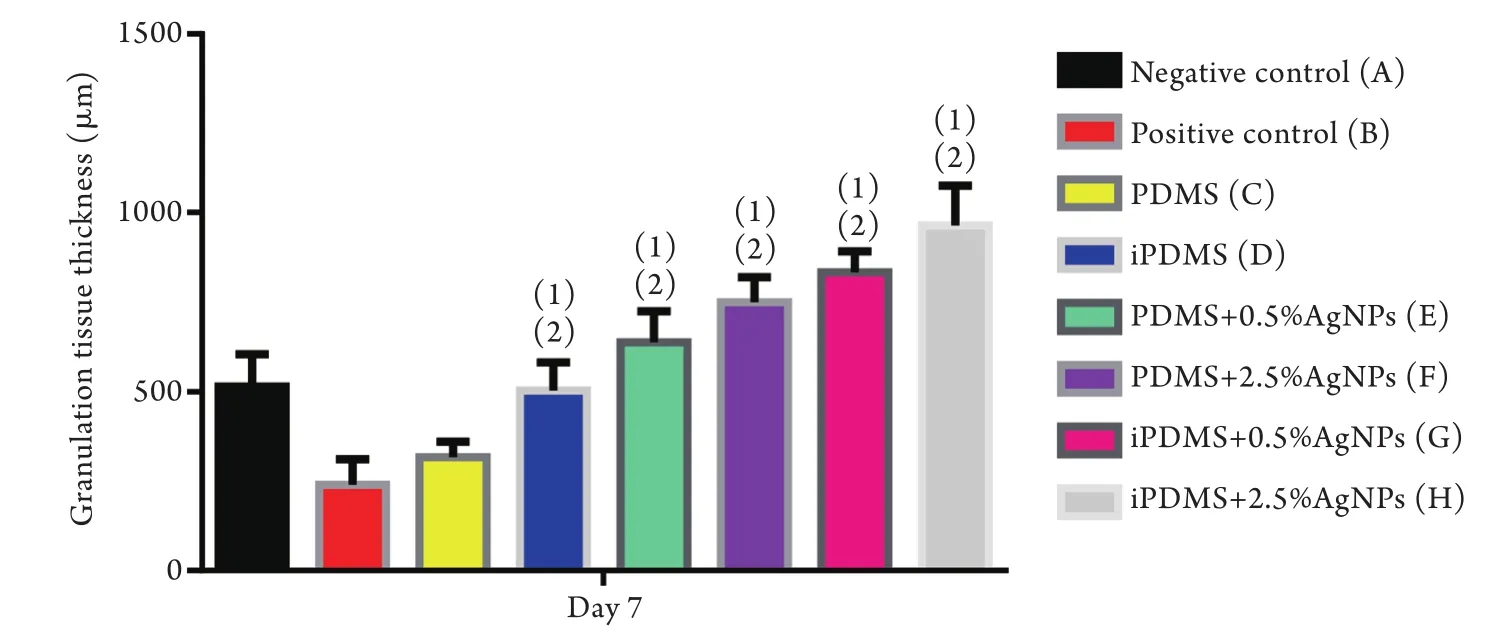
图11 伤后第7天各组肉芽组织厚度比较Fig.11 Comparison of the thickness of granulation tissue on day 7 post- wounding
细胞毒性实验显示,不同纳米银浓度的iPDMS/AgNPs对培养1~7d的小鼠成纤维细胞增殖无明显抑制作用。既往研究显示纳米银的细胞毒性呈剂量依赖性,且低剂量时可能是无毒的[23],本研究通过CCK-8实验检测发现,iPDMS/AgNPs对小鼠成纤维细胞没有明显的毒性作用,与Pauksch等[24]的研究结果一致,即纳米银在合适的浓度时无细胞毒性,仅在高浓度时有一定的细胞毒性作用。
抑菌的一个重要指标是细菌黏附和随之而来的菌群形成,本研究应用临床上常见的两种标准耐药菌(金黄色葡萄球菌和大肠埃希菌)检测iPDMS/AgNPs的抗黏附能力。结果显示,硅油修饰的PDMS/AgNPs膜片细菌菌落数明显少于其他各组,提示硅油修饰的膜片具有更好的抗黏附能力,该特点可能有助于提高创面的愈合率[25]。材料与细菌共培养结果显示,纳米银修饰的膜片组OD值明显低于其他各组,提示iPDMS/AgNP对金黄色葡萄球菌和大肠埃希菌具有较好的抗菌活性。上述结果表明iPDMS/AgNPs在体外能够有效地抗感染,最终可能促进创面愈合,与Wu等[26]的研究结果一致,他们认为纳米银复合材料对金黄色葡萄球菌和大肠埃希菌具有良好的抗菌活性,其机制可能是纳米银可破坏金黄色葡萄球菌和大肠埃希菌的细胞壁结构。
为了进一步探索iPDMS/AgNPs用做烧伤创面敷料的可行性,本研究采用小鼠全层皮肤感染创面模型观察其对创面愈合率、新生上皮长度和肉芽组织厚度的影响。结果显示,在伤后第3天和第7天,含有纳米银和硅油膜片组创面愈合率明显高于空白组和PDMS组,表明iPDMS/AgNPs能有效提高创面愈合率,与既往研究结果一致[27]。病理组织学观察显示,应用iPDMS/AgNPs后,小鼠全层皮肤感染创面的再生上皮长度和肉芽组织厚度明显增加,表明其可促进上皮再生和肉芽组织形成,从而加速创面愈合,与相关文献报道一致[28-29]。
综上所述,本研究设计了一种新的创面敷料iPDMS/AgNPs,不仅具有良好的生物相容性、柔韧性、抗黏附能力和抗菌活性,并能有效促进创面愈合,此外,该敷料采用3D打印机设计,可满足不同患者的需求,有望在将来作为一种理想的创面敷料用于临床。

