小鼠肠上皮细胞岩藻糖基化与新生儿坏死性小肠结肠炎发生的关系
杜华,佘香,余加林,胡坤,贺雨,肖洒,艾青,刘东
新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是新生儿期一种严重威胁患儿生命的疾病[1]。近年来随着极低出生体重儿存活率的提高,NEC的发病率有逐渐升高的趋势,活产儿为1‰~3‰,占NICU患儿的2%~5%,其中90%以上为早产儿,病死率高达20%~40%,存活者也常常遗留短肠综合征、营养不良等后遗症,给家庭和社会带来了严重负担[2-3]。目前研究认为NEC是一种多因素疾病,肠道菌群改变与其发生关系密切[4-5],而肠黏膜中与菌群接触最密切的是肠上皮层[6-7],近年来有大量研究表明肠上皮多糖在宿主与菌群的相互作用中扮演着重要角色,肠上皮的糖基化水平可由菌群刺激和肠道免疫系统共同调节,上皮多糖也参与肠道菌群稳态的维持,其中肠上皮细胞岩藻糖基化在肠道共生菌定植中意义重大[8-9]。近年Goto等[10]研究发现肠上皮细胞岩藻糖基化水平主要通过菌群与肠道3型天然淋巴细胞(group 3 innate lymphoid cells,ILC3s)的相互作用(ILC3s-IL-22-Fut2轴)进行调节。本研究旨在探讨肠上皮细胞岩藻糖基化水平改变是否参与了NEC的发病,并初步分析其可能的机制,为进一步阐明菌群与NEC发生的因果关系提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 10日龄的C57BL/6新生小鼠42只(6只SPF级C57BL/6孕鼠购自重庆医科大学实验动物中心,中国)。
1.1.2 主要试剂 Similac配方奶(雅培公司,美国),贝克幼犬配方奶(贝克公司,美国),HBSS平衡盐溶液、胎牛血清(Gibco,美国),EDTA、胶原酶、DNA酶(Sigma,美国),DTT(VETEC,美国),RPMI 1640 培养基(Hyclone,美国),Fixation/Permeabilization、Permeabilization Buffer套装(Ebioscience,美国),RNAiso Plus、反转录试剂盒(TaKaRa,日本),Supermix EvaGreen(Bio-Rad,美国),Mouse IL-22 ELISA Kit(RayBiotech,美国),7AAD、RORγt-PE(BD,美国),CD45-BV605、CD45-APC、Lineage Cocktail-BV421(BioLegend,美国),UEA1-DyLight649(VECTOR,美国)。
1.1.3 主要仪器 CANTO-Ⅱ流式细胞仪(BD,美国),加样枪、小型台式离心机(Eppendorf,德国),低温高速离心机(Thermo,德国),NanoDrop 2000(Thermo,德国),CFX96 Real-time PCR仪(Bio-Rad,美国),切片机(Leica,德国),普通光学显微镜(Nikon,日本),电子分析天平(COBOS,西班牙)。
1.2 方法
1.2.1 NEC动物模型的建立 将42只10日龄的C57BL/6新生小鼠按随机数字表法随机分为NEC组(n=21)和对照组(n=21)。其中NEC组给予配方奶人工喂养,喂养量0.03ml/g,每4h喂养1次,缺氧冷刺激(100%氮气箱内缺氧30s,4℃冷刺激10min)每日2次[11];对照组由母鼠哺乳,不做其他处理。每日喂养前记录新生鼠体重并观察有无吐奶、腹胀、腹泻和血便,活动状态是否良好等。建模3d后(13日龄)断头法处死新生鼠。
1.2.2 肠组织病理染色 将新生鼠处死后,分离肠组织,肉眼观察有无肠腔积气、出血、坏死等NEC样病变,用PBS冲洗肠段。取出回肠末端近回盲部肠组织,用4%多聚甲醛固定过夜。将固定好的标本脱水、石蜡包埋、切片、苏木素-伊红染色、封片,在光学显微镜下观察组织病理形态并拍照。参照NEC损伤评分标准,采用双盲法进行肠组织病理评分[12],每例组织标本观察3个视野,取其平均值,评分≥2分认为NEC建模成功。
1.2.3 小鼠肠道细胞分离 将回肠末端近回盲部肠组织取出后,用预冷的PBS灌洗,肠内容物洗净后,将肠道纵行剖开,剪成1cm左右小段,将肠组织放于含有EDTA、DTT的不含镁钙的HBSS平衡盐溶液中,37℃孵育15min后过滤,4℃、400×g离心10min得到肠上皮细胞(intestinal epithelial cells,IEC)。将剩余组织转入含有2mg/ml胶原酶和10%FBS的RPMI 1640中,37℃震荡孵育40min后过滤,将细胞悬液通过Percoll淋巴细胞提取液,经密度梯度离心及PBS洗涤后,得到肠固有层淋巴细胞(lamina propria lymphocyte,LPL)。
1.2.4 流式细胞技术检测岩藻糖基化肠上皮细胞(fucosylated ECs,F-ECs)和肠道固有层ILC3s数量保证每管上样细胞数约为2×106个,上样体积200μl,标记策略:F-ECs:7AAD阴性,CD45-BV605阴性,UEA1-DyLight649阳性;ILC3s:7AAD阴性,CD45-APC阳性,CD3/4/11/19-BV421阴性,RORγt-PE阳性。细胞标记后用CANTO-Ⅱ流式细胞仪上机检测,使用FlowJo V10软件分析结果。
1.2.5 实时荧光定量PCR检测IL-22、IL-22R、Fut2水平 使用RNAiso Plus裂解上皮细胞和固有层淋巴细胞,分别提取总RNA,使用反转录试剂盒将RNA反转录为cDNA,所有步骤严格按照试剂盒说明书操作,将cDNA在CFX96 Real-time PCR仪上进行扩增,分别检测肠上皮细胞IL-22R、Fut2和固有层淋巴细胞IL-22的表达水平。反应条件:95℃预变性30s;95℃变性5s、56.5℃退火5s、65℃延伸5s,共39个循环。反应引物序列如表1所示。采用2–ΔΔCt法进行目的基因相对表达量分析。

表1 实时荧光定量PCR引物序列Tab.1 Primers of real-time PCR
1.2.6 ELISA检测肠固有层淋巴细胞IL-22蛋白水平
从液氮中取出冻存的肠固有层淋巴细胞,用含有2% FBS的PBS洗涤,4℃、500×g离心10min后,按照1×106个细胞加入200μl细胞裂解液的比例加入含磷酸酶抑制剂、蛋白酶抑制剂和PMSF的细胞裂解液,4℃震荡,12 000×g离心5min,取上清液为全蛋白提取物。采用ELISA检测IL-22蛋白表达水平,所有步骤严格按照试剂盒说明书操作。
1.3 统计学处理 采用SPSS 22.0软件进行统计分析。使用Shapiro-Wilk检验进行正态性检验,符合正态分布的计量资料以±s表示,组间比较采用两独立样本t检验,非正态分布的计量资料以M(Q)表示,组间比较采用Mann-Whitney检验。P<0.05为差异有统计学意义。
2 结 果
2.1 NEC建模对新生鼠体重的影响 建模前和建模第1天两组新生鼠体重无明显差异;建模第2天[(4.21±0.62)gvs.(3.32±0.11)g,P<0.01]和第3天[(4.27±0.72)gvs.(3.17±0.11)g,P<0.001],NEC组新生鼠体重明显低于对照组,差异有统计学意义(图1)。
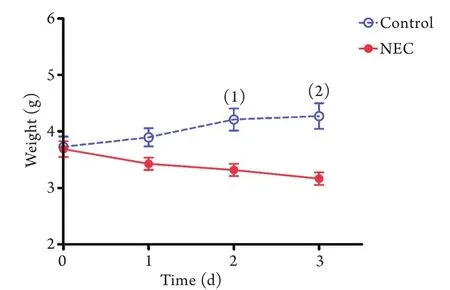
图1 NEC及对照组新生鼠体重比较Fig.1 Body weight of neonatal mice in NEC and control group
2.2 肠组织大体形态、病理形态观察及病理损伤评分 肉眼观察,对照组肠管色泽粉嫩,呈黄色,弹性佳,无积气等表现;NEC组色泽暗淡,弹性差,回盲部以上呈串珠样积气改变。光镜下观察,对照组肠道结构完整连续,腺体排列规则,绒毛高耸整齐;NEC组固有层和黏膜下层断裂分离,部分绒毛脱落消失,腺体排列紊乱,肌层变薄甚至断裂,双盲法病理学评分为2.76±0.42分(图2)。
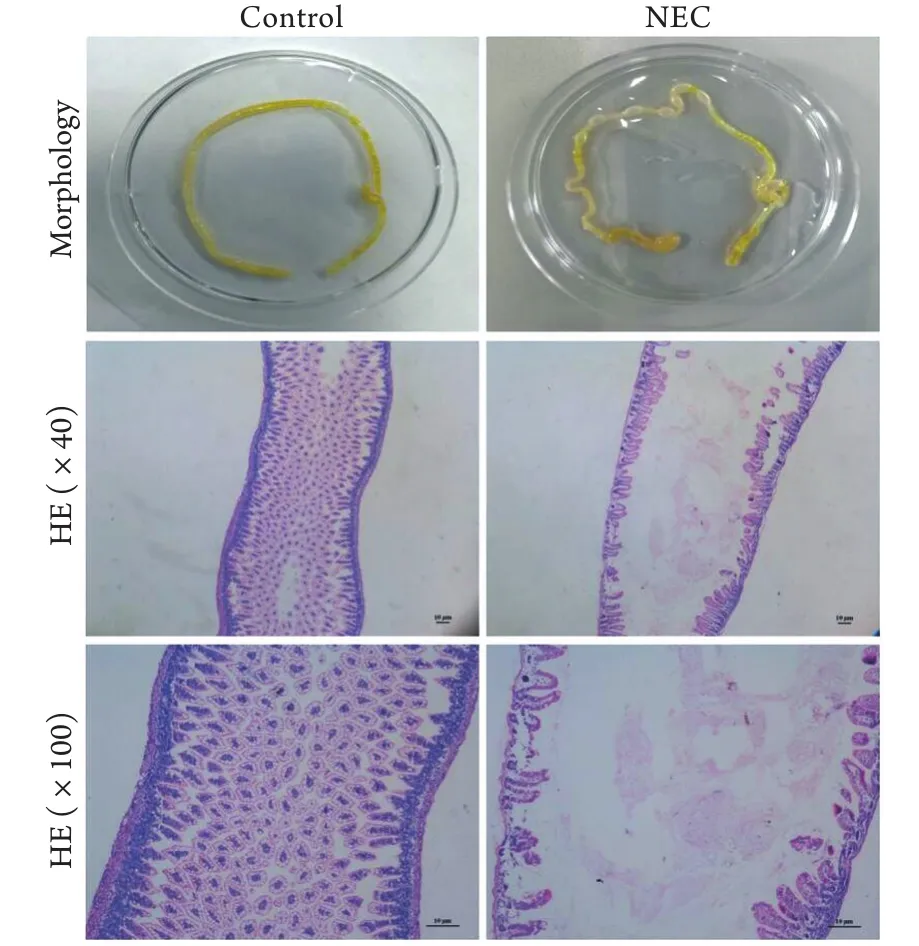
图2 对照组及NEC组新生小鼠肠组织的大体形态和病理形态比较Fig.2 Gross morphology and pathomorphology of intestinal tissue of neonatal mice in control and NEC group
2.3 F-ECs和肠道固有层ILC3s数量 流式细胞计数结果显示,NEC模型组F-ECs百分比(28.41%±8.28%)低于对照组(43.60%±13.58%),差异有统计学意义(P<0.05,图3,CD45阴性、UEA-1阳性群为目标细胞);NEC模型组肠道固有层ILC3s百分比(11.59%±2.25%)也明显低于对照组(20.14%±4.27%),差异有统计学意义(P<0.001,图4,CD3/4/11/19阴性、RORγt阳性群为目标细胞)。
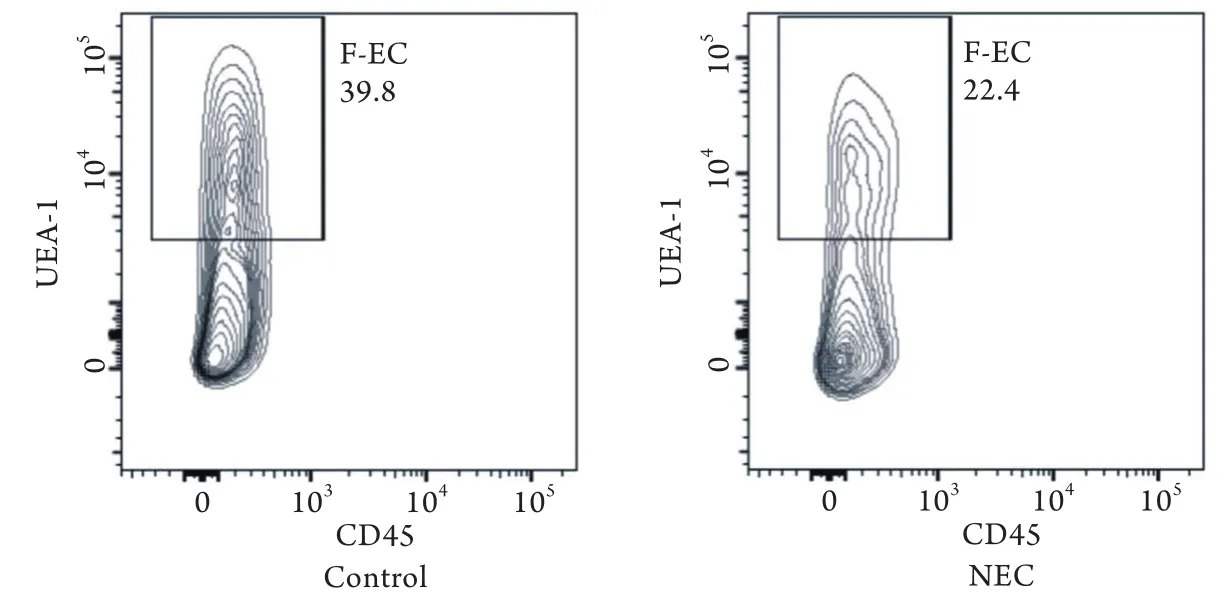
图3 对照组及NEC组F-ECs比例(流式细胞仪)Fig.3 F-ECs ratio in control and NEC group (Flow cytometry)(1)P<0.05 compared with control group

图4 对照组及NEC组肠道固有层ILC3s比例(流式细胞仪)Fig.4 Intestinal lamina propria ILC3s ratio in control and NEC group (Flow cytometry)(1)P<0.001 compared with control group
2.4 NEC建模对上皮细胞IL-22R、Fut2和固有层淋巴细胞IL-22 mRNA表达水平的影响 NEC模型组上皮细胞IL-22R mRNA表达水平(0.31±0.07vs.1.00±0.29)和Fut2 mRNA表达水平(0.33±0.13vs.1.00±0.22)明显低于对照组(P<0.001);NEC模型组固有层淋巴细胞IL-22 mRNA表达水平(M=0.02)也明显低于对照组(M=1.15),差异有统计学意义(P<0.01)。
2.5 两组肠道固有层淋巴细胞IL-22蛋白表达水平比较 ELISA检测结果显示,与对照组(7.97±0.10)相比,NEC模型组固有层淋巴细胞IL-22蛋白表达水平(6.91±0.14)明显降低,差异有统计学意义(P<0.001)。
3 讨 论
NEC的高发病率和高病死率严重威胁着新生儿尤其是早产儿的健康与生命,阐明其发病机制对于NEC的早期诊断以及干预治疗均具有重要意义。目前认为遗传易感性、肠道不成熟、微血流灌注失衡、异常肠道菌群定植、肠黏膜免疫应激性增高等都是NEC发病的危险因素[2]。尽管迄今为止仍不能确定何种因素起主导作用,但肠黏膜屏障结构与功能破坏使细菌与机体的正常关系失衡导致NEC发生这一观点逐渐被认可[13-15]。近年来NEC与肠道菌群的关系逐渐受到重视,已有研究发现在NEC患儿中变形菌门增加,厚壁菌门、拟杆菌门降低,而且肠道菌群改变发生于NEC之前[16-18]。已有大量研究证实,拟杆菌门、厚壁菌门可以调节肠道免疫和炎症,在维持肠道稳态中发挥重要作用[19-21]。
岩藻糖基化糖类基团参与了多种病理生理过程,包括细胞黏附、组织发育、血管生成、恶性肿瘤发生及肿瘤代谢等[22]。岩藻糖基化在哺乳动物肠道中普遍存在,肠上皮细胞α1,2-岩藻糖基化主要由半乳糖苷2-α-L-岩藻糖基转移酶2(galactoside2-α-L-fucosyltransferase 2,Fut2)合成,特定的菌群如分节丝状菌(SFB)[23]和拟杆菌[24]能够促进肠道的岩藻糖基化。一些共生菌如拟杆菌等可以产生岩藻糖苷酶,将岩藻糖基从上皮细胞表面分离并与其结合,结合的L-岩藻糖被一系列岩藻糖降解酶分解代谢,可用于:①作为能量供细菌利用;②内化为岩藻糖基化的荚膜多糖(细菌细胞壁组分);③调节岩藻糖操纵子基因的表达;④作为细菌产生短链脂肪酸(SCFAs)的底物;此外,上皮细胞岩藻糖基化可以为拟杆菌等含有岩藻糖苷酶的细菌提供定植优势,增加肠道有益菌群的数量,促进对机会致病菌定植的抗性[8-9]。在病原体诱导的应激损伤时,岩藻糖可以通过改变微生物代谢通路和减少细菌毒力因子表达改善宿主健康[25]。本研究中,NEC模型组F-ECs百分比低于对照组,提示在NEC发生过程中,肠上皮细胞岩藻糖基化水平下降,可能是NEC中菌群改变的潜在影响因素。
黏膜免疫细胞对于上皮细胞岩藻糖基化的诱导至关重要。天然淋巴细胞是一类新定义的固有免疫细胞家族,在人体黏膜组织中含量丰富,包括细胞毒性天然淋巴细胞(NK细胞)和非细胞毒性天然淋巴细胞(ILC1s、ILC2s、ILC3s),近年来天然淋巴细胞与肠道疾病的关系逐渐受到重视[26]。肠道固有层的天然淋巴细胞主要是ILC3s,ILC3s表达转录因子维A酸受体相关孤核受体(RORγt)以及标志性细胞因子IL-22和IL-17,IL-22是指导上皮细胞功能的细胞因子,在肠道固有免疫、组织修复和抗细菌感染中发挥重要作用[27]。ILC3s的活性受肠道菌群影响,参与糖类代谢和糖酵解过程[28]。Goto等[10]及Pickard等[25]发现肠道共生菌可以促进ILC3s产生其标志性细胞因子IL-22,IL-22可通过IL-22R-STAT3通路诱导上皮细胞Fut2的表达,从而促使肠上皮细胞表面蛋白的岩藻糖基化,对于宿主抵抗病原菌感染十分重要。为了进一步探索NEC岩藻糖基化水平下降的可能机制,本研究采用流式细胞技术测定了NEC模型组和对照组肠道固有层内ILC3s的比例,同时检测了固有层淋巴细胞IL-22和肠上皮细胞IL-22R、Fut2 mRNA的表达水平,以及固有层淋巴细胞IL-22蛋白的表达水平。结果显示,NEC模型组肠道固有层ILC3s百分比明显低于对照组,其下游因子IL-22、IL-22R和Fut2表达都明显降低,提示NEC模型的岩藻糖基化水平降低可能是通过ILC3s-IL-22-Fut2轴调节的。
综上所述,本研究结果表明,肠上皮细胞岩藻糖基化水平降低参与了NEC小鼠模型的发病,可能是通过ILC3s-IL-22-Fut2轴调节实现的。目前,NEC的发生与肠道菌群的研究多停留在相关性分析方面,阐明其因果关系成为亟待解决的问题。分析NEC肠道上皮细胞岩藻糖基化的改变,有助于为阐明肠道菌群与NEC发生的因果关系提供新的思路,但肠道菌群、免疫细胞与肠上皮细胞岩藻糖基化之间的复杂互作关系仍需进一步探索研究。

