间充质干细胞过表达miR-21对卵巢颗粒细胞凋亡的影响
王清,陈小莹,李欣然,汪庆如,付霞霏
近年来,恶性肿瘤的发病呈年轻化趋势;随着肿瘤化疗技术的不断研发及广泛应用,恶性肿瘤患者的存活率不断提高,但与此同时出现的化疗性卵巢早衰成为了年轻恶性肿瘤患者必须面对的问题,同时也是临床医生关注的热点及难点[1-2]。化疗性卵巢早衰是指化疗后闭经持续1年,排除妊娠,卵泡刺激素(FSH)≥30mU/ml者[3],严重威胁着患者的生殖健康。目前尚无有效方法从根本上修复化疗药物损伤的卵巢结构和功能。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)是具有多向分化潜能的成体干细胞,因其具有多能性及易于分离培养、扩增的特性,是干细胞治疗领域最有潜能的种子细胞[4-5]。研究显示BMMSCs可用于修复脊髓、心肌和皮肤损伤等[6-7]。本课题组前期研究结果显示BMMSCs可抑制卵巢颗粒细胞凋亡,部分修复化疗药物损伤的卵巢结构和功能,但移植后部分细胞凋亡,尚达不到完全修复的效果[8]。
微小核糖核酸(miRNAs)存在于真核生物体内,为一类长约22个核苷酸的内源性非编码单链RNA,能与靶mRNA 3'端非翻译区(3'-UTR)的碱基序列结合,调节靶mRNA的剪切或翻译。miRNAs在机体一系列生理及病理过程如细胞增殖、凋亡、分化及病原体感染中发挥调控作用[9-11]。其中,miR-21是较早在哺乳动物中发现和确认的一种miRNAs分子。研究证实,miR-21在多种肿瘤如宫颈癌、卵巢癌、乳腺癌、脑胶质瘤、甲状腺癌等的发生发展过程中发挥作用,调节细胞凋亡,参与肿瘤浸润与转移。同时,miR-21在卵巢颗粒细胞凋亡和卵泡发育中发挥调控作用[12]。但miR-21能否增强间充质干细胞修复化疗性卵巢早衰的疗效鲜见报道。本研究构建miR-21慢病毒载体,转染BMMSCs,获得miR-21修饰的BMMSCs(miR-21-BMMSCs),并在体外将miR-21-BMMSCs与化疗药物诱导凋亡的颗粒细胞共培养,探讨BMMSCs过表达miR-21对颗粒细胞凋亡的影响及其可能机制。
1 材料与方法
1.1 实验动物 雌性清洁级Wistar大鼠6只,体重180~200g,由南方医科大学实验动物中心提供。动物饲养条件:室温(23±2)℃,湿度45%~55%,光照时间12h,自由摄水,适应性饲养3~5d。
1.2 大鼠BMMSCs的分离、培养及鉴定 大鼠麻醉后,无菌条件下取出胫骨和股骨,制备成单细胞悬液,小心加入预先准备的含密度为1.083的Percoll分离液的离心管内,注意勿使两种液体混合,两种液体体积比为1:1。以2500r/min离心20min,小心吸取中间界面乳白色的单个核细胞层,用PBS洗2次后加入含10%胎牛血清的DMEM/F12完全培养基重悬,按1×106/ml密度将细胞接种培养。实验所用BMMSCs为第2~4代细胞。流式细胞仪检测CD29、CD34、CD44、CD45的表达,进行表面标志鉴定。
1.3 大鼠卵巢颗粒细胞的分离、培养及鉴定 3~4周雌性Wistar大鼠皮下注射孕马血清(PMSG)60U/只,48h后断颈处死,取出卵巢。在解剖显微镜下用注射器针头刺破其表面的成熟卵泡,使颗粒细胞释放入培养液中,分离卵巢颗粒细胞。收集的细胞用PBS洗2次后加入适量培养液重悬培养24h后行HE染色。具体步骤:制备颗粒细胞爬片,经甲醛固定后依次通过无水乙醇、95%乙醇、80%乙醇脱水,进行HE染色,再依次通过95%乙醇、无水乙醇,晾干后中性树脂封片。置于光学显微镜下观察细胞形态。免疫组化法检测卵泡刺激素受体(FSHR)蛋白表达:将颗粒细胞接种于24孔板,待细胞贴壁后加入4%多聚甲醛固定,10%山羊血清封闭30min后,滴加FSHR兔多克隆抗体(1:500)4℃孵育过夜,加入聚合HRP标记抗兔IgG二抗室温下孵育30min。DAB显色5~10min,苏木精复染3min,盐酸乙醇分化,返蓝,自来水冲洗1min,脱水、透明、封片、镜检。
1.4 LV-miR-21的构建及转染 采用分子生物学方法构建miR-21慢病毒载体,慢病毒表达载体pLVX-shRNA2由Clontech公司提供(载体编号:VT1457)。以含有rno-miR-21-5p序列的DNA为模板进行PCR反应。将扩增片段用1%琼脂糖凝胶电泳进行分离纯化,并回收得到的目的片段。经BamH Ⅰ和EcoR Ⅰ进行双酶切后,再次纯化得到rno-miR-21-5p片段。pLVX-shRNA2空载体用BamH Ⅰ和EcoR Ⅰ进行双酶切后,回收线性化空载体。将线性化载体与纯化的PCR产物在T4DNA连接酶作用下置于16℃条件下连接过夜,转化E.coliDH5α感受态细胞,均匀涂在含氨苄青霉素的LB平板上,置于37℃条件下培养过夜。挑取少许菌落溶于LB培养液中,取1μl为模板,进行PCR扩增。得到的PCR产物采用琼脂糖凝胶电泳法进行初步鉴定;培养阳性克隆,提取质粒,送上海英骏生物技术有限公司测序。进行慢病毒载体的包装,测定滴度为1×109/ml。将携带miR-21基因的慢病毒液以感染复数(MOI)为20加入BMMSCs培养液中,感染24~48h后,荧光显微镜下观察绿色荧光蛋白的表达情况,计算感染效率。
1.5 miR-21的表达检测 实验分为3组:BMMSCs组(不转染病毒液)、LV组(转染空载病毒液)、miR-21组(miR-21慢病毒载体以MOI=20转染BMMSCs)。采用实时荧光定量qRT-PCR方法检测各组BMMSCs中miR-21的表达水平。实验步骤严格按试剂盒说明书进行,按RNA提取试剂盒说明书步骤提取细胞总RNA。取2ng细胞总RNA作为起始模板进行反转录,反应体系为10μl,每组设3个复孔。
1.6 BMMSCs过表达miR-21对颗粒细胞凋亡的影响 实验分为5组:正常组、磷酰胺氮芥(PM)组、miR-21组、BMMSCs组、miR-21-BMMSCs组。正常组颗粒细胞培养基中不加PM,PM组加入30μmol/L的PM诱导凋亡,miR-21组颗粒细胞培养基中加PM诱导凋亡后转染LV-miR-21,BMMSCs组、miR-21-BMMSCs组颗粒细胞培养基中加入PM 24h后分别与BMMSCs、miR-21-BMMSCs以1:1比例共培养,48h后采用流式细胞仪检测凋亡情况,采用qRT-PCR法检测miR-21、程序性死亡因子4(programmed cell death 4,PDCD4)、人第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome Ten,PTEN)mRNA的表达量,Western blotting检测PTEN、PDCD4蛋白表达水平。
1.7 实时定量PCR(RT-PCR)检测miR-21、PTEN和PDCD4 mRNA表达水平 RT-PCR反应条件为95℃10min;95℃预变性10s、60℃退火60s,共40个循环;熔解曲线反应条件为:95℃ 15s、65℃ 60min、95℃ 30s。2–ΔΔCt法分析实时定量PCR的结果。miR-21、PTEN和PDCD4定量分别采用miRNA U6、GAPDH为内参照。实验重复3次。引物序列:miR-21上游为5'-TAGCTTATCAGACTGATGTTG-3',下游为5'-GCTGTCAACGATACGCTACGTAACG-3';PTEN上游为5'-CCCAGTTTGTGGTCTGCCAGC-3',下游为5'-ATGAGCTTGTC-CTCCCGCCG-3';PDCD4上游为5'-TTGAGCACGGAGAT-ACGAAC-3',下游为5'-GTCCCGCAAAGGTCAGAAAG-3'。
1.8 Western blotting检测PTEN、PDCD4蛋白表达水平 使用细胞裂解液裂解细胞收集蛋白,测定蛋白浓度。SDS-PAGE电泳,分离蛋白;将PVDF膜封闭后加入用Western一抗稀释液稀释的兔抗人PDCD4(1:1000)、兔抗人PTEN(1:1000),4℃环境下杂交过夜;加二抗杂交溶液杂交26min。采用柯达凝胶成像仪行发光检测,结果以PTEN、PDCD4带与内参照β-actin条带光密度(OD)值的比值表示。实验重复3次。
1.9 统计学处理 采用SPSS 22.0软件进行统计分析。计量资料以±s表示,两组间比较用t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 BMMSCs的培养及鉴定 第3代BMMSCs细胞形态均一,为成纤维细胞样的长梭形,排列有序(图1A)。流式细胞仪检测结果表明90%以上细胞CD34和CD45为阴性,CD44和CD29为阳性,证实为BMMSCs。
2.2 构建miR-21慢病毒载体 使用限制性内切酶EcoR Ⅰ及BamH Ⅰ双酶切,T4DNA连接酶连接,将miR-21插入pLVX-shRNA2,构建LV-miR-21重组质粒。阳性克隆的测序结果显示重组质粒中插入的rno-miR-21-5p序列与目标序列完全一致,证实成功构建了miR-21慢病毒载体系统。携带miR-21基因的慢病毒液以MOI=20感染BMMSCs后,荧光显微镜下可见绿色荧光蛋白的表达(图1B),转染效率为92.20%±1.96%。
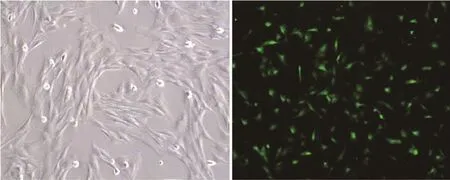
图1 BMMSCs的培养及转染Fig.1 Cultivation in vitro and transfection of BMMSCs
2.3 BMMSCs转染载体后miR-21的表达 RTPCR检测结果显示,BMMSCs组、LV组、miR-21组miR-21的表达量(分别为1.0154±0.0258,1.0191±0.0500,4.2410±0.4367)差异有统计学意义(F=268.032,P=0.000),其中miR-21组明显高于BMMSCs组及LV组,但BMMSCs组与LV组相比差异无统计学意义(图2)。
2.4 大鼠卵巢原代颗粒细胞的培养及鉴定 大鼠卵巢原代颗粒细胞培养2~3d可完全贴壁,呈单层贴壁集落样生长,胞质内可见颗粒样物质(图3A);HE染色后,显微镜下观察可见颗粒细胞形态呈多角形或短梭形,细胞核大而圆、深染,胞质富含颗粒及空泡,呈淡红色(图3B);此外FSHR免疫组化检测结果显示,>95%的细胞质内有棕色目的蛋白表达,蓝紫色的为细胞核(图3C)。
2.5 BMMSCs过表达miR-21对卵巢颗粒细胞凋亡的影响 流式细胞仪检测结果显示,正常组、PM组、miR-21组、BMMSCs组、miR-21-BMMSCs组的细胞凋亡率分别为10.4%±1.8%、33.4%±4.2%、27.0%±2.5%、28.0%±2.0%、19.6%±1.5%,5组间比较差异有统计学意义(F=59.35,P=0.00),其中miR-21-BMMSCs组细胞凋亡率明显低于miR-21组、BMMSCs组,但仍高于正常组。

图2 BMMSCs转染载体后miR-21的表达Fig.2 Expression of miR-21 in BMMSCs transfected with LV-miR-21
2.6 颗粒细胞miR-21及PTEN、PDCD4 mRNA和蛋白的表达 miR-21组、miR-21-BMMSCs组miR-21的表达水平明显高于其他各组,PTEN、PDCD4的mRNA和蛋白表达水平明显低于PM组、BMMSCs组(图4)。

图3 卵巢颗粒细胞的培养及鉴定Fig.3 Cultivation in vitro and identification of granulose cells

图4 各组颗粒细胞的凋亡情况及miR-21、PTEN、PDCD4 mRNA和蛋白表达情况Fig.4 Apoptosis of granulose cells and mRNA and protein expression of miR-21, PTEN and PDCD4
3 讨 论
近年来,全球恶性肿瘤发病率不断上升,且呈低龄化的趋势。化疗广泛用于恶性肿瘤的治疗,使患者的生存率得到明显提高,但化疗性卵巢早衰严重影响着化疗后女性的生活质量[13]。美国加利福尼亚州癌症中心的统计结果表明,在接受化疗的育龄期乳腺癌女性患者中,卵巢早衰的发病率为55%[14]。卵巢既是生育器官,同时也是重要的内分泌器官,对体内外因素非常敏感,易受到各种理化因素的损害。目前认为,化疗药物主要影响卵泡的生长、发育和成熟,导致卵泡闭锁和卵巢组织纤维化,以及颗粒细胞的凋亡。已有的体内外化疗药物毒性实验中均检测到卵巢颗粒细胞凋亡事件的发生。颗粒细胞是组成卵泡的最大细胞群,是雌、孕激素的主要来源,对维持卵泡正常的结构和功能起着举足轻重的作用,颗粒细胞的凋亡与卵泡的闭锁密切相关。因此,抑制卵巢颗粒细胞的凋亡和卵泡闭锁,就有可能延缓或避免卵巢早衰的发生。目前治疗卵巢早衰的方法包括激素治疗、促性腺激素释放激素激动剂治疗、卵子胚胎冷冻、卵巢组织冷冻移植等,但这些治疗方法的效果均欠佳[15]。
间充质干细胞具有自我更新及分化为多种细胞的能力,可以修复受损的器官结构及其功能,从而为化疗诱导的卵巢功能早衰提供替代治疗。BMMSCs移植可用于治疗多种损伤性疾病,如心肌、脑、脊髓、皮肤及颌面部损伤等,已在多种疾病的动物模型中得到证实[6-7],且已取得了满意的临床疗效。本课题组前期研究将BMMSCs引入卵巢早衰的治疗中,并通过体内外实验证实了BMMSCs对化疗性卵巢早衰的修复作用,初步证实其修复作用与抑制卵巢颗粒细胞的凋亡密切相关[8],但治疗效果不如预期,考虑移植后BMMSCs的迅速大量凋亡是导致治疗效果不佳的主要因素。因此实施预处理提高移植细胞的存活率是提高疗效的关键所在。
miR-21是一种较早在人体中发现且分布相对广泛的miRNA,在细胞核内通过RNA聚合酶Ⅱ转录先形成pri-miR-21,再进行修饰,进一步形成成熟的miR-21。miR-21具有促进细胞增殖、抑制细胞凋亡的作用,在多种肿瘤细胞及组织中都具有较高水平的表达[9]。miR-21对卵巢颗粒细胞的凋亡及卵泡发育过程亦具有重要的调控作用。研究证实,miR-21可抑制小鼠卵巢颗粒细胞的凋亡,增加排卵率[12]。近期研究发现过表达miR-21的BMMSCs凋亡减少,存活力增强,其机制可能与下调靶基因PTEN的表达从而实现对PI3K/Akt通路的调控密切相关[16]。本实验将miR-21-BMMSCs与化疗药物诱导凋亡的颗粒细胞共培养,结果显示过表达miR-21的BMMSCs具有更强的抑制卵巢颗粒细胞凋亡的能力。据报道,miR-21的靶基因约有190个,目前研究较为透彻的是PDCD4、PTEN,均在细胞凋亡调控中发挥作用。PTEN通过调控下游PI3K途径,对卵巢颗粒细胞的增殖和凋亡产生影响。PTEN水平下调,磷酸化PIP-3则激活蛋白激酶B(Akt)通路,诱导细胞生长、增殖以及抑制细胞凋亡[17],如PTEN表达不平衡将导致卵巢功能衰竭[18]。PDCD4能结合真核细胞翻译起始因子4E(elF4e),抑制其复合物的产生,从而在起始阶段调节蛋白翻译过程[19]。PDCD4参与脂多糖(LPS)介导的细胞凋亡。在LPS信号通路中,Toll样受体4(TLR4)上调可增加PDCD4表达,诱导下游IL-10以及NF-κB的表达,导致细胞凋亡。因此,PTEN及PDCD4在细胞凋亡中发挥着重要的调控作用,下调PTEN及PDCD4的表达能够抑制细胞凋亡。本研究检测了miR-21相关靶基因PTEN、PDCD4 mRNA及蛋白的表达,结果显示过表达miR-21的BMMSCs中PTEN、PDCD4的表达降低,证实了miR-21可通过下调PTEN及PDCD4的表达抑制卵巢颗粒细胞凋亡。
总之,本研究结果提示,BMMSCs过表达miR-21可明显减少卵巢颗粒细胞的凋亡,其机制可能与下调靶基因PTEN、PDCD4的表达密切相关。

