不同生存期食管鳞癌患者载脂蛋白D表达水平的研究*
李晓静 孙妞妞 李秀敏
食管癌是最常见的恶性肿瘤之一[1],预后较差,目前研究显示中晚期食管癌患者的5年生存率约为15%[2],甚至有的患者可长期带瘤生存[3]。阐明其分子机制能够为探寻食管癌新的治疗靶点奠定分子基础,也可为临床上预测生存风险、实施个体化治疗提供依据。本研究主要应用绝对定量法(isobaric tags for relative and absolute quantification,iTRAQ)联合基质辅助激光解吸离子化串联飞行时间质谱(MALDITOF/TOF MS)技术,对不同生存期食管癌患者的差异蛋白进行对比分析,获得与食管癌生存期相关的血清关键候选蛋白,并进一步验证,探讨其能否成为预测食管癌患者预后的一种生物标记物。
1 材料与方法
1.1 研究对象
收集2008年3月至2009年9月河南省食管癌高发地区安阳市肿瘤医院经组织学或细胞学确诊食管鳞状细胞癌并行根治性切除食管癌的患者731例,收集其一般资料(包括流行病学资料、疾病治疗情况、生活习惯、手术时间、病理诊断、TNM分期、肿瘤大体类型、肿瘤大小、肿瘤部位、分化程度等资料)建档作为资料库,收集其术前血清标本,并于术中选取癌组织标本、正常食管黏膜(距手术切缘10 cm)。随机从资料库抽取生存期≤3年和生存期≥5年的患者各34例作为研究对象,其中男45例,女23例,年龄37~89岁,平均(61.25±3.74)岁。高分化鳞癌23例,中分化鳞癌42例,低分化鳞癌3例。对68例患者进行跟踪随访,明确患者术后生存时间;随访间隔时间为第1年每3个月1次,第2年每6个月1次,以后每年1次,直至患者死亡,随访时间截止到2013年9月,中位随访时间为58(36~72)个月。该研究已获得医院伦理委员会批准,并获得所有患者知情同意。
纳入标准:组织学或细胞学确诊食管鳞癌;经临床评价可手术切除的肿瘤;患者能够耐受腹部胸部外科手术或其他治疗;既往无消化系统及其他癌症病史;在手术前未进行化疗或放疗等相关治疗;临床病理资料完整;签署知情同意书者。
排除标准:组织学或细胞学确诊食管腺癌;未行手术根治术者;有肿瘤家族史者;术前接受过化疗或放疗等相关治疗;临床病理资料有缺失者;未签署知情同意书者。
1.2 方法
1.2.1 一般资料 根据美国联合委员会癌症-国际抗癌联盟(AJCC-UICC)分期手册TNM分期系统的临床病理分期进行评价,临床病理特点包括患者的性别、年龄、肿瘤大小、肿瘤位置、TNM分期、肿瘤分化程度等(表1)。
1.2.2 定量蛋白组学 血清标本取材后快速冷冻于液氮中并保存于-80℃冰箱中,实验开始后需先将血清样本解冻,然后每组选取合适样品进行等体积合并成3组样本池后,去除血清中的高丰度蛋白质,待低丰度蛋白质组分浓缩后离心取上清,进行蛋白质定量;取约20 μg蛋白质样品进行电泳,使用考马斯亮蓝染色后评估原血清和低丰度蛋白样品;再取约150 μg蛋白质样品进行酶解和肽段定量,然后按照iTRAQ Reagent-8plex Multiplex Kit(AB SCIEX)试剂盒说明书进行8标同iTRAQ标记肽段,每组标记2次进行技术重复;混合标记后的所有肽段,MALDITOF/TOF MS进行分析得到多肽片段的定量信息,进行SCX预分级和质谱鉴定分析。

表1 不同生存期食管癌患者的临床病理资料
1.2.3 Western blot检测 取解冻后的血清标本约5 μL,加 15 μL去离子水和 5 μL Loading buffer配成25 μL样本混合液,-20℃冰箱过夜;使用12%分离胶及4%浓缩胶进行制胶,缓慢加入样本混合液后进行电泳,待溴酚蓝跑出即可终止,然后转膜;转膜后使用封闭液进行封闭过夜,再使用二抗进行孵育;然后使用显影液进行显影、曝光;使用Image J软件对所得蛋白质条带进行光密度分析,以ApoD与β-actin光密度的比值来表示该蛋白在食管癌不同生存期患者血清中的相对表达含量。
1.2.4 免疫组织化学检测 将石蜡包埋的组织样本切成5 μm厚的切片,于64℃烤箱中烘烤1 h,晾至室温。按SABC免疫组织化学染色试剂盒(SA2002-兔IgG)说明书进行操作,以DAB显色,PBS缓冲液代替一抗作为阴性对照。采用Leica Application Suite图像采集系统采集图片,采用Image-Pro Plus 6.0图像分析软件分析图像,以积分光密度(IOD)为指标对各组阳性染色做定量分析。
1.3 数据分析
蛋白组学质谱分析使用软件Mascot 2.2和Proteome Discoverer1.3(thermo)进行查库鉴定及定量分析,使用Proteome Discoverer 1.3软件对肽段报告离子峰强度值进行定量分析。实验数据采用SPSS 13.0软件进行统计分析,计量资料以表示,用t检验进行分析;计数资料采用χ2检验评估,P<0.05为差异有统计学意义。
2 结果
2.1 iTRAQ联合MALDI-TOF/TOF MS的结果
质谱分析结果经Mascot 2.2软件查库,对有明确定量信息的蛋白质进行定量分析显示:本实验中共556种蛋白有详细的定量信息,其中表达具有显著差异性的蛋白有253种,有52种蛋白的表达随生存期延长而上调,48种蛋白的表达随生存期延长而下调。本研究进一步对生存期≤3年、≥5年的两个极端生存期之间表达蛋白进行比较,经筛选并鉴定出与食管癌生存期相关的五个关键差异蛋白,依次分别为:碳酸酐酶Ⅰ、碳酸酐酶Ⅱ、血管紧张素、ɑ-2巨球蛋白以及载脂蛋白D(表2)。
由表2可以筛选出ApoD五个关键差异蛋白,且其表达情况表明该蛋白与食管癌长生存期呈明显正相关关系,对该蛋白进一步进行heatmap层次聚类分析,发现各组之间存在明显的差异(图1)。

表2 iTRAQ结合2-D MALDI-TOF/TOF MS技术筛选出与食管癌生存期相关的差异蛋白
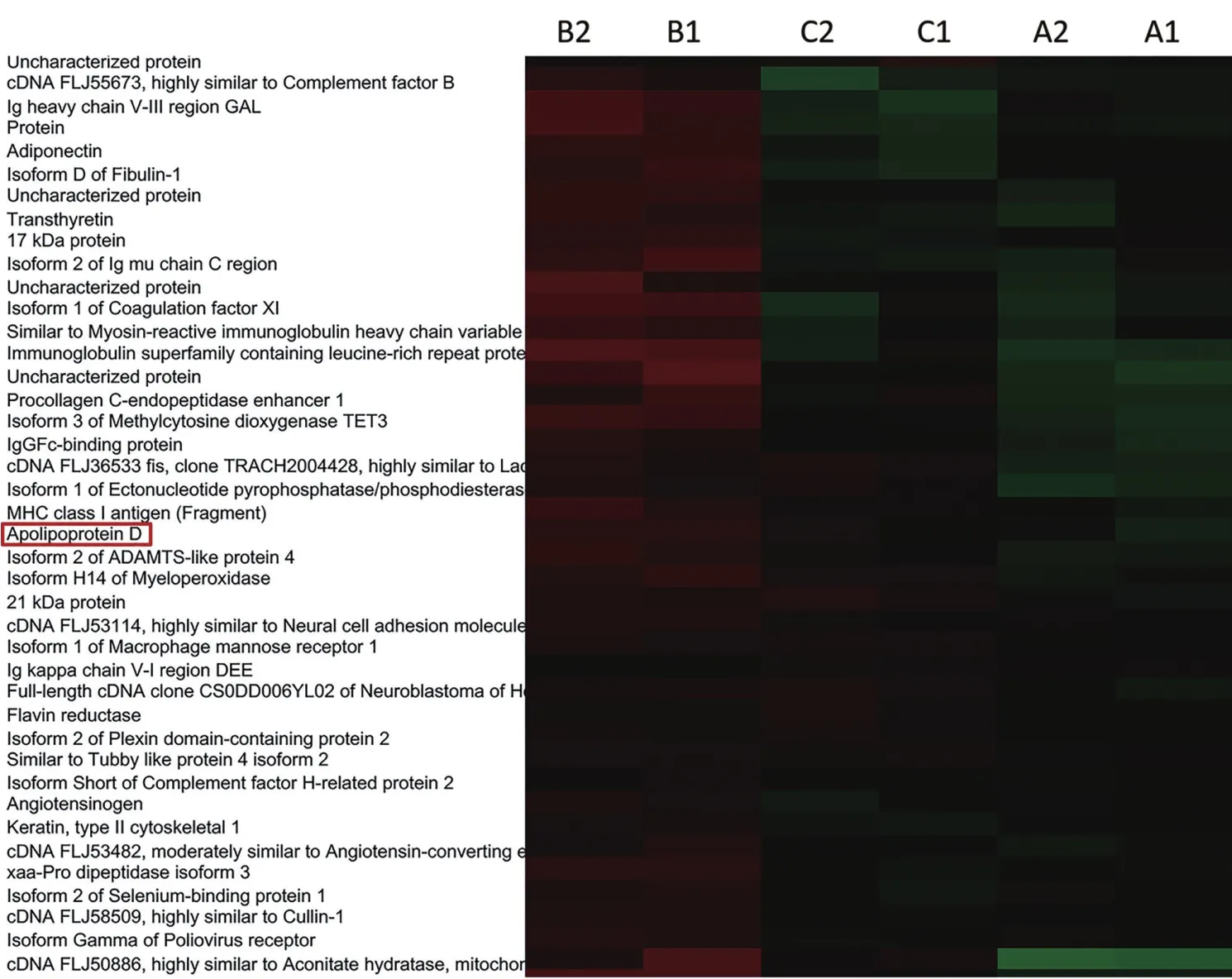
图1 ApoD在食管癌及正常人血清中的层次聚类分析
2.2 Western blot结果
研究结果显示ApoD在生存期≥5年组血清中表达最高,正常人血清中表达其次,而在生存期≤3年组中表达最低。生存期≥5年组与正常人组的光密度值相比以及生存期≤3年组与生存期≥5年组的光密度值相比,差异均有统计学意义(P<0.01,图2)。
2.3 免疫组织化学结果
ApoD蛋白阳性染色细胞表现为棕黄色或者褐色颗粒,平均积分光密度(IOD/面积)表示免疫反应物的表达强度。研究结果显示:ApoD在正常食管鳞状上皮中高表达,而在癌组织中低表达,其中生存期≥5年组表达情况高于生存期≤3年组;生存期≥5年组与食管正常组织的光密度值相比,差异有统计学意义(P<0.01,图3);生存期≤3年组与生存期≥5年组的光密度值相比,差异有统计学意义(P<0.05,图3)。
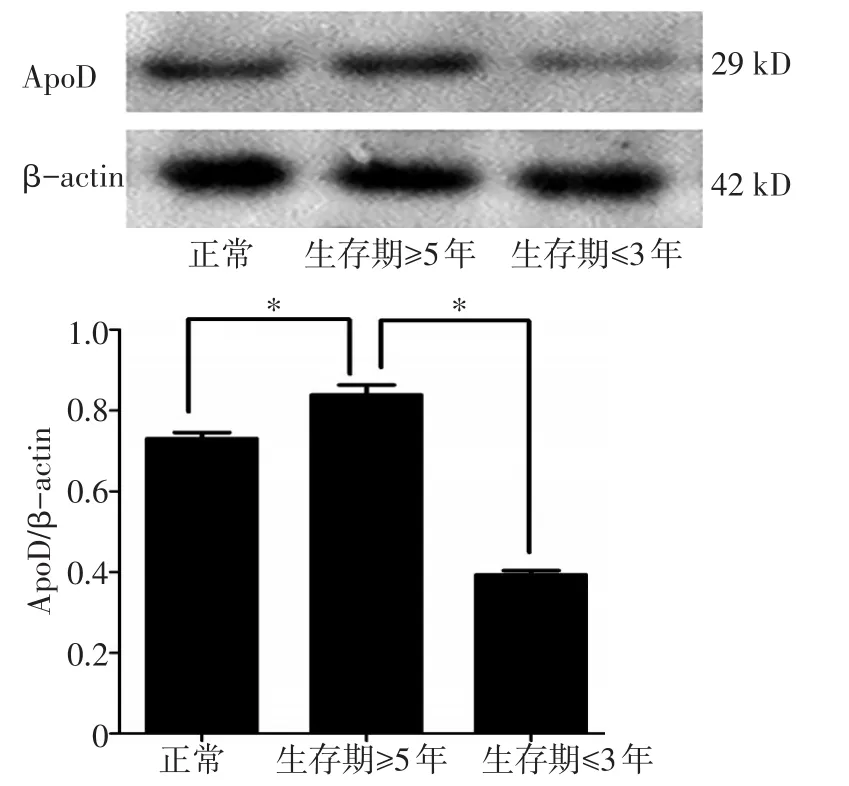
图2 Western blot检测ApoD在不同组血清中的表达。n=10,*P<0.05
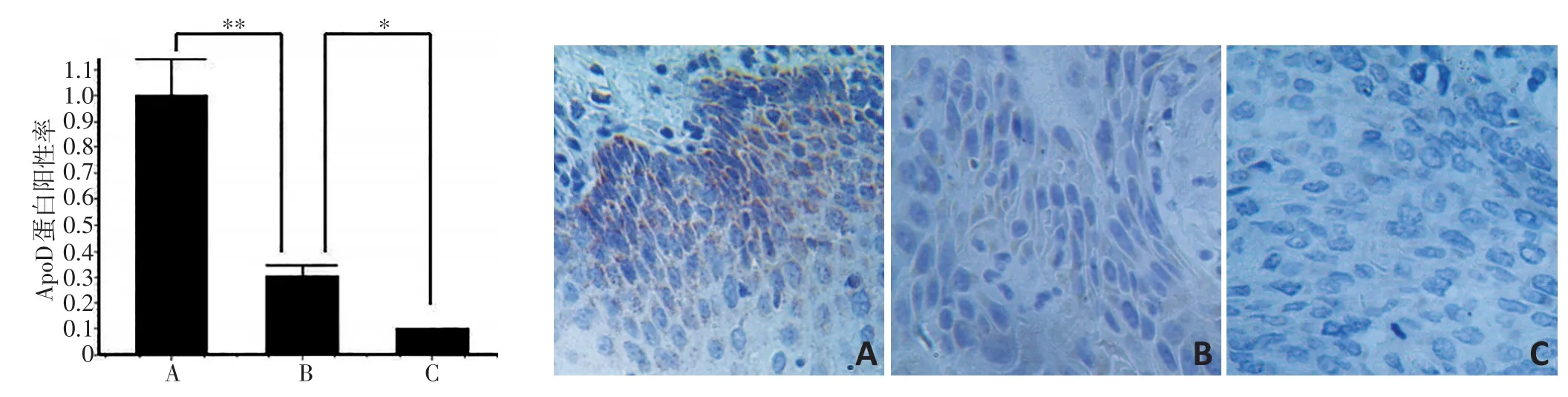
图3 ApoD在食管癌正常组织及癌组织中的表达(Masson染色×200)
3 讨论
食管癌是世界上最常见的六大恶性肿瘤之一[1],该病发病率高,预后差,容易发生转移[4]。河南林州地区是中国也是世界上食管癌发病率和死亡率最高的地区之一,病理分型以鳞癌为主[5]。目前,临床上多采用TNM分期等方法来预测该病的预后情况,却也存在部分TNM分期晚的患者有较长生存期,所以这类方法并不能准确地预测食管癌的预后[6]。随着分子生物学的研究进步,人们发现食管癌的发生发展是一个多因素、多步骤和多基因参与的复杂过程,关键基因在这一过程中的表达改变可能对食管癌的预防、诊断和治疗都有非常重要的意义[7]。因此,本研究拟从分子生物学方面寻找到某些生物标志物,以期可以快捷准确地预测食管癌的发病情况及患者的预后,从而采取积极的干预措施。
本研究采用iTRAQ试剂标记的荧光胶内差异双向电泳(2-D DIGE)联合基质辅助激光解吸离子化串联飞行时间质谱(MALDI-TOF/TOF MS)蛋白质组学研究方法,对生存期≤3年、≥5年的两个极端生存期食管癌患者血清蛋白进行gene ontology分析,获得与食管癌生存期相关的血清关键候选蛋白。并结合heatmap层次聚类分析结果,得到52种蛋白与食管癌生存期呈正相关,如载脂蛋白D、ɑ-2巨球蛋白等;有50种蛋白与食管癌生存期呈明显负相关。这与Pawar等[8]的研究基本一致;本研究对差异蛋白逐个分析比较,最终锁定针对食管癌患者生存期呈正相关的蛋白ApoD进行进一步验证。
ApoD是与食管癌生存期正相关的52种蛋白之一,同时也是一种存在多个配基的多功能蛋白[9]。既往研究表明,ApoD参与免疫反应、细胞凋亡、胚胎的发育和分化、神经系统的发生和损伤修复以及肿瘤发生等生命活动和过程[10]。本研究发现,ApoD在生存期≥5年组血清中表达最高,正常人血清中表达其次,而在生存期≤3年组中表达最低,这也印证了此前一项ApoD与食管癌的相关研究[11],表明ApoD是一种强有力的肿瘤生长活性抑制基因这一发现。
由于血清中能够监测到的物质多会受到癌组织的影响,目的蛋白可能在组织中也有类似的表达。本研究发现ApoD在正常食管鳞状上皮中高表达,在生存期≥5年组癌组织中表达次之,在生存期≤3年组癌组织中表达最低。虽然组织验证的结果与血清结果不完全一致,考虑可能是由于ApoD属于血浆蛋白,在血清中的表达更为敏感,组织中的表达趋势与之不完全一致也是可能的[12]。本研究中,虽然组织和血清中的ApoD趋势不完全一致,但均说明该蛋白的高表达可能预示着食管癌患者会有更好的预后、更长的生存期限。
同时,ApoD基因可能具有复杂的调控网络,其在肿瘤中的作用及机制仍存在争论,如乳腺癌[13]、卵巢癌[14]、前列腺癌[15]、肝癌[16]、中枢神经系统肿瘤[17]、大肠癌[18]、食管癌[19]、皮肤恶性黑色素瘤[20]以及视网膜母细胞瘤[21]等都能不同程度地检测到ApoD。已有数据表明,在胃癌等癌症中,ApoD的高水平和良性预后有关,甚至ApoD已经作为一种能够预测预后的生物相关标记被提出来[22]。本研究结果显示ApoD在正常人群血清和食管组织中高表达,在食管癌患者术前血清和癌组织低表达,且生存期≤3年组的表达情况明显低于生存期≥5年组。综上所述,推测该蛋白高表达可能在某种程度上抑制了肿瘤的生长和侵袭,提示患者拥有更长的生存期,说明该蛋白确实有可能成为预测食管癌患者预后的参考指标之一。

