胰腺导管腺癌中酪氨酸蛋白激酶-7的表达及临床意义*
胰腺癌是治疗效果最差的恶性肿瘤之一,针对胰腺癌的治疗,无论是手术方式的改进,还是新型药物的问世,都未能在根本上改善胰腺癌患者的预后,其5年生存率徘徊在5%左右[1-4]。胰腺癌的发生、发展是一个极其复杂的过程,是多种因素共同作用的结果。85%以上的胰腺癌来源于胰腺导管上皮细胞,因此研究导管腺癌对胰腺癌的诊疗意义较大[1-3];胰腺癌的发病率近年来呈上升趋势,据估计,2017年美国新发53 670例,死亡人数将达到43 090例[1]。根治性手术切除作为唯一可治愈胰腺癌的方法,在胰腺癌患者中的比例很低[2]。胰腺癌的高死亡率和其早期难以发现、术后极易复发尤其是缺乏有效的治疗有关,而突破诊治胰腺癌的关键在于深入探究胰腺癌发生发展的机制,针对相关靶点进行有效的治疗。
酪氨酸蛋白激酶-7(protein tyrosine kinase-7,PTK7)也被称为结肠癌激酶-4(colon carcinoma kinase-4,CCK4),是一种在人体内由PTK7基因编码的具有催化活性的受体酪氨酸激酶,包括七个细胞外免疫球蛋白样结构域,一个跨膜区域,一种黄化膜区域和一个催化惰性细胞质的酪氨酸激酶域[5]。PTK7具有多种生物学功能,包括胚胎形成管的生成[6]和多能干细胞功能[7],还有其在恶性肿瘤发生发展过程中的具有争议性的功能和作用。有研究报道,PTK7在多种实体肿瘤中有较高的表达水平,这些肿瘤包括结直肠肿瘤[8]、肝细胞癌[9]、肝内胆管癌[10]、前列腺癌[11]、胃癌[12]、乳腺癌[13]、非小细胞肺癌[14]、口腔鳞癌[15]和食管鳞癌[16]等,且PTK7的异常高表达常提示不良的预后。然而,PTK7在某些肿瘤中低表达,如透明细胞肾细胞癌[17]、黑色素瘤[18]和上皮性卵巢癌[19]。还有类似的研究报道,发现PTK7在乳腺癌中细胞株中表达水平下降[20],以及在肺癌中PTK7通过抑制ERK和AKT的磷酸化而发挥抑癌作用[21]。此外,还有研究结果证实PTK7阴性表达的生存预后比阳性表达结果更差,从而提示PTK7可能在卵巢浆液性癌中是一种肿瘤抑制因子[22]。综上所述,上述所有的研究结果表明,在不同肿瘤中PTK7蛋白的表达水平和生物学功能是完全不同的,其具体作用取决于特定的肿瘤和相关的机制。迄今为止,胰腺导管腺癌中PTK7的表达情况还不明确。
本研究通过回顾性分析天津医科大学肿瘤医院2011年5月至2016年1月接受胰腺癌根治手术治疗的85例胰腺导管腺癌患者的临床病理特征与随访资料,应用免疫组织化学的方法检测胰腺导管腺癌组织中蛋白酪氨酸激酶-7蛋白的表达,分析和探究PTK7蛋白在胰腺导管腺癌组织中的表达及其临床意义和价值,从而为胰腺癌患者的靶向治疗提供一定的理论依据。
1 材料与方法
1.1 临床资料
收集2011年5月至2016年1月期间天津医科大学肿瘤医院85例胰腺导管腺癌患者行根治性手术切除的组织标本,分析其临床病理资料。患者均行根治性手术切除治疗,全部病例均病理证实为胰腺导管腺癌,术前未经化疗或放疗,均具有完整的病例资料。收集患者的一般临床资料,包括性别、年龄、肿瘤位置、肿瘤大小、手术方式和CA19-9水平等。85例患者年龄39~58岁,中位年龄(50.6±4.93)岁;其中男性44例,女性41例;肿瘤大小:≤2 cm者25例,>2 cm者60例;组织学分化程度:中高分化腺癌32例,中低分化腺癌53例;肿瘤分期:Ⅰ期6例,Ⅱ期50例,Ⅲ期29例,本组入选无Ⅳ期病例;淋巴结转移:阴性者37例,阳性者48例;脉管内瘤栓者46例。
比较分析不同组患者的临床病理学特征,包括:分化程度、淋巴结转移、血管受侵、脉管内瘤栓、神经受侵、肿瘤分期。随访:以电话和查阅病历的方式随访。随访起始时间为手术时间,随访截止时间为2017年12月或患者死亡时间。统计学比较两组患者一般临床资料和临床病理学资料及分析预后影响因素。
1.2 细胞和试剂
胰腺癌细胞系PANC-1(人类胰腺腺癌)和BXPC-3(胰腺的原发性腺癌)购自美国ATCC。两种细胞前者用DMEM培养,后者用Roswell Park Memorial Institute 1640培养基培养。所有细胞培养介质中含10%胎牛血清,100 μL/mL青霉素和链霉素,在37°C含5%二氧化碳的细胞孵育箱中培养细胞。PTK7购自北京博奥森生物技术有限公司(Catalog No:bs-18542R),为兔抗人多克隆抗体,实验的稀释浓度为1:600。免疫组织化学二步法检测试剂盒购自北京中衫金桥生物技术有限公司(PV6002,通用型二抗)。行Western blot的抗体anti-β-actin(1:1 000稀释,ab8226,Abcam plc,Cambridge,UK),抗体 anti-Ki67(1:1 000稀释,ab16667,Abcam plc,Cambridge,UK),抗体 anti-proliferating cell nuclear antigen(PCNA)(1:500稀释,ab29,Abcam plc,Cambridge,UK)。shRNA 1 for PTK7(NM_152881)购自 ViGene Biosciences公司,序列如下:AACATCAAATGGATTGAGGCAGG。Lipofectamine™2000 Transfection Reagent购自Thermo Fisher Scientific,货号:11668027。
1.3 方法
1.3.1 免疫组织化学检测 胰腺导管腺癌组织进行福尔马林固定,石蜡包埋,标本进行5 μm切片,行PTK7免疫组织化学染色。免疫组织化学采用SP二步法,DAB显色。染色切片于显微镜高倍镜下(400倍)随机计数10个视野,计数100个肿瘤细胞,根据肿瘤细胞阳性染色百分率和染色强度综合评价免疫组织化学结果。
1.3.2 RNAi转染 提前将细胞培养液换成不含血清培养基;将stealth RNAi和Lipofectamine 2000分别混匀后室温静置孵育,后混合两者,加入到细胞培养液中。
1.3.3 Western blot 裂解细胞后测定蛋白浓度,制胶,上样,电泳,电转膜,封闭,将适宜浓度的一抗加到PVDF膜上,4℃过夜后,用TBST洗净,将二抗用1%BSA稀释到适合浓度(1:5 000)加到膜上,室温下孵育1 h,后TBST摇床上洗涤3次,增强化学发光法显色。
1.3.4 MTT细胞存活实验 收集不同组别的对数期细胞,调整细胞悬液浓度为50 000个/mL,每孔加入100 μL细胞悬液(每孔5 000个细胞),保证细胞密度均匀,细胞放入培养箱培养一定时间后每孔加入20 μL-MTT(5 mg/mL),培养3~4 h。终止培养,小心吸去孔内培养液。每孔加入150 μL DMSO 37℃温箱孵育10 min,之后用酶标仪检测OD570 nm的各孔的吸光度值。
1.3.5 克隆形成实验 两种细胞分别取相等数目加含有血清的培养液,每孔中大约放入300个细胞,使其均匀分布;培养大约两周后取出6孔细胞培养板放在倒置显微镜下观察有>50个细胞的克隆形成;加结晶紫染色30 min左右后缓慢洗净照相。
1.3.6 免疫组织化学染色结果的判定 PTK7蛋白表达主要表达于胰腺导管腺癌肿瘤细胞的胞浆,也有轻微的不同程度的胞核着色,呈棕黄色颗粒状。结果判定如下,阳性肿瘤细胞数<10%记0分;肿瘤细胞阳性百分率为10%~25%记1分;肿瘤细胞阳性百分率为25%~50%记2分;肿瘤细胞阳性百分率>50%记3分;同时对阳性着色的肿瘤细胞的浆、核染色强度进行评价:阴性记0分,弱阳性记1分,中度阳性记2分;将阳性细胞百分率分值和染色强度分值之积的分值作为最后计分,计分范围为0~6分。实际结果判断为高表达(4~6分)或低表达(0~3分)。每个病例观察10个高倍视野,在不知病理分级与临床资料的情况下由两位经验丰富的病理科医师读片,双盲法判断结果。
1.4 统计学分析
采用SPSS 22.0软件进行统计学处理。两组计量资料的比较采用t检验,计数资料的比较采用χ2检验。生存率的计算采用Kaplan-Meier法,生存曲线的比较采用Log-rank检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 PTK7在胰腺导管腺癌组织中的表达
85例原发性胰腺导管腺癌组织中PTK7蛋白有60例(78.9%)高表达,85例癌旁组织(距离肿瘤组织3~5 mm处的胰腺正常组织)中45例(52.9%)呈高表达,免疫组织化学的染色结果见图1和图2。胰腺导管腺癌与癌旁组织阳性率比较(χ2=5.604,P=0.018<0.05),其表达差异具有统计学意义。
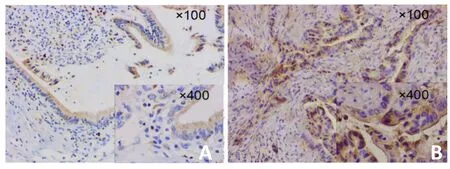
图1 PTK7在胰腺导管腺癌组织中的表达
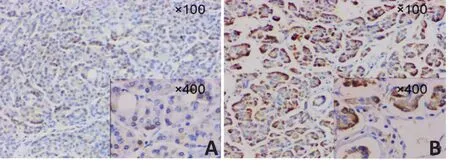
图2 PTK7在胰腺导管腺癌癌旁组织中的表达
2.2 胰腺导管腺癌组织PTK7的表达与临床病理特征和预后的相关性
PTK7的异常表达与胰腺导管腺癌分期、淋巴结转移和脉管内瘤栓相关(P<0.05,表1),与患者的性别、年龄、分化程度、肿瘤大小无关。患者预后生存分析结果,PTK7均与患者预后明显相关(P<0.05,图3):PTK7高表达的胰腺导管腺癌患者术后中位生存期明显短于PTK7低表达的胰腺导管腺癌患者(11.50±0.870)个月vs.(20.90±2.168)个月。
2.3 shRNA干扰PTK7后抑制细胞增殖能力
通过shRNA干扰PTK7后建立细胞稳系,行Western blot验证PTK7的蛋白表达水平降低了(图4A,P<0.05),且MTT和克隆形成结果显示,shRNA实验组较对照组细胞存活数显著减少,克隆形成数显著减少(图4B,P<0.05),增殖相关蛋白Ki-67和PCNA的表达水平显著降低(图4C和4D,P<0.05)。
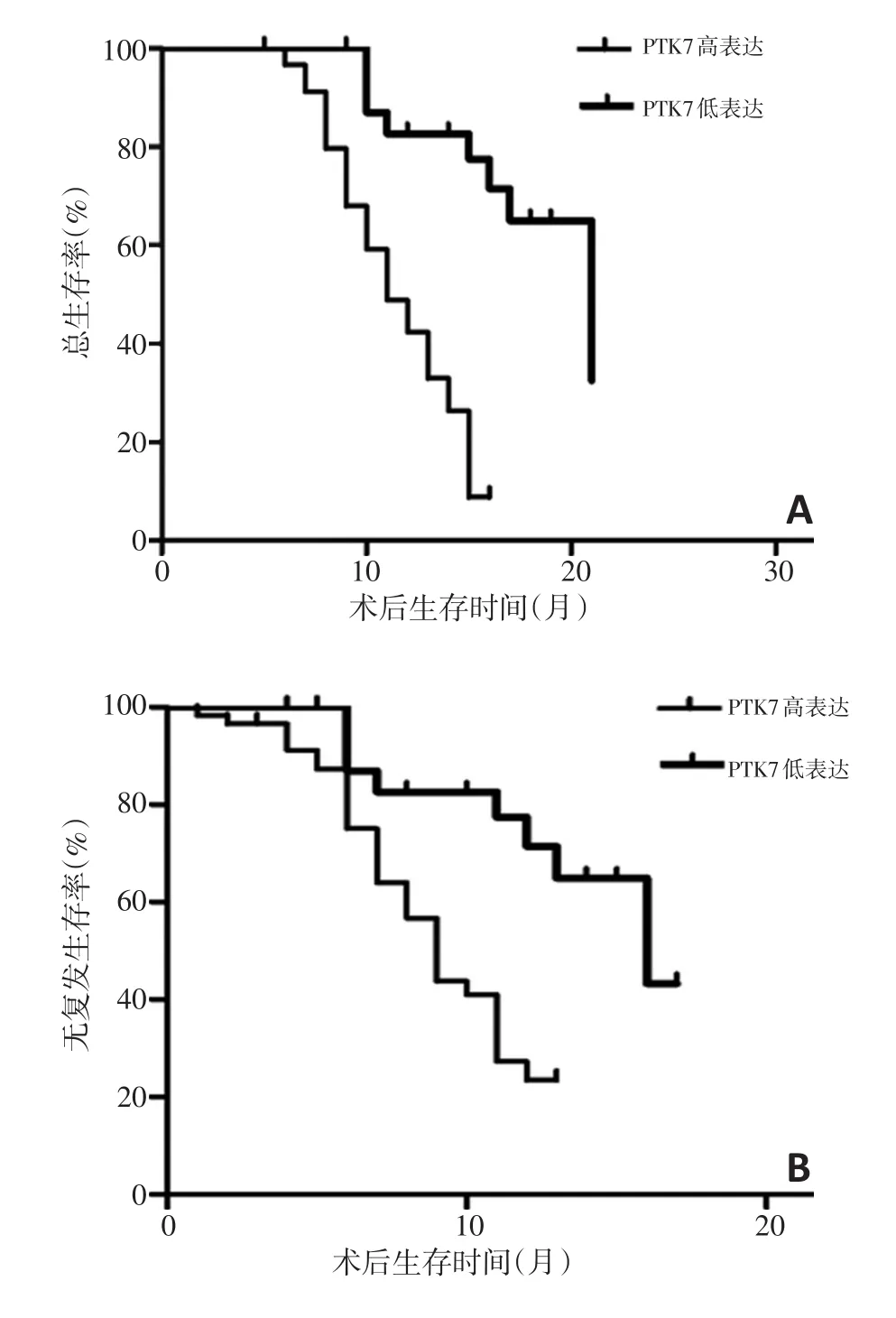
图3 PTK7与胰腺导管腺癌患者术后预后相关性分析

表1 胰腺导管腺癌PTK7表达与临床病理特征的关系
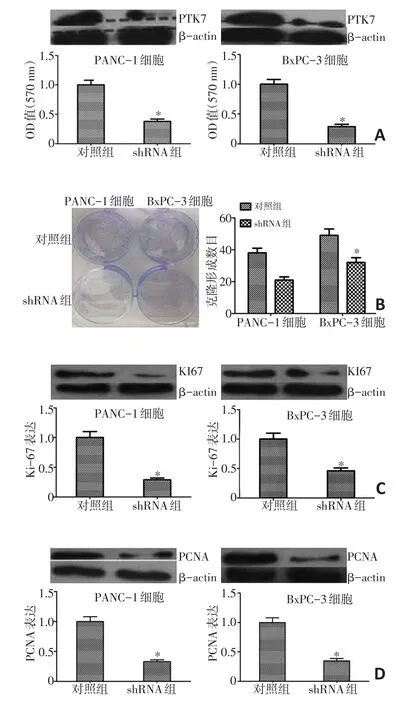
图4 shRNA干扰PTK7后抑制胰腺癌细胞增殖
3 讨论
有关PTK7在不同肿瘤中的表达,多项研究报道不同的观点与结论,这提示同一基因可能在不同类型的肿瘤中具有完全不同的作用。最新的一项荟萃分析通过汇总数据的元分析,提供PTK7与恶性肿瘤风险、临床参数和DFS等的相关证据,结果显示高表达的PTK7可能促进恶性肿瘤的发生发展[5]:PTK7在恶性肿瘤组织中呈现高水平的异常表达,且这种高水平表达提示肿瘤组织学级别水平高,且提示较短的无病生存率和更差的总生存率。与大多既往研究的结果基本一致,本项研究表明PTK7在胰腺导管腺癌中呈现异常高表达,且这种异常高表达和胰腺癌分期、淋巴结转移和脉管内瘤栓相关,提示了预后不良。有研究指出,在多种肿瘤组织中PTK7表达情况的相关性研究,选用的对照组的组织(正常组织、癌旁组织、炎性组织或者良性肿瘤组织等)不尽相同,因此可能存在结论的不一致性[5]。例如,有研究报道应用正常结直肠黏膜和腺瘤为对照[8]。Zhang等[10]用了良性前列腺增生作为对照组。Jin等[11]使用正常的胆道组织作为对照。为了评价PTK7在肿瘤发生过程中的作用,有研究指出,对照组不能选择从腺瘤或炎性增生中获得的组织,而应该选择正常组织,这样才能进一步分析肿瘤发生过程中PTK7水平的变化。本研究应用癌旁正常组织作为对照,虽然没有完全应用正常胰腺组织,但也能反映肿瘤发生前后PTK7水平的变化情况,并且在一定程度上消除或者减少了个体和组织微环境的差异,因此结果是可信和有价值的。此外,Asad等[19]发现PTK7在92.86%(13/14)正常输卵管上皮和45.10%(92/204)上皮性卵巢肿瘤组织中表达阳性,该研究不同于既往研究的结果,是唯一报道PTK7在正常组织中比在肿瘤组织呈现更高比例的阳性表达;虽然其中的原因尚不清楚,但这一发现提示PTK7在维持组织功能方面可能也起着重要作用。并且,既往的荟萃分析研究结果表明PTK7高表达提示更高的癌症风险、更高的组织学分级、更低的总生存率和无病生存率[5],和本研究的结果一致。进一步查阅文献,发现与PTK7表达水平低的肿瘤细胞相比较,其表达水平高的肿瘤细胞表现出更强的增殖、DNA合成、入侵和迁移能力[5,16]。然而,Golubkov等[23-25]报道 PTK7则能抑制癌细胞的侵袭和迁移。目前,PTK7在不同肿瘤中的这些不同功能和机制仍不明确。本研究结果显示,在胰腺癌细胞系中,PTK7能通过调节增殖相关因子Ki-67和PCNA的水平进而促进胰腺癌细胞的增殖,并且其异常高表达提示不良的预后。这可能提示,在胰腺癌组织中PTK7通过促进肿瘤细胞增殖的机制参与胰腺癌的发生发展,产生了一系列的生物学效应,进而影响了胰腺癌分期、淋巴结转移和脉管内瘤栓,从而导致患者预后不良。
另外,在PTK7和恶性肿瘤机制的关系,也有一些有价值的线索:Golubkov等[25]发现全长膜PTK7通过下调肌凝蛋白的链磷酸化来降低纤维肉瘤HT1080细胞的迁移效率;然而,PTK7针对基质金属蛋白酶的蛋白水解片段则能促进HT1080细胞的侵袭。PTK7在癌细胞通过蛋白酶的裂解,形成各种消化片段;与完整的PTK7相比,这些蛋白水解产物发挥不同的功能[5]。最近,有几项研究试图解释清楚PTK7在不同类型恶性肿瘤中的明确作用和机制:Shin等[16]发现PTK7通过激活AP-1和NF-κB增加细胞的侵袭能力;有研究发现在神经胶质瘤细胞系中,PTK7通过调节TGF-b/Smad signaling信号通路来抑制细胞增殖和致瘤潜能,并诱导CD44细胞凋亡[26]。但是,这些研究都是将全长的PTK7作为一个整体进行分析,而忽视了PTK7的不同片段蛋白水解产物的不同作用。
综上所述,本研究结果表明,PTK7过度表达与胰腺导管腺癌的恶性临床病理特征相关,提示更差的总体生存率和更短的无病生存时间,表明PTK7可以作为预测胰腺导管腺癌不良预后的一种生物标志物。并且,体外细胞实验发现PTK7能通过调节增殖的相关因子来促进胰腺癌细胞增殖。然而,需要在体内外实验中进一步研究其相关的机制。相信随着对其作用机制的深入研究,PTK可能会成为胰腺导管腺癌治疗的一个新靶点。

