葡萄糖调节蛋白78在口腔鳞状细胞癌组织中的表达及其对化疗敏感性的影响
申铁兵,郭立娜,李琼,夏凤君
内蒙古医科大学附属医院口腔科,呼和浩特 0100500
口腔鳞状细胞癌是中国目前发病率和病死率较高的头颈部恶性肿瘤之一,严重威胁着人类的健康和生命.由于大多数口腔鳞状细胞癌对放疗不敏感,以及由于颌骨对放射线的阻挡,使放疗效果不理想,因此,化疗是口腔鳞状细胞癌最主要的辅助治疗手段[1],但是长期化疗易导致肿瘤细胞产生耐药性,从而影响化疗效果[2].因此,如何提高肿瘤细胞对化疗药物的敏感性一直是肿瘤治疗领域关注的重点.近年来,自噬性程序性细胞死亡引起越来越多细胞生物学家的关注[3].有研究显示,内质网应激(endoplasmic reticulum stress,ERS)反应与细胞自噬密切相关[4].其中,葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)是内质网管腔中最主要的多功能分子伴侣蛋白,参与调控未折叠蛋白反应(unfolded protein response,UPR)信号通路[5].近年来,有研究表明,GRP78在一些肿瘤细胞中呈高表达,对于肿瘤细胞对化疗药物的敏感性具有重要的影响[6],但目前关于GRP78在口腔鳞状细胞癌组织中的表达情况及其与化疗药物敏感性的相关性研究尚未见明确报道.本研究通过检测GRP78在口腔鳞状细胞癌组织和细胞中的表达水平,探讨其对奥沙利铂(oxaliplatin,L-OHP)诱导口腔鳞状细胞癌细胞凋亡的影响,旨在为提高口腔鳞状细胞癌细胞的化疗敏感性提供潜在的干预靶点.现报道如下.
1 资料与方法
1.1 一般资料
收集2017年1月至2017年12月于内蒙古医科大学附属医院病理科存档的38例口腔鳞状细胞癌患者的口腔鳞状细胞癌组织标本作为观察组.38例患者中,男性21例,女性17例;年龄为26~78岁,平均年龄为(57.24±13.94)岁;高分化癌15例,中分化癌17例,低分化癌6例.另外,选择口腔颌面外科唇裂修复术中丢弃的正常口腔黏膜组织作为对照组,正常口腔黏膜组织标本取自5例男性和5例女性,年龄为31~68岁,平均年龄为(54.50±11.07)岁.两组标本来源者的性别和年龄比较,差异无统计学意义(P>0.05),具有可比性.
1.2 细胞、试剂与仪器
人口腔鳞状细胞癌细胞株Tca8113细胞购自American Type Culture Collection公司.L-OHP由齐鲁制药有限公司提供,引物以及siRNA干扰靶序列由上海生工生物工程有限公司合成并提供,SP免疫组化试剂盒和DAB显色试剂盒均购于北京中杉金桥生物技术有限公司,cDNA合成试剂盒、荧光定量PCR试剂盒和细胞凋亡试剂盒均购于美国OMEGA生物公司,DMEM高糖细胞培养基和Opti-MEM培养液均购于美国GIBCO公司,0.25%胰蛋白酶-EDTA细胞消化液购于北京钮因华信科技发展有限公司,胎牛血清和链霉素-青霉素双抗均购于美国ThermoFisher公司,Trizol和细胞转染试剂LipofectamineTM2000均购于美国Invitrogen公司,GRP78抗体、蛋白酪氨酸激酶2(Janus kinase 2,JAK2)抗体、磷酸化的蛋白酪氨酸激酶2(phosphorylated protein tyrosine kinase 2,p-JAK2)抗体、信号转导与转录因子3(signal transducer and activator of transcription 3,STAT3)抗体及磷酸化的信号转导与转录因子3(phosphorylated signal transduction and transcription factor 3,p-STAT3)抗体均购于美国Abcam公司,辣根酶标记的二抗购于美国Epitomics公司,DEPC购于美国Sigma公司,磷酸盐缓冲液、三氯甲烷、异丙醇、无水乙醇、二甲基亚砜(dimethylsulfoxide,DMSO)均购于国药集团化学试剂有限公司,生理盐水购于安徽双鹤药业有限责任公司.HERcell1501型CO2细胞培养箱购于美国Thermo Forma公司,Eppendorf 5427 R台式高速冷冻离心机购于德国Eppndorf公司,DL-CJ-2ND超净工作台购于北京东联哈尔仪器制造有限公司,实时定量PCR仪购于美国Bio-Rad公司,iMake多功能酶标仪购于日本Bio-Rad公司,CX41倒置光学显微镜和OLSCKX53倒置荧光显微镜均购于日本OLYMPUS公司,电子分析天平购于上海玉研科学仪器有限公司,Amersham电泳仪购于瑞典Bioscience公司,恒温水浴摇床和YCZ-40D型转移电泳槽均购于北京六一仪器厂,FluorChem FC3凝胶成像数码分析系统购于美国ProteinSimple公司.
1.3 实验方法
1.3.1免疫组织化学法 严格按照SP试剂盒说明书的步骤进行操作.随机选择10个视野,观察GRP78的阳性表达情况.GRP78阳性判断标准:以细胞质呈棕黄色染色判定为GRP78阳性表达.①阳性细胞染色强度评分标准:不着色0分,淡黄色1分,棕黄色2分,棕褐色3分;计算10个视野下的染色平均分值.②阳性细胞所占百分比评分标准:阳性细胞所占百分比为0,记0分;1%~25%,记1分;26%~50%,记2分;51%~75%,记3分;>75%,记4分.根据染色指数判定结果,染色指数=阳性细胞所占比例评分X细胞染色强度评分.根据染色指数将切片分为阴性(0~1分),弱阳性(2~5分),中阳性(6~10分),强阳性(>10分).弱阳性、中阳性和强阳性均为GRP78细胞阳性.
1.3.2 细胞培养 将Tca8113细胞培养于含10%胎牛血清的DMEM培养基中,将细胞置于37℃、5%CO2的细胞培养箱中进行培养.24~48 h更换培养液,48 h传代一次.
1.3.3 耐药细胞株的建立 经预实验结果显示,LOHP作用于Tca8113细胞半数抑制浓度(half inhibition concentration,IC50)为 19.44 μg/ml,取对数生长期细胞Tca8113,加入2 μg/m(l终浓度约为1/10 IC50)的L-OHP作用48 h后进行传代,重复上述步骤孵育72 h后,弃上清;然后重复同样的步骤,将L-OHP的终浓度提高一倍(L-OHP终浓度分别为2、3、4、5、6 μg/ml);直至Tca8113细胞可在5 μg/ml(终浓度约为1/4 IC50)L-OHP的作用环境下正常生存,然后以含加倍浓度(12~24 μg/ml)的大剂量LOHP对Tca8113细胞进行间断诱导,从而成功获得了生长良好的耐受24 μg/ml L-OHP的耐药细胞株,命名为Tca8113-L-OHP.弃培养上清,采用无菌PBS冲洗3次后,加入含10%胎牛血清的DMEM培养基中继续培养.
1.3.4 MTT法 采用噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)法检测细胞增殖能力.将Tca8113细胞或者Tca8113-L-OHP耐药株(1X104/孔)单层接种至96孔板中,置于37℃、5%CO2的细胞培养箱中进行培养,加入32 μg/ml的LOHP,检测Tca8113细胞和Tca8113-L-OHP细胞中JAK2/STAT3信号通路相关蛋白的表达.设置10个平行孔,24 h后,受试组细胞加入4、8、16、32、64 μg/m(l终浓度)L-OHP,而空白对照组细胞未作任何处理,继续培养48 h后,每孔加入20 μl MTT,置于37℃、5%CO2的细胞培养箱中孵育4 h后,弃上清液,每孔加入200 μl DMSO,置于振动器上振荡5 min,置于显微镜下观察无紫色结晶物.将96孔板放置于酶标仪上,检测波长为570 nm,参比波长为450 nm处的吸光度(absorbance,A)值,计算平均值.根据计算公式计算细胞增殖抑制率(inhibition rate,IR).IR(%)=(A空白对照组-A受试组)/A空白对照组X 100%.
1.3.5 细胞转染 提前1天在相应备行转染的6孔板上接种5X105个Tca8113-L-OHP细胞,分为2个实验组:GRP78 siRNA转染组和阴性对照组.培养24 h后,当融合度达到50%~60%时,按照脂质体转染说明书进行转染操作,在EP管中分别加入5 μl预先配置的GRP78 siRNA以及250 μl的无血清Opti-MEM培养基,混匀,室温放置10 min;另外在5 μl LipofectamineTM2000 脂质体溶液中加入 250 μl无血清Opti-MEM培养液,振荡混匀后,室温放置10 min;将上述两种溶液吹打混匀,室温放置30 min;将脂质体-质粒DNA复合液滴加至孔板细胞表面,置于37℃、5%CO2的细胞培养箱中培养24~48 h.阴性对照组的转染方法与上述GRP78 siRNA的转染方法一致,而转染无关序列不同.未转染的Tca8113-L-OHP细胞仅进行常规培养.提取Tca8113-L-OHP细胞RNA,验证目的基因的相对表达量.
1.3.6 提取总RNA ①收集1X1010个细胞,置于EP管中;②加入1 ml预冷的Trizol,充分混合均匀,静置5~10 min;③加入200 μl三氯甲烷,振荡30 s,静置5~10 min;④12000 r/min离心5 min,离心半径为8 cm,取上清;⑤加入 500 μl异丙醇,振荡 30 s,静置5~10 min;⑥12000 r/min离心5 min,离心半径为8 cm,弃上清;⑦加入1 ml的75%乙醇,振荡30 s,12000 r/min离心5 min,离心半径为8 cm,弃上清;⑧将EP管倒置于滤纸上,将RNA充分干燥;⑨加入20 μl的DEPC水溶解沉淀,分装,置于-80℃保存备用.采用琼脂凝胶电泳检测RNA相对分子量;采用分光光度计检测RNA浓度.
1.3.7 RNA反转录 严格按照试剂盒说明书的步骤进行操作.将cDNA置于-20℃的温度下保存备用.
1.3.8 实时荧光定量聚合酶链反应(real-time polymerase chainreaction ,RT-PCR)将20 μl的反应体系置于37℃恒温中水浴60 min,85℃5 s,加入去离子水至 100 μl,各反应孔取 2 μl进行 PCR.冰浴中配制20 μl PCR反应体系,95℃30 s预变性,95℃5 s,60℃30 s,共进行45个循环.根据美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库获得的资料设计引物序列,引物由上海生工生物工程有限公司合成并提供.根据使用说明调整基线,将阈值设定在荧光值对数图的线性部分,从软件中读取Ct值.ΔCt=样品 Ct均值-内参 Ct均值,ΔΔCt=ΔCt-(随机阴性对照样品Ct均值-内参Ct均值),以2-ΔΔCt表示目的基因mRNA的相对表达量.
1.3.9 蛋白质印迹法(Western blot)①提取蛋白样品;②蛋白样品凝胶电泳;③转膜;④封闭;⑤加入JAK2、p-JAK2、STAT3、p-STAT3一抗孵育;⑥加入二抗孵育;⑦显影;⑧采用化学发光法检测膜上的蛋白表达条带,采用FluorChem FC3凝胶成像数码分析系统进行定量分析,以积分光密度表示灰度值.
1.4 统计学方法
采用SPSS 19.0软件对-数据进行统计分析.计量资料以均数±标准差()表示,组间比较采用t检验;多组间比较采用单因素方差分析,多组间两两比较采用q检验.计数资料采用例数或率(%)表示,组间比较采用χ2检验或Fisher确切概率法.以P<0.05为差异有统计学意义.
2 结果
2.1 不同组织中GRP78的表达
口腔鳞状细胞癌组织中GRP78的阳性表达率为84.2%,高于正常口腔黏膜组织的20.0%,差异有统计学意义(P<0.05).高、中、低分化口腔鳞状细胞癌组织中GRP78的阳性表达率比较,差异无统计学意义(P>0.05);高、中、低分化口腔鳞状细胞癌组织中GRP78的阳性表达率均高于正常口腔黏膜组织(P<0.05).(表1、图1)

表1 不同组织中GRP78蛋白的表达情况
2.2 Tca8113细胞和Tca8113-L-OHP细胞对LOHP的化疗敏感性及GRP78的表达
经RT-PCR检测结果显示,Tca8113细胞中GRP78 mRNA的相对表达量为(0.29±0.04),明显低于Tca8113-L-OHP细胞的(0.83±0.08),差异有统计学意义(t=19.092,P<0.01).经MTT法检测,经不同浓度的L-OHP(4、8、16、32、64 μg/ml)处理后,Tca8113细胞的增殖能力明显受到抑制,且随着LOHP的浓度升高,对细胞增殖活性的抑制越明显,Tca8113细胞的增殖抑制率明显高于Tca8113-LOHP细胞,差异均有统计学意义(P<0.01)(表2).
表2 L-OHP对Tca8113和Tca8113-L-OHP细胞增殖活性的影响(%,±s)
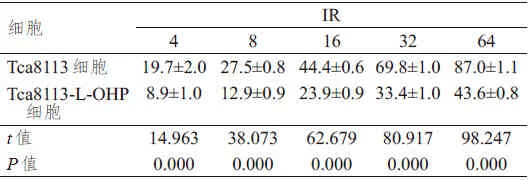
表2 L-OHP对Tca8113和Tca8113-L-OHP细胞增殖活性的影响(%,±s)
缩略语:IR=细胞增殖抑制率
细胞Tca8113细胞Tca8113-L-OHP细胞t值P值IR 4 19.7±2.0 8.9±1.0 14.963 0.000 8 27.5±0.8 12.9±0.9 38.073 0.000 16 44.4±0.6 23.9±0.9 62.679 0.000 32 69.8±1.0 33.4±1.0 80.917 0.000 64 87.0±1.1 43.6±0.8 98.247 0.000
2.3 下调GRP78对Tca8113-L-OHP细胞对LOHP敏感性的影响
经不同浓度的L-OHP作用后,GRP78 siRNA组Tca8113-L-OHP细胞的增殖活性明显低于阴性对照组,差异均有统计学意义(P<0.01).(表3)
表3 转染GRP78 siRNA对Tca8113-L-OHP细胞增殖活性的影响(%,±s)
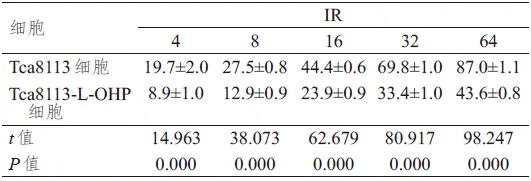
表3 转染GRP78 siRNA对Tca8113-L-OHP细胞增殖活性的影响(%,±s)
缩略语:IR=细胞增殖抑制率
Tca8113-L-OHP细胞阴性对照组GRP78 siRNA组t值P值IR 4 9.1±0.9 21.4±1.2 25.41 0.000 8 13.2±1.0 32.5±1.0 42.54 0.000 16 23.0±0.8 50.3±0.9 75.27 0.000 32 32.2±1.2 75.4±0.8 99.13 0.000 64 44.9±1.3 91.4±1.1 88.39 0.000
2.4 Tca8113细胞和Tca8113-L-OHP细胞中JAK 2/STAT 3信号通路相关蛋白的表达
加入L-OHP后,Tca8113细胞中p-JAK2和p-STAT3 mRNA、p-JAK2和p-STAT3蛋白的相对表达量均低于Tca8113-L-OHP细胞,差异有统计学意义(P<0.05).经32 μg/ml的L-OHP作用后,与未加入L-OHP作用的Tca8113细胞相比,加入L-OHP Tca8113细胞中p-JAK2、p-STAT3 mRNA和p-JAK2、p-STAT3蛋白的相对表达量有所下调,差异均有统计学意义(P<0.05);但是加入L-OHP后,Tca8113细胞中JAK2、STAT3 mRNA和JAK2、STAT3蛋白相对表达量,以及Tca8113-L-OHP细胞中JAK、p-JAK、STAT3、p-STAT3的相对表达量与加入L-OHP前比较,差异均无统计学意义(P>0.05).(表4、表5)
表4 Tca8113细胞中JAK、p-JAK、STAT 3、p-STAT 3的表达(±s)

表4 Tca8113细胞中JAK、p-JAK、STAT 3、p-STAT 3的表达(±s)
加入L-OHP无有t值P值JAK2 mRNA 1.20±0.13 1.18±0.13 0.344 0.735蛋白0.92±0.12 0.95±0.15 0.494 0.627 p-JAK2 mRNA 0.38±0.07 0.20±0.08 5.355 0.000蛋白0.64±0.15 0.41±0.12 3.786 0.001 STAT3 mRNA 0.91±0.12 0.89±0.13 0.358 0.725蛋白0.64±0.08 0.67±0.10 0.741 0.468 p-STAT3 mRNA 0.45±0.10 0.18±0.04 7.927 0.000蛋白0.58±0.07 0.28±0.05 11.028 0.000
表5 Tca8113-L-OHP细胞中JAK、p-JAK、STAT 3、p-STAT 3的表达(±s)

表5 Tca8113-L-OHP细胞中JAK、p-JAK、STAT 3、p-STAT 3的表达(±s)
加入L-OHP无有t值P值1.16±0.18 1.14±0.20 0.235 0.817 0.94±0.14 0.98±0.12 0.686 0.502 0.71±0.11 0.65±0.12 1.166 0.259 1.05±0.17 1.02±0.14 0.431 0.672 0.92±0.10 0.94±0.13 0.386 0.704 0.66±0.09 0.69±0.10 0.705 0.490 0.62±0.06 0.61±0.05 0.405 0.690 0.45±0.07 0.44±0.05 0.368 0.718 JAK2 mRNA 蛋白p-JAK2 mRNA 蛋白STAT3 mRNA 蛋白p-STAT3 mRNA 蛋白
2.5 GRP78对JAK 2/STAT 3信号通路相关蛋白表达的影响
经RT-PCR和Western blot检测,转染GRP78 siRNA后,Tca8113-L-OHP细胞p-JAK2、p-STAT3 mRNA和p-JAK2、p-STAT3蛋白的相对表达量均明显低于阴性对照组,差异均有统计学意义(P<0.01).(表6)
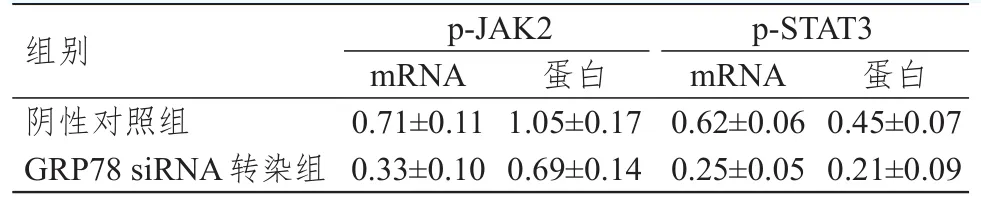
表6 Tca8113-L-OHP细胞中p-JAK、p-STAT 3的表达
3 讨论
目前,临床上关于头颈部恶性肿瘤的治疗方法仍以外科手术切除为主,配合化疗和放疗辅助治疗.如何提高肿瘤细胞对化疗药物的敏感性,尽量提高治疗效果,减少不良反应的发生,是目前肿瘤治疗领域一直关注的重点[7].由于肿瘤微环境发生较大变化,如缺氧、低糖、酸中毒、炎性反应等,从而导致ERS反应的发生[8].因此,一方面激活内质网上相应蛋白感受器STAT3、JAK2等将信号传递至细胞核,启动UPR维持细胞内环境稳态;另一方面诱导内质网应激传感器GRP78高表达,以提高内质网内对蛋白的折叠和加工能力[9].GRP78是热休克蛋白家族成员之一,具有高度保守的结构域,主要参与调控UPR信号通路[10].有研究显示,很多肿瘤细胞的GRP78呈高表达,并与细胞耐药性密切相关[11].宋佳等[12]发现特异性下调GRP78的表达可增加肝癌细胞对厄洛替尼的敏感性.目前,已有研究证实GRP78在非小细胞肺癌、肝癌、乳腺癌等肿瘤细胞中的相对表达量上调[13],但是关于GRP78在口腔鳞状细胞癌细胞中的表达及其与化疗药物耐药性的相关性尚属于空白领域,因此,本研究着重探讨了GRP78与口腔鳞状细胞癌对L-OHP耐药性的关系以及对JAK/STAT信号通路的影响.
L-OHP属于第三代铂类药物,其在口腔鳞状细胞癌治疗方面的临床疗效已经得到临床的普遍认可[14],但是基于笔者多年的临床经验发现,很多患者在接受L-OHP治疗一段时间后产生明显的耐药性,从而导致患者预后较差.因此,本研究对LOHP耐药性与GRP78的关系展开一系列研究.本研究中,首先证实了口腔鳞状细胞癌组织中GRP78的阳性表达率高于正常口腔黏膜组织(P<0.05),提示口腔鳞状细胞癌细胞的ERS表达升高,为了抵抗恶劣的肿瘤微环境的影响,GRP78的反馈性表达上调,避免细胞发生程序性死亡或凋亡.随后本研究通过药物浓度递增间歇诱导法建立L-OPH耐药细胞株,经RT-PCR法检测结果发现,Tca8113细胞中GRP78 mRNA的相对表达量明显低于Tca8113-L-OHP细胞(P<0.01);而且通过MTT法检测结果也证实,L-OHP对Tca8113-L-OHP细胞增殖活性的抑制作用降低,提示Tca8113细胞对L-OHP的耐药性产生可能与GRP78表达量上调有关.因此,进一步通过siRNA技术下调Tca8113-L-OHP细胞中GRP78基因的表达,经不同浓度的L-OHP作用后,对Tca8113-L-OHP细胞增殖活性的抑制作用较阴性对照组细胞明显升高,因此,下调GRP78后,L-OHP诱导口腔鳞状细胞癌细胞的凋亡率明显上升,由此证明GRP78在口腔鳞状细胞癌中具有保护作用,可作为提高化疗敏感性的潜在干预靶点.
JAK/STAT信号转导通路是肿瘤细胞增殖和转移的重要调控途径,大多数恶性肿瘤的发生、发展均与JAK、STAT的磷酸化有关,包括口腔鳞状细胞癌.既往有研究证实,GRP78可通过激活STAT3促进胃癌细胞的增殖和迁移[15].本研究探讨了LOHP对Tca8113和Tca8113耐药细胞株中p-JAK2、p-STAT3 mRNA和p-JAK2、p-STAT3蛋白相对表达量的影响,结果显示L-OHP可以明显抑制Tca8113细胞中p-JAK2和p-STAT3的表达,但是对Tca8113-L-OHP细胞的相对表达量未见明显影响,提示JAK/STAT信号通路可能参与了L-OHP耐药性的发生.因此本研究又进一步探讨了GRP78对JAK/STAT信号通路的影响,结果显示,转染GRP78 siRNA后,Tca8113-L-OHP细胞中p-JAK2和p-STAT3的磷酸化水平明显下调,提示GRP78可通过调控p-JAK2和p-STAT3的磷酸化水平而影响细胞对LOHP的敏感性.
综上所述,GRP78在口腔鳞状细胞癌组织中的相对表达量明显高于正常口腔黏膜组织,并且在L-OHP耐药细胞株中的表达上调,可能与L-OHP的耐药性有关;下调GRP78的表达可降低JAK2和STAT3的磷酸化水平,从而提高口腔鳞状细胞癌细胞对L-OHP的敏感性,提示GRP78可能是提高口腔鳞状细胞癌细胞对化疗药物敏感性的潜在靶点.但是本研究尚处于实验阶段,距离药物研发以及临床应用还需要很长一段时间,关于在药物作用下GRP78的表达变化以及确切的作用机制有待进一步研究.

