PI 3K/AKT/MTOR信号通路关键信号分子在胃癌组织中的表达及与临床特征的关系
刘东刚,白春华,张旭东
长春市中心医院肿瘤内科,长春1301210
胃癌是常见的消化道恶性肿瘤,病死率居高不下,手术、化疗及放疗等治疗并未一直取得实质进展是其重要原因,因此胃癌的病因学研究在近年来成为焦点.相关研究表明,肿瘤的发生、发展与信号转导通路的活动异常有关.磷脂肌醇3-激酶(phosphoinositide-3 kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)/雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)信号通路通过激活下游分子,对细胞的存活、生长及增殖起着中心调控作用,其中,PI3K为信号通路的重要组成分,而AKT及MTOR均为下游关键信号分子[1].文献报道显示,PI3K、AKT及MTOR表达异常与胃癌的发生、发展与预后密切相关[2-3].但以往研究较多集中于对单一信号分子在胃癌组织中表达情况的检测,而PI3K、AKT及MTOR等几种关键信号分子的活化形式、在表达上的相关性以及与临床特征之间的关系,一直未予明确,尚需更多的临床研究予以证实.本研究通过采用免疫组化法及Western blot法对该通路上的下游关键信号分子AKT及MTOR在胃癌组织、癌旁组织及正常胃黏膜组织中的表达情况进行联合检测,并进一步通过定量分析,探讨二者在表达上的相关性以及与胃癌临床特征的关系,为胃癌的防治提供新的思路.
1 资料与方法
1.1 一般资料
选取2014年2月至2017年2月于长春市中心医院首次行胃癌根治术的胃癌患者的组织标本.所有患者术后均经病理组织学检查,由两位病理医师分别独立诊断为胃腺癌,且均为首次手术根治治疗,术前未经过任何放化疗冶疗的患者;根据世界卫生组织(WHO)2010年标准[4],胃癌组织学分类明确,且按美国癌症联合委员会(American Joint Committee on Cancer,AJCC)2010年第7版标准[5],均存在明确TNM分期及组织学分级的患者.共纳入120例患者,男66例,女54例;年龄41~83岁,平均(52.54±5.48)岁.搜集胃癌组织标本120例,另选取距肿瘤边缘1 cm处的癌旁组织标本120例及距肿瘤边缘>5 cm处的正常胃黏膜组织标本120例.将患者的石蜡标本置于-80℃液氮中保存.
1.2 材料及主要试剂
材料及主要试剂包括兔抗人多克隆抗体及单克隆抗体(购自美国Cell Signaling Technology公司)、DNA裂解液(购自武汉碧云天公司)、免疫组化SP试剂盒(购自上海研卉生物公司)、DAB显色剂(购自武汉博士德公司)以及磷酸盐缓冲液(phosphate buffer saline,PBS)(购自南京金益柏公司)等.
1.3 免疫组化法检测阳性细胞
使用SP法,按SP试剂盒说明书所示步骤操作.脱蜡至水,3%H2O2,低火加热1 min,修复抗原,将一抗加入,使用PBS冲洗,再加入二抗,最后加入DAB显色剂染色.染色时,以PBS代替一抗.胃癌组织中的p-AKT及p-MTOR阳性表达均定位于细胞质.由两位有经验的病理医师对所有标本进行独立双盲阅片.采用4级记分评价方法[6]判断染色结果:以细胞核或细胞质呈不规则棕黄色网状、细颗粒状或棕褐色团块状为阳性表达.按染色强度及阳性细胞比例分别记分,染色强度:无染色为0分,浅黄色为1分,棕黄色为2分,棕色为3分;根据染色细胞占细胞总数百分比:0~5%为0分,6~25%为1分,26~49%为2分,50~100%为3分.两项相加≤1分为阴性,≥2分为阳性.
1.4 Western blot法检测蛋白表达
从液氮罐中取出保存的新鲜胃癌组织、癌旁组织及正常胃黏膜组织,加入DNA裂解液,提取总蛋白,并使用BCA法测定总蛋白浓度.将蛋白上样于6孔板,每孔20 μg,聚丙烯胺凝胶电泳,转膜至硝酸纤维素膜(nitrocellulose,NC)上,再使用封闭液(含5%脱脂奶粉)予以封闭,加入稀释的一抗工作液,于杂交袋中过夜,使用PBS洗膜3次,每次15 min;滴加二抗,置于室温(20℃)下孵育2 h,拍摄照片,以空白为对照,在酶标仪上590 nm处比色,以牛血清白蛋白含量为横坐标,以吸光值为纵坐标,绘制标准曲线.以标准曲线空白为对照,根据样品的吸光值从标准曲线上查出样品的蛋白质相对含量.
1.5 统计学方法
采用SPSS 19.0统计软件进行数据分析.计数资料以例数及率(%)表示,-组间比较采用χ2检验,计量资料以均数±标准差()表示,组间比较采用两独立样本t检验.以P<0.05为差异有统计学意义.
2 结果
2.1 p-AKT、p-MTOR阳性表达率的比较
采用免疫组化法检测PI3K/AKT/MTOR信号通路的关键信号分子p-AKT、p-MTOR分别在胃癌组织、癌旁组织及正常胃黏膜组织3组标本中的表达情况.在胃癌组织及正常胃黏膜组织中,p-AKT、p-MTOR均定位于细胞质(图1、图2).胃癌组织中p-AKT阳性表达率为71.67%,分别高于癌旁组织(30.00%)及正常胃黏膜组织(24.17%),差异均有统计学意义(P<0.05);癌旁组织及正常胃黏膜组织中p-AKT阳性表达率比较,差异无统计学意义(P>0.05).胃癌组织、癌旁组织中p-MTOR阳性表达率分别为76.67%和64.00%,均高于正常胃黏膜组织(19.17%),差异均有统计学意义(P<0.05);胃癌组织、癌旁组织中p-MTOR阳性表达率比较,差异无统计学意义(P>0.05).(表1)
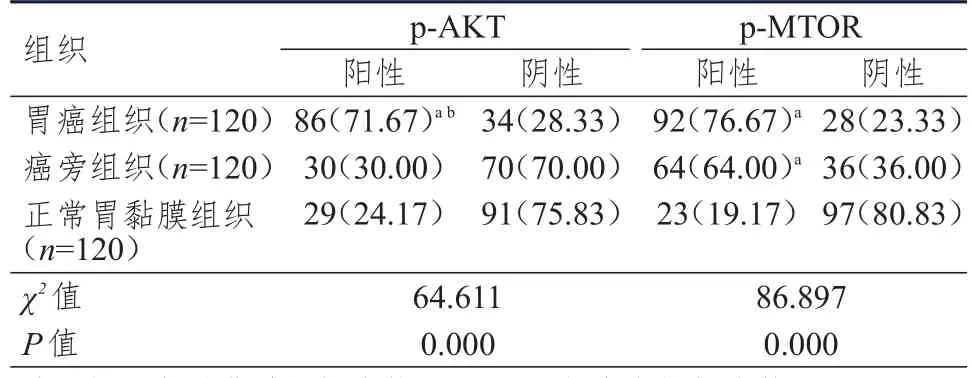
表1 p-AKT、p-MTOR在胃癌组织、癌旁组织及正常胃黏膜组织中表达情况的比较[n(%)]
2.2 p-AKT、p-MTOR蛋白相对表达量的比较
从120例患者中,采用Western blot法检测p-AKT、p-MTOR分别在胃癌组织及正常胃黏膜组织中的表达情况.p-AKT、p-MTOR在胃癌组织中的蛋白相对表达量均明显高于正常胃黏膜组织,差异均有统计学意义(P<0.01).(图3、表2)
2.3 p-AKT、p-MTOR表达情况与临床特征的关系
采用免疫组化法检测p-AKT、p-MTOR在120例胃癌组织中的阳性表达情况,结果显示,p-AKT在低分化、TNM分期为Ⅲ+Ⅳ期的胃癌组织中阳性表达率均高于高中分化、TNM分期为Ⅰ+Ⅱ期的胃癌组织,差异均有统计学意义(χ2=6.511、18.622,P<0.05);p-MTOR在低分化、TNM分期为Ⅲ+Ⅳ期的胃癌组织中阳性表达率均明显高于高中分化、TNM分期为Ⅰ+Ⅱ期的胃癌组织,差异均有统计学意义(χ2=20.211、7.919,P<0.01);而不同年龄、肿瘤直径、浸润深度、淋巴结转移情况胃癌患者的胃癌组织中p-AKT、p-MTOR阳性表达率比较,差异均无统计学意义(P>0.05).(表3)
表2 p-AKT、p-MTOR在胃癌及正常胃黏膜组织中相对表达量的比较(±s)
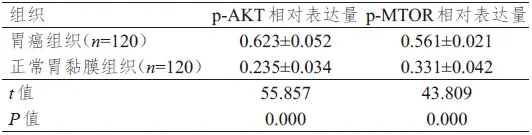
表2 p-AKT、p-MTOR在胃癌及正常胃黏膜组织中相对表达量的比较(±s)
组织胃癌组织(n=120)正常胃黏膜组织(n=120)t值P值p-AKT相对表达量0.623±0.052 0.235±0.034 55.857 0.000 p-MTOR相对表达量0.561±0.021 0.331±0.042 43.809 0.000
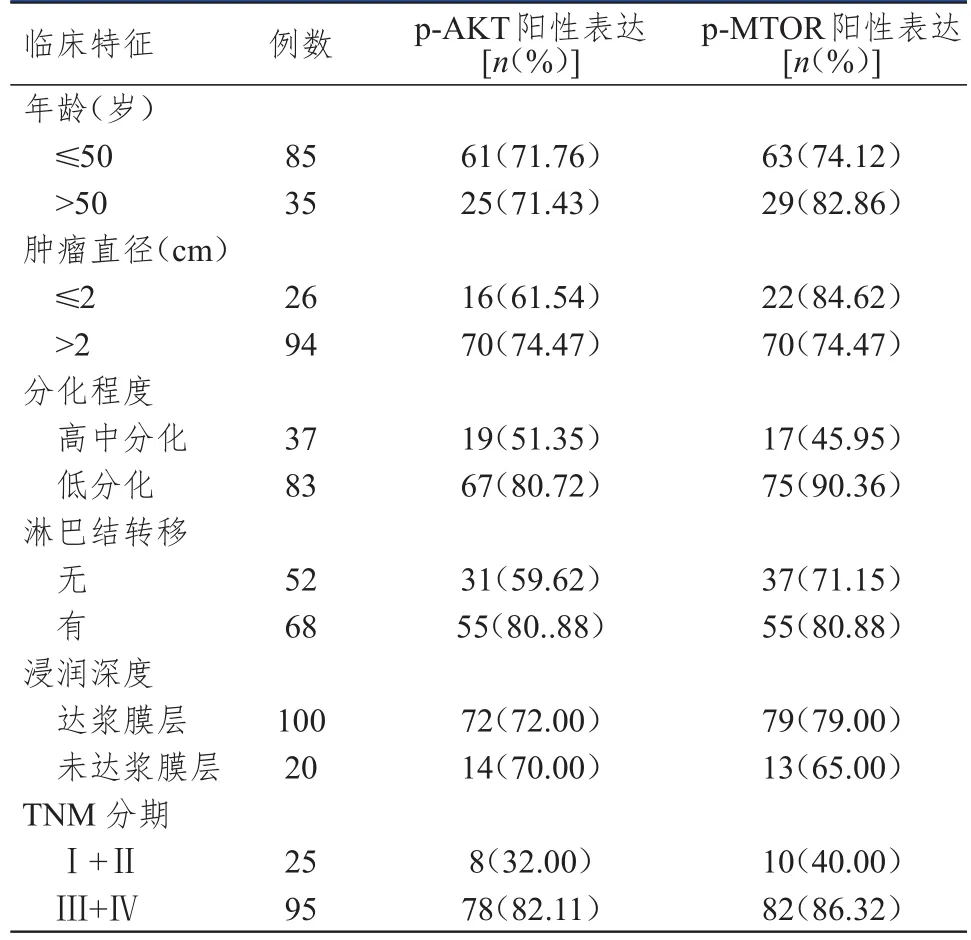
表3 不同临床特征的胃癌患者的胃癌组织中p-AKT、p-MTOR的表达情况(n=120)
采用Western blot法检测p-AKT、p-MTOR在120例胃癌患者中的蛋白相对表达情况,结果显示,p-AKT在低分化、TNM分期为Ⅲ+Ⅳ期的胃癌组织中的蛋白相对表达量均明显高于高中分化、TNM分期为Ⅰ+Ⅱ期的胃癌组织,差异均有统计学意义(t=30.105、4.786,P<0.01);p-MTOR在低分化、TNM分期为Ⅲ+Ⅳ期的胃癌组织中的蛋白相对表达量均明显高于高中分化、TNM分期为Ⅰ+Ⅱ期的胃癌组织,差异均有统计学意义(t=9.038、14.222,P<0.01);而不同年龄、肿瘤直径、浸润深度、淋巴结转移情况胃癌患者的胃癌组织中p-AKT、p-MTOR蛋白相对表达量比较,差异均无统计学意义(P>0.05).(表4)
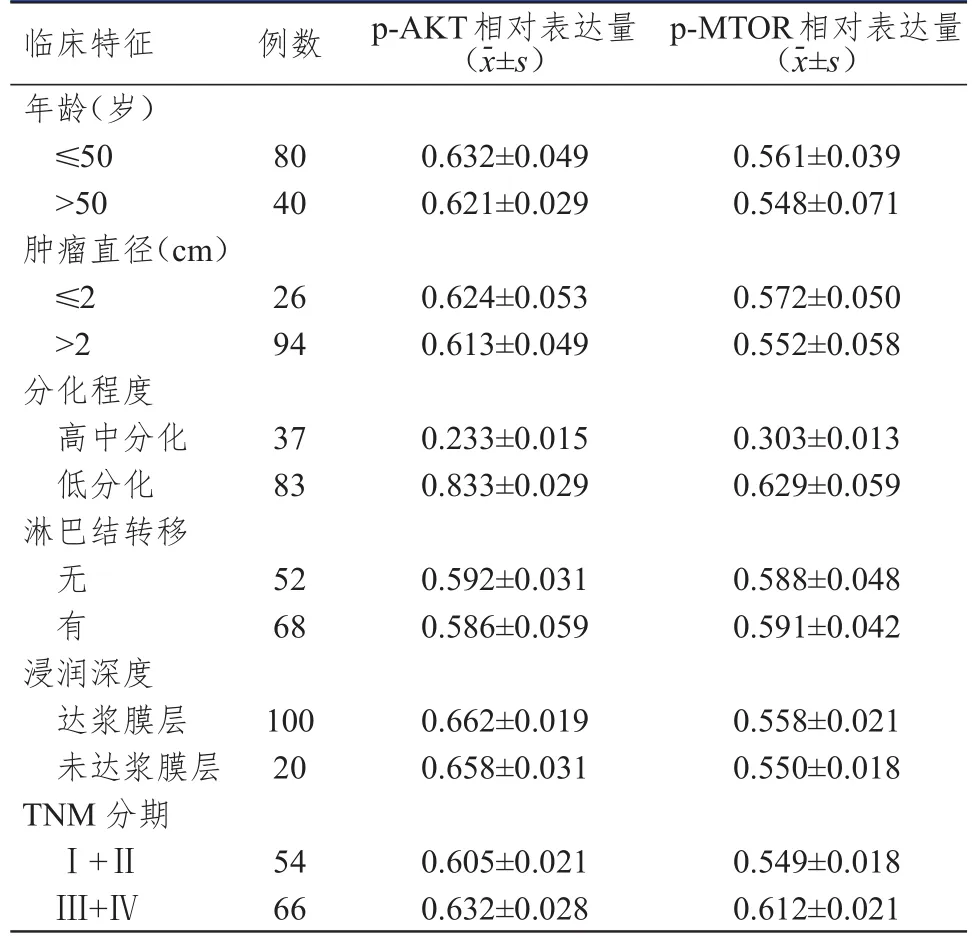
表4 不同临床特征的胃癌患者的胃癌组织中p-AKT、p-MTOR蛋白相对表达量(n=120)
3 讨论
PI3K/AKT/MTOR信号通路的上游关键信号分子PI3K在受到多种生长因子、细胞因子刺激时,可被异常活化,进而激活其下游底物AKT,引起AKT磷酸化,继而进一步激活其下游底物MTOR[7].研究发现,检测疾病进展的分子标志物,从正常细胞到不典型增生再到细胞恶化,p-AKT、p-MTOR的激活水平均逐渐增加,而且伴随凋亡分子标志物的丢失[8].PI3K/AKT/MTOR信号通路在异常活动时存在级联放大效应,引起PI3K/AKT/MTOR信号通路的关键信号分子异常过度活化与异常活动,在加速细胞周期、抗细胞凋亡、促进血管生成以及提高肿瘤生存能力等方面,发挥着中心调控作用[9-10],在多种肿瘤的发生、发展中具有重要作用.胃癌的病因较为复杂,越来越多的研究表明,胃癌的发生、发展与PI3K/AKT/MTOR信号通路的异常活动密切相关[11-12].AKT的磷酸化目前主要见于胃癌,在AKT被异常激活后,活化其下游分子底物MTOR,而MTOR通路在促进细胞蛋白合成及有丝分裂、加速细胞周期进程方面具有重要作用,在MTOR通路异常活动时,可导致细胞周期G1期调节紊乱,胃癌细胞也具有G1期调节紊乱的显著特点[13].而PI3K/AKT/MTOR信号通路的级联放大效应,可能在促进胃癌恶性进展中发挥着重要作用.
本研究中,对120例胃癌组织、120例癌旁组织及120例正常胃黏膜组织,采用免疫组化法检测p-AKT、p-MTOR的表达情况,研究结果显示,p-AKT、p-MTOR在胃癌组织中的阳性表达率分别高于正常胃黏膜组织,证实了p-AKT、p-MTOR在胃癌组织中存在过表达,与国内外同类研究结果[14-15]类似.将患者分别按年龄、肿瘤直径、分化程度、有无淋巴结转移、浸润深度及TNM分期分组,对免疫组化检测的结果,进一步分析阳性表达与临床特征的关系,结果显示,p-AKT、p-MTOR在胃癌组织中的表达与胃癌分化程度、TNM分期有关.p-AKT、p-MTOR在低分化、TNM分期为Ⅲ+Ⅳ期的胃癌组织中阳性表达率及蛋白相对表达量均高于高中分化、TNM分期为Ⅰ+Ⅱ期的胃癌组织,差异均有统计学意义(P<0.05);而不同年龄、肿瘤直径、浸润深度、淋巴结转移情况胃癌患者的胃癌组织中p-AKT、p-MTOR阳性表达率及蛋白相对表达量比较,差异均无统计学意义(P>0.05).研究结果表明,p-AKT、p-MTOR表达与胃癌的恶性进展有关.
肿瘤细胞的分化程度与细胞生理活动紊乱的严重程度有关,低分化肿瘤较高中分化肿瘤在细胞的生理活动上,拥有更严重的紊乱程度,因此,低分化肿瘤也拥有更为严重的恶性发展.本研究发现,在低分化的肿瘤组织中,p-AKT、p-MTOR存在更高表达,异常活化更为活跃.推测原因,早期AKT被异常过度激活,导致AKT蛋白过度扩增,AKT通过增加细胞周期素转录以及磷酸化蛋白激酶抑制途径,激活下游底物,促使细胞周期加速,促进肿瘤的恶性发展.而MTOR通过控制其下游与转录、翻译有关的多种蛋白的磷酸化,在细胞的存活、生长及增殖中,起着中心调控作用.AKT激活后,位于其下游的MTOR被活化,受MTOR调控的多种生长因子、细胞因子,通过PI3K/AKT信号转导链而作用于细胞分裂、转录和翻译等细胞增殖的多个重要环节,两者的级联放大作用,共同促进了肿瘤的恶性发展.p-AKT、p-MTOR的高度活跃,加速了细胞周期,促使受之调控的多种下游信号通路紊乱,产生了集中爆发效应,加重了细胞生理功能紊乱的严重程度,导致肿瘤细胞分化程度降低,促使细胞恶性程度增加.TNM分期及组织学分级是衡量患者恶性程度的重要标准,本研究还发现,p-AKT、p-MTOR在高临床分期患者中,表达也随之增高,提示p-AKT、p-MTOR在TNM分期较高的患者胃癌组织中,表达更为活跃.这一结果在其癌旁组织、正常胃黏膜组织中,也得到了体现.而其原因可能是随着临床分期的升高,伴随着细胞肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)等致癌因子及多种炎性介质的释放,反过来刺激PI3K/AKT/MTOR信号通路异常活动加剧,p-AKT、p-MTOR过度活化更为活跃,肿瘤在突破浆膜层后,淋巴结受累、向邻近组织浸润侵犯以及向远处转移能力均显著增强,表明肿瘤是在向恶性更高的方向发展.
本研究还发现,p-AKT、p-MTOR在胃癌组织中的阳性表达,与肿瘤直径、肿瘤浸润深度、淋巴结转移等无关,与以往报道的结果有所不同.晏淼等[16]报道,p-AKT、p-MTOR在胃癌组织中的表达水平,与胃癌分化程度、淋巴结转移、浸润深度以及TNM分期均有关.本研究以肿瘤直径、浸润深度、淋巴结转移等临床特征单独分组观察,p-AKT、p-MTOR在胃癌组织中的表达比较,差异均无统计学意义(P>0.05),结果表明,p-AKT、p-MTOR表达与上述临床特征无关.提示单一临床特征变化,并不能证实就是由p-AKT、p-MTOR异常过度活化所引起.癌症的发生、发展有着较为复杂的原因,PI3K/AKT/MTOR信号通路关键信号分子的异常活化,可能是胃癌发生及其临床特征的重要原因之一,但并非是其唯一原因.但在TNM分期较高的患者中,观察到p-AKT、p-MTOR在胃癌组织、癌旁组织及正常胃黏膜组织中均存在.
本研究结果表明,p-AKT、p-MTOR在胃癌组织中高表达,证实了胃癌的发生可能与PI3K/AKT/MTOR信号通路的关键信号分子过度活化后产生的级联放大效应有关,是AKT、MTOR等多种关键信号分子共同促进的结果,联合检测p-AKT与p-MTOR的活性物在胃癌组织中的表达情况,对于胃癌的诊断、治疗及预后具有重要价值.而关键信号分子异常活化的原因,可能与调节PI3K/AKT/MTOR信号通路活性的负反馈机制即对该通路的正常抑制能力降低有关,导致该通路的活性被过度放大,活性高度释放,促使p-AKT、p-MTOR表达异常增多,在胃癌组织中异常高度活跃,产生了一系列级联放大效应,在多种因素共同作用下,促进了胃癌的恶性发展.宋仕茂等[17]采用雷帕素霉抑制剂干预后,发现可明显抑制胃癌细胞的生长和迁移,也证实了胃癌的进展与PI3K/AKT/MTOR信号通路的异常活动有关.本研究也证实,PI3K/AKT/MTOR信号通路有望成为新的生物治疗靶点.但该通路的异常活动,从侧面证实了其活性的负反馈调节机制也存在着异常.因此,该生物治疗靶点的实际临床价值,仍尚需进一步的临床实验予以证实.综上所述,AKT、MTOR在胃癌组织中存在着过表达,与胃癌进展有密切关系.AKT、MTOR过度活化,可能与PI3K/AKT/MTOR信号通路的活性正常抑制能力降低有关.AKT、MTOR不仅有望成为诊断胃癌恶性程度新的分子标志物,而且在胃癌治疗长期难以取得进展,当前手术、化疗及放疗等均难以取得满意效果,针对PI3K/AKT/MTOR信号通路开辟生物治疗途径中,无疑具有极为重要的临床应用价值.

