多模态磁共振成像技术对胃癌术前T分期与术后病理诊断的对比研究
王智清 陶芳旭 张其林 彭 容*
胃癌作为临床常见恶性上消化道肿瘤,流行病学调查发现其发病率与病死率均较高,在恶性肿瘤相关死亡中位于第二位,且预后较差,5年生存率为20%~30%。目前,手术切除是根治胃癌的关键手段,但仅有小部分患者在确诊时能够手术切除[1]。
肿瘤-淋巴结-远处转移(tumor node metastasis,TNM)分期作为一个公认的分期系统,能准确预测患者预后;而基于TNM分期的胃癌早期诊断及准确分期,有利于临床医生及时制定准确的治疗方案,改善患者预后[2]。既往研究中,胃癌诊断及术前分期多应用CT与内镜超声,但前者存在电离辐射,后者属于侵入性方法,诊断结果准确性与操作者有着密切的关联[3]。
近年来,伴随着影像技术与硬件设备的快速发展,磁共振成像(magnetic resonance imaging,MRI)技术对软组织的显示较既往检测方法更为清晰,具有较高的软组织对比度及多序列、多方位成像特征,无创性及电离辐射,空间和时间分辨率较高,运动伪影较少,已成为国内外研究热点[4]。基于此,本研究旨在深入探究多模态MRI技术在胃癌术前T分期中的诊断价值。
1 资料与方法
1.1 一般资料
采用便利抽样法选取2015年2月至2018年2月攀枝花市中心医院收治的64例胃癌患者,并对其进行回顾性分析。所有患者均经手术病理证实,其中男性43例,女性21例;年龄35~65岁,平均年龄(56.29±7.12)岁;肿瘤部位于胃窦15例,胃体22例,贲门26例,全胃1例;肿瘤直径≥5 cm为44例,<5 cm为20例;术后病理组织学分型中高分化腺癌33例,中低分化腺癌24例,未分化癌4例,黏液腺癌1例,印戎细胞癌2例。本研究获医院医学伦理委员会批准。
1.2 纳入与排除标准
(1)纳入标准:①符合“食管癌和胃癌治疗指南”[5]中相关诊断标准,均经胃镜检查及组织病理学确诊为进展期胃癌,拟行胃癌根治性切除或姑息性手术;②年龄≥35岁;③入选前1周内未接受过放化疗及刺激性检查(如纤维胃镜、内镜超声);④对本研究知情且签署同意书。
(2)排除标准:①存在磁共振(magnetic resonance,MR)检查禁忌症,如有心脏起搏器、冠脉支架及除颤器等;②合并严重心脏、脑、肺、肾脏及血液系统等原发性疾病;③伴严重感染、重度贫血及血小板计数、白细胞计数低者;④其他恶性肿瘤病史;⑤钆对比剂过敏者;⑥妊娠期或哺乳期妇女。
1.3 仪器与试剂
采用Signa Excite 3.0T型MR超导型扫描仪(美国GE公司);Spectris Solsris高压注射器(美国Medrad公司)。对比剂钆贝葡胺注射液(上海博莱科信谊药业公司)。
1.4 检测方法
(1)使用Signa Excite 3.0T型MR超导型扫描仪,采用8通道Torsopa腹部相控阵表面线圈,对比剂为钆贝葡胺注射液,高压注射器为Spectris Solsris。检查时禁止患者随身携带金属物品。
(2)扫描前准备。所有患者检查前8~12 h禁水、禁食,于扫描前15~30 min肌注山莨菪碱20 mg,适当减少胃肠蠕动,同时口服温开水600~800 ml,使胃腔充分充盈,产生饱腹感,轻拍后背减少胃腔内空气。于检查前5 min,再饮温开水200~400 ml,行呼吸训练,确立最佳屏气耐受点,尽可能减少呼吸运动伪影,立即予以MR检查扫描。
(3)MR扫描。患者取仰卧位,于腹部呼吸最明显处放置呼吸门控软管,确保显示屏上呼吸波幅度>全长1/3。将垫子置入呼吸门控软管周围,腹部线圈上缘平齐于胸骨柄1/2处,线圈中心置于主磁体中央。行呼吸训练,进行呼吸监控。
(4)扫描序列、范围和参数。①所有患者行腹部常规扫描T1WI、T2WI、弥散加权成像(diffusionweighted imaging,DWI)、肝脏三维容积快速采集(liver acquisition with volume acceleration,LAVA)Flex(LAVA-Flex)动态增强扫描序列;②扫描范围从胸骨柄1/2处至双侧肾上腺平面。LAVA-Flex动态增强扫描时经高压注射器以2.0 ml/s的注射速度静脉注入钆贝葡胺,剂量为0.2 ml/kg体质量,分别于注药后15~18 s、50~56 s扫描,获取动脉早期及晚期、门静脉早期及晚期图像;③扫描序列相关参数见表1。
(5)图像处理。采用Function软件进行扫描图像分析,由2名高年资影像医师观察并分析影像资料,采用双盲法进行阅片观察,观察病灶部位、大体形态、胃壁厚度、扫描各序列信号特征及多时相动态增强后病变强化方式、邻近器官受侵、胃壁浸润程度及淋巴结转移等,并参照美国胃癌临床TNM分期系统,对扫描图像行胃癌T分期评价,意见不统一时通过讨论达成一致。

表1 MRI扫描序列与扫描参数
1.5 观察指标
分析多模态MRI检查影像学特征,并以术后病理检查结果为金标准,评价多模态MRI对胃癌术前T分期诊断敏感度及特异度。胃癌T分期MRI诊断标准参考美国胃癌临床TNM分期标准[6]:①T1期,胃壁未增厚,可见异常强化胃壁内层,强化组织未超过中间层;②T2期,胃壁增厚异常,多层结构胃壁外层结构较为完整,或浆膜面整齐、光滑(由于影像学无法有效区分T1、T2期,故将两者合并为T1/T2进行观察);③T3期,胃壁全层被肿瘤浸润,胃壁外界或胃周脂肪间低信号带呈不规则网格状,或出现中断现象;④T4期,胃壁邻近器官结构信号改变,或增强扫描提示邻近器官结构异常强化影。
1.6 统计学方法
采用SPSS 19.0软件处理上述数据,计数资料以百分率(%)表示,组间行x2检验;计量资料以(x-±s)表示,组间行t检验,以p<0.05为差异有统计学意义。
2 结果
2.1 影像学分析
(1)对64例胃癌患者均进行MRI平扫、DWI及动态增强扫描。所有患者平扫时癌肿区胃壁均呈不均匀性增厚,厚度约为7.70~38.4 mm。各序列信号表现不同,其中病灶在T1WI序列呈等信号31例,或稍低信号33例;在T2WI序列呈等或稍高信号17例,呈等低信号47例;部分胃癌癌肿区胃壁出现三层结构,呈“高信号(黏膜层)-低信号(黏膜下层)-高信号(肌层及浆膜层)”。
(2)所有患者癌肿区正常胃黏膜形态出现消失或破坏。DWI图像上显示癌肿区胃壁呈高信号,部分胃壁可见分层结构。MRI动态增强扫描后呈不同程度强化,其中23例呈分层强化,动脉期病灶内层呈带状或线状明显强化,门静脉期自外扩展强化,延迟期癌肿区胃壁完全强化;41例呈不规则强化,动脉期病灶呈云絮状或不规则团块状强化,门静脉期病灶持续强化,延迟期逐渐减退,如图1所示。

图1 胃底贲门癌动态增强扫描MRI图像
(3)有36例患者胃壁浆膜面粗糙,呈结节状外突,于周围脂肪间隙内出现网格状或条索状阴影;16例胃壁浆膜面光滑,T1WI反相位上胃周脂肪与胃壁间低信号带完整;12例癌肿区与邻近脏器间脂肪间隙模糊,甚至消失。其中侵及肝脏、胰腺共18例;局部或远处淋巴结转移10例,淋巴结不同程度增大,于DWI序列中肿大淋巴结呈高信号;脏器转移6例,转移至肝脏6例,动态增强扫描提示转移灶动脉期呈花环状强化。
2.2 多模态MRI对胃癌术前T分期的诊断符合率
在64例胃癌患者中,经手术病理确诊T1/T2期26例,T3期23例,T4期15例,多模态MRI诊断T1/T2期24例、T3期21例、T4期14例,其诊断符合率为92.19%,见表2。

表2 多模态MRI诊断符合率分析(例)
2.3 多模态MRI T分期结果与术后病理诊断比较
(1)T1/T2期比较。多模态MRI诊断T1/T2期胃癌灵敏度为73.08%,特异度为86.8%,阳性预测值为79.2%,阴性预测值为82.5%,一致性检验Kappa值为0.61,见表3。
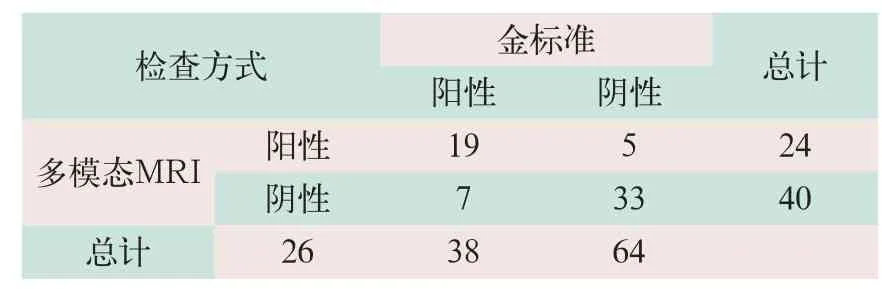
表3 多模态MRI诊断T1/T2期胃癌敏感度及特异度分析(例)
(2)T3期比较。多模态MRI诊断T3期胃癌灵敏度为82.61%,特异度为95.12%,阳性预测值为90.48%,阴性预测值为90.69%,一致性检验Kappa值为0.79,见表4。

表4 多模态MRI诊断T3期胃癌敏感度及特异度分析(例)
(3)T4期比较。多模态MRI诊断T4期胃癌灵敏度为86.67%,特异度为97.96%,阳性预测值为92.86%,阴性预测值为96.00%,一致性检验Kappa值为0.87,见表5。

表5 多模态MRI诊断T4期胃癌敏感度及特异度分析(例)
3 讨论
手术是胃癌最有效的治疗手段,有报道称局部分期是制定其治疗方案的主要参数,亦是预后的重要决定因素。其中,局灶性病变(T1~T2)可行根治性手术治疗,以获取最佳长期存活率,而局部进展期病变(T3~T4),往往行新辅助化疗联合根治性手术,生存率相对较低[7]。可见,术前早期诊断及分期并准确评价肿瘤侵润胃壁范围、程度及淋巴结受累状况,对指导临床制定合理的治疗方案、最大限度改善患者预后尤为重要。MRI技术以其无电离辐射、多序列多方位成像、软组织分辨力高等优点,已成为目前胃癌检出及术前分期的关键手段[8]。
本研究中,64例胃癌患者均接受MRI平扫,癌肿区胃壁均呈不均匀性增厚,厚度约为7.70~38.4 mm。而正常胃壁厚度为2~5 mm,通常局部胃壁增厚>6 mm被认为异常[9]。此外,炎性反应亦也导致胃壁增厚,如胃溃疡时胃壁会出现不同范围及程度的增厚,故仅以胃壁增厚这一特征来确诊胃癌缺乏说服力[10]。3.0T型MR平扫时各序列信号表现不同,本研究中发现病灶在T1WI序列呈等或稍低信号,T2WI序列有17例呈等或稍高信号,47例呈等低信号,这与瘤体病理组织学构成有关。如癌肿局部含黏液成分较多时,T2WI序列呈高信号;纤维结缔组织含量较多时,T1WI、T2WI序列呈低信号[11]。此外,肿瘤局部出血、坏死及水肿等情况均会诱发相应信号改变[12]。胃癌多时相动态增强扫描时一般存在两种强化类型,即分层强化与不规则强化。本研究中,发现低分化腺癌大部分呈分层、不均匀性强化,中高分化腺癌呈均匀性强化,表明胃癌强化可能与肿瘤组织分化有关;同时,多时相动态增强扫描能清晰显示胃癌三层结构(黏膜层、黏膜下层、肌层与浆膜层),很大程度上为胃癌分期提供了参考依据。进展期胃癌往往会累及并突破浆膜面,而本研究中,MRI显示病灶侵及邻近脏器时胃周脂肪间隙较为模糊,甚至消失;侵及浆膜时浆膜面毛糙、模糊,于T1WI反相位上可见癌肿区胃周脂肪与胃壁间低信号带中断,提示MRI对胃癌浆膜面侵犯有较大诊断价值。
本研究结果显示,多模态MRI对T1/T2、T3和T4期胃癌的诊断准确率分别为81.25%、90.63%和95.31%,证实多模态MRI对胃癌术前T分期诊断具有较高的准确性。颜小杭等[13]报道,MRI对进展期胃癌患者T分期诊断总准确率为86.67%,其中T2期为85.71%,T3期为76.92%,T4期为93.75%。另有文献报道,MR诊断胃癌T分期准确率可达73%~88%,T2、T3及T4期分别为63.00%~80.00%、78.60%~96.00%和40.00%~100.00%,这与本研究结论相似[14]。进展期胃癌T2、T3期准确区分一直是临床难点,而本研究对各个序列进行了T分期,以胃壁外界或其与胃周脂肪间信号带是否完整为依据来进行T2、T3期区分。MRI平扫结合DWI及动态增强扫描成像速度迅速,能充分显示胃壁分层及癌肿浸润深度,对T2、T3期诊断具有较高价值;其中,LAVA动态增强序列经结合采集技术、脂肪抑制技术,成像速度与图像分辨力得到了极大提高,于延迟期能清晰显示胃壁病变、胃周组织及浆膜外浸润状况,有助于区分T2、T3期胃癌[15]。动态增强扫描延迟期,T2期胃癌胃壁周围光滑,癌肿部胃壁强化明显,癌肿外层呈低信号;而T3期胃癌病灶全层逐渐强化,胃壁外层毛糙、模糊,周围脂肪间隙内显示不规则结节影或索条影[16]。结合上述征象,有利于区分T2、T3期胃癌。本研究中,主要以胃周脂肪征象、浆膜轮廓征象为依据,通过判定是否侵犯浆膜来区分T3、T4期胃癌。多模态MRI技术对评估是否穿透浆膜层较为可靠,可于腹腔脂肪与胃浆膜面之间形成连续线状低信号带,此低信号带有助于判断病变是否突破浆膜;采用LAVA动态增强序列,经邻近器官与肿瘤的不同强化方式可对各脏器是否受侵进行判断,利于肿瘤分期[17]。
本研究虽证实多模态MRI对胃癌术前T分期诊断具有较高的准确性,但仍存在不足之处,如胃周低信号带仅于胃周脂肪组织与胃壁相接触部位出现,而胃周脂肪组织是否存在有明显个体差异,易引起胃癌T分期误诊;炎症与纤维化于增强MR上呈增强表现,易诱发过度分期;MRI诊断较小淋巴结仍有一定局限性,故今后需深入调查研究[18]。
MRI在诊断胃癌术前T分期方面存在一定价值,准确判断病变部位、大小,尤其是在胃癌侵润深度方面的诊断准确性较高,并在一定程度上可反应病变病理组织学构成,有助于指导治疗方案的选择,改善患者预后。

