托吡酯对蛛网膜下腔出血后早期脑损伤的神经保护作用
范成普,杜杭根,周冰之,王承,郝必烈,李宏宇,陈景南,曹杰
(浙江中医药大学附属第二医院,浙江 杭州310005)
继发于颅内动脉瘤破裂的蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是神经外科临床中较常见的一种严重疾病,预后差、死亡率高,大约占所有中风病例的5%~7%[1]。既往研究发现,早期脑损伤发生在SAH后72小时内,是由多种机制参与其病理生理过程,预后较差[2-3],控制SAH后早期脑损伤具有重要意义。托吡酯作为一种新型、广谱的抗癫药物,已被报道对多种脑损伤有保护作用[4-6]。本研究旨在从神经细胞凋亡和炎症角度探讨托吡酯对SAH后早期脑损伤的神经保护作用,为临床治疗蛛网膜下腔出血提供新思路。
1 材料与方法
1.1 实验分组 SD雄性大鼠80只,清洁级,体质量180~230g,由上海西普尔实验动物有限公司提供,许可证号:SCXK(沪)2013-0016,随机分为假手术组20只、SAH组30只和TPM组30只。将三组SD大鼠在同一实验室饲养,饲料由标准粉、麸皮、鱼皮粉等组成,温度24~26℃,湿度60%~70%。
1.2 SAH模型构建 根据Bederson法[7]行颈内动脉穿刺建立SD大鼠蛛网膜下腔出血模型(SAH组和TPM组):取健康雄性SD大鼠,体质量300~350g,采用复合麻醉剂腹腔注射,仰卧位固定后经右侧股动脉插管,于术前及SAH后行血气分析。颈前部备皮、消毒,在颈部正中切口,钝性分离暴露左侧颈总动脉、颈外动脉和颈内动脉,结扎切断颈外动脉和颈内动脉之间的吻合支,将颈外动脉结扎并切断拉直,使其与颈内动脉成一直线。取3.0单股尼龙线50mm并在线端18.5mm处作一标记,头端锐化后将尼龙线经颈外动脉置入颈内动脉的颅内段,进入深度约18.5mm,直到感觉有阻力时再往前进3mm,刺破血管造成SAH,约15秒后迅速拔出尼龙线,然后结扎颈外动脉残端,缝合颈部切口。假手术组除了不刺破血管壁外,其余操作均与SAH组相同。整个手术过程大鼠予以电热毯保持恒温(37±1)℃。
1.3 方法 术后2小时,TPM组予40mg/kg托吡酯(Topiramte,TPM)灌胃,其余两组灌服等量生理盐水,12小时1次。灌胃前及术后24小时进行Garcia JH神经行为学评分[8],48小时后处死取脑组织检测含水量及 NF-κb p65、Caspase-3和 Bax/Bcl-2指标。
1.4 观察指标
1.4.1 神经行为学评分 Garcia JH神经行为学评分标准如表1,对每组大鼠逐一评估,最高18分,最低 3 分,结果以(±s)表示。

表1 Garcia JH神经行为学评分标准
1.4.2 脑组织含水量测定 采用干、湿重法测定。各组取大鼠6只,断头取脑,取伤侧大脑半球脑组织标本,电子天平称称取湿重(温度20~25℃,湿度70%~90%),然后将标本置于(100±2)℃恒温干燥箱内24小时烘干至恒重,称取干重。脑组织含水量=(湿重-干重)/湿重×100%。
1.4.3 其他指标 采用TUNEL/NeuN/DAPI染色观察细胞凋亡变化,采用Western blot方法检测Caspase-3、Bcl-2、Bax以及 NF-κb p65 表达。 Western blot检测方法:收集细胞,PBS洗细胞1次,用细胞裂解液裂解细胞,在冰上操作30分钟,10000r/min,4℃离心2分钟,收集细胞上清液测定样品蛋白浓度,10%SDS-PAGE电泳,将蛋白电转到PVDF膜上,用5%脱脂奶粉封闭1小时,加一抗 (NF-κb p65、Caspase-3、Bax、Bcl-2、actin)4℃孵育过夜,洗膜后结合碱性磷酸酶标记二抗(辣根过氧化物酶标记)室温避光孵育1小时,增强化学发光法(ECL)显影,应用凝胶成像分析系统分析结果,重复3次,取平均值。
1.5 统计学处理 采用SPSS22.0统计软件分析,计量资料以(±s)表示,组间比较采用t检验。
2 结果
与假手术组相比,SAH组神经行为学评分降低, 脑组织含水量升高,NF-κb p65、Caspase-3 和Bax/Bcl-2均升高,差异均具有统计学意义(均P<0.05)。与SAH组比较,TPM组行为学评分升高、脑组织含水量降低,NF-κb p65、Caspase-3 和 Bax/Bcl-2均降低,差异均具有统计学意义 (均P<0.05)。详见表2。从细胞凋亡及神经炎症角度看,TPM治疗后中可观察到绿色标记的凋亡细胞比例下降,Caspase-3和促凋亡蛋白Bax表达减少,抑制凋亡蛋白Bcl-2表达增加,NF-κb p65表达减少。详见图1-3。
表2 三组观察指标比较(±s)
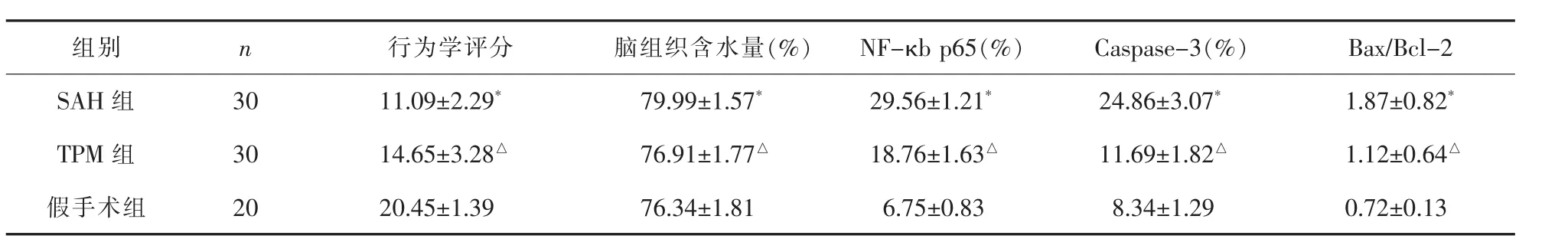
表2 三组观察指标比较(±s)
与假手术组比较*P<0.05;与SAH组比较△P<0.05
组别S A H组T P M组假手术组n 3 0 3 0 2 0行为学评分 脑组织含水量(%) N F-κ b p 6 5(%) C a s p a s e-3(%) B a x/B c l-2 1 1.0 9±2.2 9* 7 9.9 9±1.5 7* 2 9.5 6±1.2 1* 2 4.8 6±3.0 7* 1.8 7±0.8 2*1 4.6 5±3.2 8△ 7 6.9 1±1.7 7△ 1 8.7 6±1.6 3△ 1 1.6 9±1.8 2△ 1.1 2±0.6 4△2 0.4 5±1.3 9 7 6.3 4±1.8 1 6.7 5±0.8 3 8.3 4±1.2 9 0.7 2±0.1 3
3 讨论
SAH是由于脑血管破裂后血液流至蛛网膜下腔所致,是一种灾难性的疾病,可分为自发性和创伤性。SAH后早期脑损伤指出血后72小时内的脑组织损害,被认为是后期高致死率及高致残率的主要因素[7]。许多严重的生理紊乱在早期脑损伤期间有不良后果,如血脑屏障破坏、炎症、细胞死亡以及SAH后早期的症状体征。几十年来,治疗早期脑损伤的神经保护药物层出不穷,但均未达到满意的效果。TPM又名“妥泰”,是临床上一种新型的抗癫药,有研究证实其在一系列神经损伤中,如脑水肿、再灌注损伤、慢性压迫性神经损伤、癫、脊髓损伤、创伤性脑损伤等具有保护效应[8-10]。已有动物实验表明,TPM有助于改善缺血性颅脑损伤的神经功能[11];另外,也有研究者在大鼠的创伤性颅脑损伤模型上发现TPM的类似疗效。
本研究中,与假手术组相比,SAH组神经行为学评分降低,说明蛛网膜下腔出血会损伤颅脑神经功能,而经过TPM治疗,神经行为学评分又升高,说明TPM治疗在神经功能方面具有保护效应。颅脑损伤后脑组织含水量反映脑水肿程度,脑水肿通常导致一系列不良预后,本文中SAH组与假手术组相比,脑组织含水量升高,说明SAH后出现明显的脑水肿,水肿消退有利于脑神经损伤的恢复,经TPM治疗,脑组织的含水量显著降低(均P<0.05)。
此外,SAH引起的脑水肿涉及多种发生发展机制,包括细胞凋亡、促炎因子的调控(如IL-1β,IL-6和TNF-α)[12-13],其中,炎症在疾病的病理生理机制中发挥关键性作用,涉及到促炎因子释放、炎症细胞浸润。本实验研究了与神经炎症相关的信号通路NF-κb p6,表明SAH后血管痉挛中NF-κb参与促炎因子的调控,抑制NF-κb激活是一种调节神经保护或者神经功能恢复的重要途径。本研究Western blot结果显示TPM能抑制NF-κb激活,意味着在SAH后早期脑损伤中 NF-κb可能介导促炎因子的TPM调节。细胞凋亡,即程序性细胞死亡,出现在多种脑损伤的病理生理状态中。动脉瘤性蛛网膜下腔出血后的继发性改变包括颅内压增高和脑血流减少,易导致缺血性脑损伤,此种状态下细胞凋亡易出现在海马、血脑屏障和脉管系统,有可能比直接脑损伤更危险。颈内动脉穿刺法建立的大鼠蛛网膜下腔出血模型,细胞凋亡在大脑大部分区域可被观察到,尤其在基底大脑皮层和海马[14],与本研究一致。Caspases能导致DNA断裂和细胞死亡,是参与细胞凋亡的关键性调节,其中Caspases-3的激活依靠断裂的进程。此外,Bcl-2在各种条件下也参与神经凋亡的调节。在线粒体途径中,Bax为一种促进凋亡的蛋白质,易位到线粒体中并进一步产生细胞色素C,最终激活Caspases级联反应,如Caspases-3。Bcl-2作为一种抗凋亡蛋白,与Bax一起形成二聚体,Bax/Bcl-2比值意味着促凋亡或抗凋亡趋势。本实验中,SAH后细胞凋亡数目明显增多,Caspases-3大量激活和Bax/Bcl-2比值的升高均意味着SAH导致细胞凋亡,而经过TPM治疗后通过下调Bax/Bcl-2比值和抑制Caspases-3的激活达到了抗凋亡效应。类似的结果在Mao等[10]关于脑缺血以及再灌注损伤的研究有过报道。
综上所述,TPM可能通过抗凋亡、抗炎在SAH后早期脑损伤中发挥神经保护作用。作者后续将进一步研究TPM浓度-效应关系,从神经细胞凋亡和炎症两个不同角度探讨TPM对SAH后早期脑损伤的神经保护作用,从而为临床治疗蛛网膜下腔出血提供新的思路。

