促肾上腺皮质激素对母猪肝中葡萄糖代谢相关酶转录表达及活性的影响
孙 晔,曾梓菡,贾璨灿,宁彩波,吴望军,赵 芳*,刘红林*
(1. 南京农业大学动物医学院,南京 210095; 2.南京农业大学动物科技学院 动物遗传育种研究室,南京 210095)
现代集约化动物生产过程中难以避免应激的发生[1-2]。应激是指动物机体对威胁自身稳态事件所产生的一系列生物反应。应激发生后,机体下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)系统被激活,下丘脑释放促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH),CRH促使垂体释放促肾上腺皮质激素(adrenocorticotropic hormone,ACTH),ACTH作用于肾上腺皮质,上调皮质醇等肾上腺皮质类激素的分泌,从而调动机体各个组织器官应对外界刺激[3-4]。在猪生产中,应激被认为是损害猪生产性能的主要因素[5-6]。断奶或环境因素产生的应激会影响猪的采食量,降低猪日增重和饲料转化率,造成猪生长缓慢[7-8]。热应激会破坏猪的肠道屏障功能,降低部分消化酶活性,影响肠道微生物菌群平衡[9]。运输应激引起猪紧张不安,导致体温升高,降低猪肉品质[10]。除了对生长性能的影响,应激还会损害动物的免疫系统。研究发现,热应激后猪血清中细胞炎症因子IL-2、IFN-γ及TNF-α水平改变,机体的细胞免疫功能被抑制[11]。运输后猪的血清总蛋白下降,抗体生成减少,极易发生腹泻或呼吸道疾病甚至猝死[12-13]。对于生产母猪,温度升高会降低母猪的采食量及泌乳量,进而降低母猪体重,影响仔猪生长速率[14]。此外,应激会严重影响母猪的繁殖性能。应激导致母猪体内激素分泌紊乱,使母猪卵巢卵泡发育受阻、排卵减少,延迟母猪断奶后发情,严重时会诱发卵巢囊肿,增加母猪繁殖障碍的几率,给养殖场造成巨大的经济损失[15-17]。因此,研究应激反应的作用机制对了解猪的应激损伤意义重大。
血液中皮质醇浓度升高是衡量应激发生的重要指标。皮质醇刺激脂解和糖质新生,增加血糖供应,为机体应激应答提供更多的能量[18]。外源ACTH注射显著增加血液皮质醇水平,上调血糖水平,模拟应激的发生[19]。作为血糖来源的主要器官,肝中存在与糖原合成、糖原分解、糖酵解、糖异生、磷酸戊糖途径等糖代谢相关的酶类,它们的表达及活性是决定葡萄糖代谢正常进行的关键因素[20-22]。尽管近年来国内外对猪应激的研究取得了一定的进展,但应激对血糖指标变化的作用机理还有待进一步探讨。
为了明确应激引起的高皮质醇水平对母猪肝血糖调控机制的影响,本试验对母猪注射促肾上腺皮质激素(ACTH),通过检测母猪肝中糖代谢相关酶类的转录表达及酶活性,解析应激对肝血糖调控的影响机制,为进一步了解应激对母猪生产性能的影响提供一定的理论和试验依据。
1 材料与方法
1.1 试验动物及试验设计
试验母猪由江苏淮阴种猪场提供。选取9头,体重为(185±25) kg的健康经产断奶苏淮母猪,产后40天断奶,随机分成处理组(5头)和对照组(4头)。 断奶当天对母猪进行颈静脉插管手术,断奶后第2天开始试验(试验的第1天)。处理组于每天的8:00、16:00、24:00时(间隔8 h)分别注射1 IU·kg-1ACTH,同时给对照组受试母猪注射等量生理盐水,连续注射7 d。试验母猪自由采食、饮水,于试验第8天进行屠宰取样。
1.2 试剂
ACTH(A6303)购自Sigma公司;Trizol购自Invitrogen公司;M-MLV Reverse Transcriptase、SYBR Premix Ex Taq TM购自TaKaRa公司;皮质醇放射免疫分析试剂盒购自北京北方生物公司。葡萄糖代谢相关酶活性检测试剂盒购自索莱宝科技有限公司,具体货号: 6-磷酸葡萄糖脱氢酶(BC0260)、丙酮酸激酶(BC0540)、己糖激酶(BC0740)、糖原磷酸化酶(BC3340)、糖原合成酶(BC3330)、丙酮酸羧化酶(BC0730)、磷酸烯醇式丙酮酸羧激酶(BC3310)、果糖-1,6-二磷酸酶(BC0920)、葡萄糖-6-磷酸酶(BC3320)、果糖-6-磷酸激酶(BC0530)。
1.3 样品采集
每天采用一次性负压采血管(含肝素钠)由颈静脉插管采血10 mL。所有血液样品经3 000 r·min-1离心 10 min,分离血浆,于-20 ℃中保存,用于血糖和皮质醇水平的测定。试验母猪屠宰后,迅速采集肝组织,置于液氮中冻存。
1.4 血糖及皮质醇测定
将分离的待测血浆送至南京市军区总医院,利用全自动生化分析仪对血糖(GLU)进行检测分析;采用放射免疫法测定血浆皮质醇浓度。
1.5 实时荧光定量PCR
根据NCBI核酸数据库中相应基因mRNA的全序列,利用Primer premier5.0软件设计引物,引物由金唯智生物公司合成(引物序列见表1)。Trizol 法提取肝样品中的总RNA,紫外分光光度计检测RNA质量和浓度,进行反转录及荧光定量PCR扩增。反应体系:2×SYBR Premix Ex Taq 10 μL, 上下游引物(10 μmol·L-1)各0.4 μL,50×ROX Reference Dye 0.4 μL,cDNA模板2 μL,ddH2O 6.8 μL,总体积20 μL。反应条件:95 ℃预变性3 min; 95 ℃变性10 s,62 ℃退火10 s,72 ℃延伸15 s,40个循环。被检样品均重复3次,取平均值;以GAPDH作为内参基因,利用2- △△Ct法计算各基因的相对表达量[23],△Ct = Ct目的基因-Ct内参基因;△△Ct=(Ct处理组目的基因-Ct处理组内参基因)-(Ct对照组目的基因-Ct对照组内参基因),2-△△Ct表示处理组目的基因的表达相对于对照组的变化倍数。
1.6 葡萄糖代谢相关酶类活性测定
根据试剂盒说明书,取适量肝组织,按照组织质量(g)∶提取液体积(mL)为1∶(5~10)的比例,冰浴匀浆;于8 000 g 4 ℃离心10 min,取上清,置冰上;分光光度计波长设置为340 nm,用蒸馏水调零,加样检测葡萄糖代谢相关酶活性。
1.7 数据统计分析
所有数据均用“平均数±标准差”表示,利用SPSS 20.0软件进行统计,采用独立样本t检验分析试验组与对照组之间的差异;*表示处理组与对照组比较差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结 果
2.1 ACTH处理对母猪血液皮质醇浓度及血糖水平的影响
母猪血液皮质醇浓度变化如图1所示。试验第1天,ACTH处理组母猪血液皮质醇浓度急剧升高,组间差异极显著(P<0.01);试验第1到第4天,ACTH处理组皮质醇浓度下降,但仍显著高于对照组(P<0.05);试验第4到第7天,处理组皮质醇浓度稳定,处理组与对照组差异显著(P<0.05)。试验期间,对照组母猪血液中皮质醇浓度稳定,没有显著变化。
母猪血糖水平变化如图2所示,试验期间处理组血糖水平均高于对照组,且同一时间段组间差异均达显著水平(P<0.05)。
表1实时荧光定量PCR引物列
Table1Primersforthereal-timequantitativePCRassay

基因Gene引物对序列(5′→3′)Sequence of primerNCBI登录号NCBI accession No.PYGLF: CATCGTGAAGACCCAAGTATR:GCCCAGGAAGTGGTGTAGNM_001123172.1GYS1F:CTATGTGCTGGTGCTGTGGAR:CTCCATGCAGTAGCGGTGATNM_001195508.1GYS2F:ATGTCACCGTGGTGGTGTTTR:GCTGAGGATGGGATCAGTGGNM_001195511.1HK1F:GTGAAGCTGCTTGAGAAAGCCR:TTGATGCACATCCTGCCCTCNM_001243184.1HK2F: AGATGATCGCCTCGCATCTGR: GCTCCAAGCCCTTTCTCCATNC_010445.3HK3F: CCAGTTGCTACGAGATGCCAR:GGTGTCTACAACCAGCCCAANC_010444.3PFKLF:GGCCCAGACTTACTCACACCR:TCGATGACCTCCATGATGCGXM_013990207PKLRF:CTTCCCTGTGCTCTACCGTGR:CCACGGAGTTTTCCGCTTTCXM_005663320.1G6PCF:TCGGTGCCACTGATAAAGCR:GGGAAATGAGCAGCAAGGTNM_001113445.1FBPF:ATCCTCCAACATCGACTGCCR:ACTAGGGTCGCACTTCCGTANM_001167632.2PCF:CTGGCTACGGGTTCCTGTCCR:CCACCTTGTCTCCCATCTTGCNM_214349.1PCK1F:ATCCGACCTTCCTTGACCATR:TCAGCCTCTTGATGACACCCNM_001123158.1PCK2F:ATGGCGACTTCGTCAAGTGTR:CCGAAAGAGACGATCTCCCGXM_005666229.1GRF:CTCAGCAGCAACGGGACCACR:TGAAGACACTTTCTGTAGCGGCATNM_001008481.1β-actinF: CCTGGACTTCGAGCAGGAGATGGR: TGTCGGCGATGCCTGGGTAXM_003124280.4
F.上游引物;R.下游引物
F.Forward primer; R. Reverse primer

*表示处理组与对照组比较差异显著(P<0.05),**表示差异极显著(P<0.01)。下图同
* indicate significant difference (P<0.05), ** indicate extremely significant difference (P<0.01) between treatment and control groups. The same as the following figures
图1 ACTH处理对母猪血液中皮质醇浓度的影响
Fig.1 Effects of ACTH-treatment on concentrations of cortisol in the blood of sows
2.2 ACTH处理对母猪肝中糖代谢相关酶类转录活性的影响
母猪肝糖异生相关酶类mRNA表达水平如图3所示。对照组与处理组母猪肝中丙酮酸羧化酶(PC)、果糖-1,6-二磷酸酶(FBP)及磷酸烯醇式丙酮酸羧激酶2(PCK2)的mRNA表达水平差异不显著(P>0.05)。与对照组相比,ACTH处理组母猪肝中葡萄糖-6-磷酸酶(G6PC)及磷酸烯醇式丙酮酸羧激酶1(PCK1)的mRNA表达水平显著上调(P<0.05)。
分析ACTH处理对母猪肝中糖酵解相关酶类mRNA表达的影响,结果如图4所示。母猪肝中磷酸果糖激酶(PFKL)、丙酮酸激酶(PKLR)、己糖激酶1(HK1)和己糖激酶3(HK3)的mRNA表达水平在两组间差异不显著(P>0.05)。但是,处理组母猪肝中己糖激酶2(HK2) mRNA表达水平显著高于对照组(P<0.05)。
分析ACTH处理对母猪肝中糖原合成、分解及戊糖磷酸途径相关酶类mRNA表达的影响,结果如图5所示。与对照组相比,处理组母猪肝中糖原合成酶1(GYS1)、糖原磷酸化酶(PYGL)及6-磷酸葡萄糖脱氢酶(G6PD)的mRNA表达水平呈上升趋势,但两组间差异均不显著(P>0.05)。
2.3 ACTH处理对母猪肝中葡萄糖代谢相关酶活性的影响
ACTH处理对母猪肝中葡萄糖代谢相关酶类活性的影响如图6所示。处理组母猪肝中丙酮酸羧化酶(PC)、果糖-1,6-二磷酸酶(FBP)、磷酸烯醇式丙酮酸羧激酶(PCK)的活性与对照组相比差异不显著(P>0.05)。处理组母猪肝中葡萄糖-6-磷酸酶(G6PC)的活性显著高于对照组(P<0.05),磷酸果糖激酶(PFKL)的活性显著低于对照组(P<0.05)。此外,丙酮酸激酶(PKLR)、己糖激酶(HK)、糖原合成酶(GYS)、糖原磷酸化酶(PYGL)及6-磷酸葡萄糖脱氢酶(G6PD)活性在两组间的差异均不显著(P>0.05)。
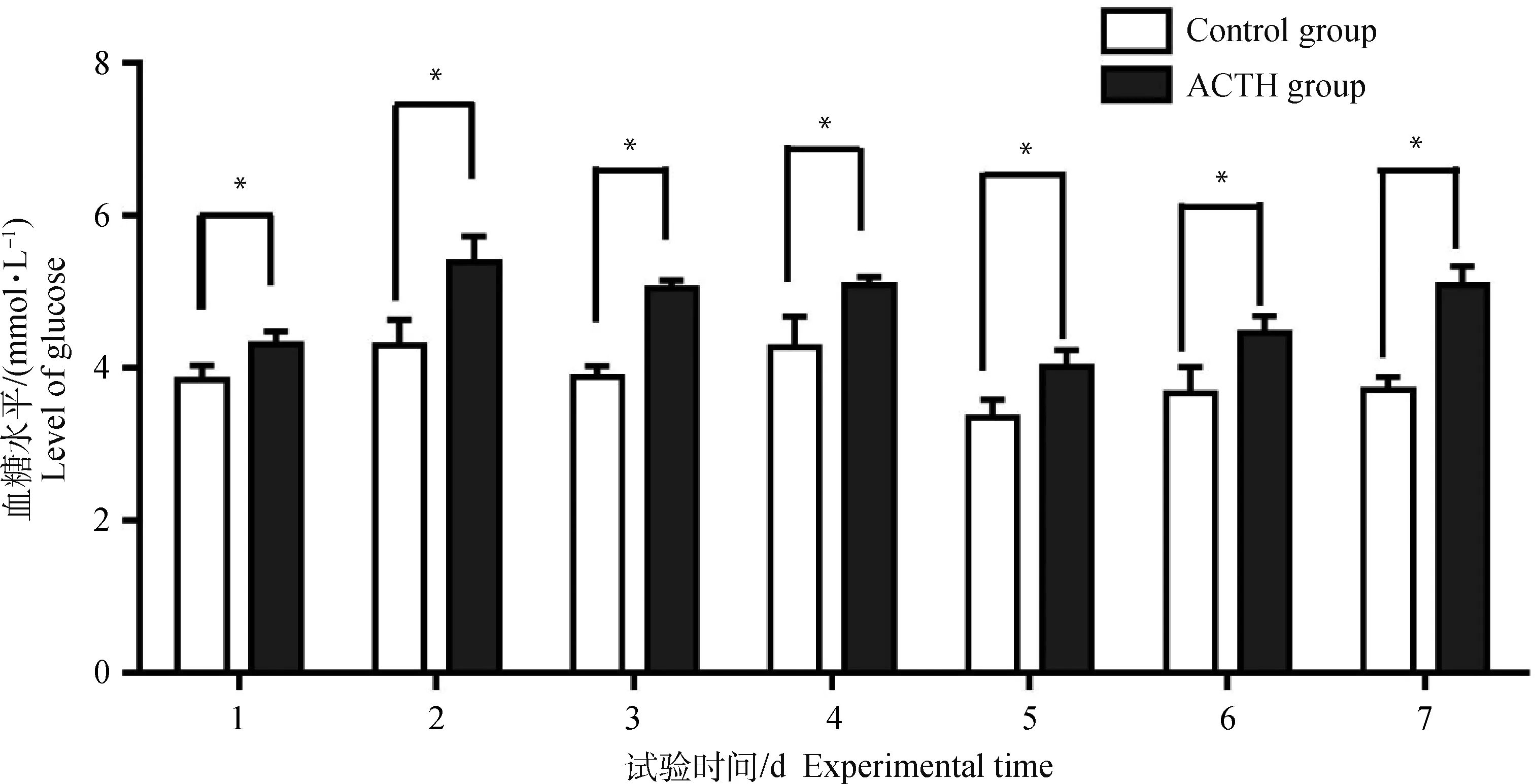
图2 ACTH处理对母猪血糖水平的影响
Fig.2 Effects of ACTH-treatment on levels of glucose in the blood of sows
2.4 ACTH处理对母猪肝中糖皮质激素受体mRNA表达的影响
检测处理组与对照组母猪肝中糖皮质激素受体(GR) mRNA的表达水平,结果显示,处理组GR水平呈上调趋势,但两组间差异不显著(P>0.05)(图7)。
3 讨 论
本试验通过对母猪注射促肾上腺皮质激素(ACTH)模拟应激发生,分析应激对母猪肝血糖调控的影响机制。试验第1天,处理组皮质醇浓度急剧升高,随着试验持续进行,皮质醇浓度略有下降,这可能与皮质醇对HPA轴的反馈调节有关。对照组皮质醇浓度保持平稳,说明注射处理本身没有对动物造成应激反应。试验期间处理组母猪皮质醇浓度一直显著高于对照组,且处理组血糖水平明显高于对照组,均反映处理组母猪处于应激状态,应激模型建立成功。
血糖是体内代谢过程中的重要物质,与部分血脂指标及脂肪沉积性状存在显著相关性[24],可以反映机体能量变化。肝糖异生是肝糖代谢的重要组成部分,机体近一半葡萄糖的供应依赖于糖异生作用[25]。糖异生的速度与编码糖异生途径限速酶的基因表达有关[26-27]。本试验中,处理组肝母猪肝中糖异生途径的关键酶葡萄糖-6-磷酸酶(G6PC)及磷酸烯醇式丙酮酸羧激酶(PCK1、PCK2)的mRNA表达水平均上调,且葡萄糖-6-磷酸酶(G6PC)的酶活性明显上升,表明ACTH处理引起的高浓度皮质醇可能通过糖异生途径中的限速酶葡萄糖-6-磷酸酶及磷酸烯醇式丙酮酸羧激酶加速肝中糖异生速度,提高血液中葡萄糖浓度。糖酵解是机体内分解葡萄糖供能的必经途径,酵解过程有3步反应为不可逆反应,催化这3步反应的酶是己糖激酶、磷酸果糖激酶和丙酮酸激酶,其中磷酸果糖激酶是糖酵解反应的限速酶[28-30]。

图3 ACTH处理对母猪肝糖异生相关酶类mRNA表达的影响
Fig.3 Effects of ACTH-treatment on mRNA expression of enzymes related to gluconeogenesis in the liver of sows

图4 ACTH处理对母猪肝糖酵解相关酶类mRNA表达的影响
Fig.4 Effects of ACTH-treatment on mRNA expression of enzymes related to glycolysis in the liver of sows

图5 ACTH处理对母猪肝糖原合成、分解及戊糖磷酸途径相关酶类mRNA表达的影响
Fig.5 Effects of ACTH-treatment on mRNA expression of enzymes related to glycogen synthesis, breakdown and pentose phosphate pathway in the liver of sows

图6 ACTH处理对母猪肝中葡萄糖代谢相关酶活性的影响
Fig.6 Effects of ACTH-treatment on activity of enzymes related to glucose metabolism in the liver of sows
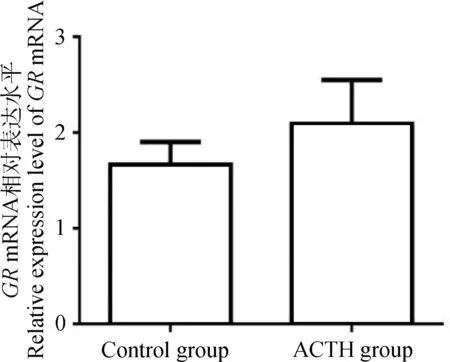
图7 ACTH处理对母猪肝中糖皮质激素受体mRNA表达的影响
Fig.7 Effects of ACTH-treatment on mRNA expression of glucocorticoid receptor in the liver of sows
本试验中,处理组肝己糖激酶2(HK2)mRNA表达上调;己糖激酶1(HK1)、丙酮酸激酶(PKLR)的mRNA表达水平呈下调趋势。在正常生理状态下,低浓度血糖会激起肝中丙酮酸激酶的磷酸化,使其活性降低,降低肝中葡萄糖的利用[31]。本研究中,ACTH处理下调丙酮酸激酶的转录表达,降低磷酸果糖激酶的酶活性,暗示应激抑制猪肝中的糖酵解,进而抑制肝中葡萄糖的利用。糖原是葡萄糖的一种高效能的贮存形式,糖原的存在保证了机体最需能量供应的脑和肌肉紧张活动时对能量的需要,同时也保证不间断地供给恒定水平的血糖[32-33]。肝是机体贮存糖原的器官,本研究中,ACTH处理没有显著影响肝中糖原合成酶1(GYS1)的mRNA表达,此外参与糖原分解的糖原磷酸化酶(PYGL)及参与磷酸戊糖途径的关键酶6-磷 酸葡萄糖脱氢酶(G6PD) 的mRNA表达均未发生显著变化,暗示ACTH处理未影响肝中糖原合成、糖原分解及磷酸戊糖途径。
皮质醇主要通过与糖皮质激素受体结合发挥其生物学作用[34-35],为分析ACTH处理是否影响母猪肝中糖皮质激素受体GR的表达,本研究分析了两组母猪肝中糖皮质激素受体mRNA的表达差异,结果显示,处理组猪肝中糖皮质激素受体水平呈上调趋势,但差异未达显著水平;这一结果暗示,ACTH处理对母猪肝中糖代谢相关酶类转录活性的影响可能依赖于GR之外的其它途径,具体机制仍需要进一步研究探讨。
4 结 论
本试验通过ACTH处理模拟猪生产中应激的发生,致使母猪皮质醇浓度升高,其导致血糖水平升高的可能作用机制:一方面通过上调肝中磷酸烯醇式丙酮酸羧激酶和葡萄糖-6-磷酸酶基因的转录表达,增强糖异生作用;另一方面,通过下调肝中磷酸果糖激酶的活性,抑制糖酵解反应,降低葡萄糖利用。但ACTH处理不影响肝中磷酸戊糖途径、糖原合成及分解;且ACTH处理未影响母猪肝中糖皮质激素受体的转录表达,提示ACTH处理对母猪肝中糖代谢相关酶类转录活性的影响可能依赖于GR之外的其它途径。
——猪肝泥

