短链氯化石蜡(SCCPs)和多环芳烃(PAHs)联合暴露对HepG2细胞抗氧化系统的影响
王菲迪,张海军,耿柠波,任晓倩,3,张保琴,宫玉峰,陈吉平,*
1. 中国科学院大连化学物理研究所,大连 116023 2. 省部共建国家重点实验室培育基地—浙江省植物有害生物防控重点实验室 浙江省农业科学院农产品质量标准研究所,杭州 310021 3. 中国科学院大学,北京 100049
近年来,环境污染受到越来越广泛的关注,且环境化学污染物种类繁多,往往多以低浓度混合物形式存在,因此不可避免地对人类造成复杂多样的健康危害,即潜在联合毒性效应。因此环境污染物的低剂量、联合毒性效应已经成为毒理学研究中的热点问题。具有相似或者不同作用机制的化学污染物能够互相影响各自的毒性效应,从而可能在不同的生物反应指标和多个作用终点引起一系列的协同、加和或者拮抗效应[1-2]。多环芳烃(PAHs)和短链氯化石蜡(SCCPs)是2种典型的有机污染物。PAHs是一类由2个或2个以上苯环构成的碳氢化合物,约有200多种,主要来源于有机质的热解和不完全燃烧[3]。短链氯化石蜡(short-chain chlorinated paraffins, SCCPs)是链长为10~13个碳原子,氯化程度在30%~70%的氯化石蜡,于2017年列入斯德哥尔摩公约POPs行列[4]。
PAHs和SCCPs广泛存在于各种环境介质中,在人母乳和血液中都以较高的浓度水平存在。SCCPs在中国人母乳和血液中浓度分别为5.24~644 μg·L-1[5]和14.8~1 400 μg·L-1[6]。PAHs在意大利的人类母乳样本中浓度为40.97~259.33 μg·L-1[7]。而在印度的人类血液样本中也检出了PAHs,其浓度为57.72~1 007.85 μg·L-1[8]。PAHs和SCCPs的主要作用机制明显是不同的。大多数多环芳烃异构体主要作为芳香烃受体(AhR)的激活剂,引起一系列的毒性和生物效应,包括诱导细胞色素P4501A1和P4501B1酶,诱发细胞转化以及致癌毒性[9-11]。另外,PAHs还可以通过改变卵巢雌激素受体蛋白β的表达来干扰破坏内分泌系统[12]。由于SCCPs具有脂肪族化合物结构,因此其可以作为过氧化物酶体增殖物激活受体(PPAR)的激动剂从而诱导过氧化物酶体增殖,而过氧化物酶体增殖通常与加速脂肪酸降解、肝损伤以及潜在的致癌性有关[13-15]。此外,SCCPs能够通过与雌激素受体蛋白α和肾上腺皮质激素受体结合表现出内分泌干扰效应[16]。目前为止,还没有关于PAHs和SCCPs联合毒性的研究。
肝脏是PAHs和SCCPs共同的主要作用靶器官[10,13,17-18]。因此本研究中我们仍选用与肝细胞同源且保留肝脏众多特殊功能的肝癌细胞HepG2细胞作为受试细胞模型来评价PAHs、SCCPs以及它们的联合暴露毒性[19]。大部分外源化合物都会引起细胞的氧化应激反应[20]。因此本文章研究了PAHs和SCCPs单独和联合暴露对HepG2细胞内ROS含量、抗氧化防御系统关键酶(过氧化物歧化酶(SOD)、过氧化氢酶(CAT))活性、非酶的谷胱甘肽(GSH)以及脂质过氧化指示物丙二醛(MDA)的含量的影响,并探讨联合暴露对这些指标的联合作用类型。
1 材料与方法(Materials and methods)
1.1 实验材料

1.2 实验仪器
Galaxy 48 R型CO2培养箱(美国New Bruns-wick公司),Tecan多功能酶标仪(Tecan Genesis,瑞士),Biofuge®Stratos全能台式高速冷冻离心机(德国Heraeus公司),微板振荡器(LAB-LINE,USA),超声细胞破碎仪(SCIENTZ JY 96-IIN,宁波新芝)。
1.3 实验方法
1.3.1 细胞培养和样品前处理
HepG2细胞在37 ℃、含有5% CO2的细胞培养箱中培养,培养基为含10% FBS和1%青霉素-链霉素的DMEM细胞培养液。取对数期生长的细胞接种至96孔板用于细胞增殖活性测试,接种密度分别为2 × 104细胞/孔,待细胞铺满96孔板的80%后进行PAHs和SCCPs的单独以及联合暴露试验,暴露时间为24 h。取对数期生长的细胞接种至6孔板用于胞内酶活性测试,接种密度为3 × 105细胞/孔,待细胞铺满6孔板的80%后进行PAHs和SCCPs的单独以及联合暴露试验,暴露时间为24 h。PAHs和SCCPs通过溶解在DMSO中引入细胞培养液,暴露浓度设置为:SCCP混合标样(总浓度ΣSCCPs为100 μg·L-1),PAH混合标样(每种PAH浓度为10 μg·L-1,总浓度ΣPAHs为160 μg·L-1),PAHs和SCCPs的混合物(混合标样中PAHs和SCCPs的浓度分别为:ΣPAHs 160 μg·L-1和ΣSCCPs 100 μg·L-1)。DMSO在培养液中的最终浓度为0.05%(V/V),对照组中只含有0.05%的DMSO。
用于酶活性测定的细胞暴露24 h后终止培养,移除培养基,用PBS清洗3遍后每孔加入0.25%胰酶200 μL消解,加入含有胎牛血清的全培养液200 μL终止消解。每孔加入1 mL PBS,用移液枪轻轻吹打至细胞完全脱离培养皿壁,制成细胞悬液并转移至离心管中,在8 ℃低温下离心,2 000 g5 min,用1 mL注射器吸弃上清液,加入预冷过的PBS液约1.5 mL并轻柔吹打重悬细胞,在8 ℃低温下离心,2 000 g5 min,重复3次。获得的细胞样品加入0.5 mL PBS重悬,在冰浴条件下用超声细胞破碎仪进行细胞破碎,破碎条件为:超声10 s,间隔10 s,持续1 min。获得的细胞悬液部分直接用于氧化指标、总蛋白浓度的测定。
1.3.2 MTT法检测细胞活度
用于细胞活度检测的细胞暴露24 h后,96孔板每孔加入MTT液(5 mg·mL-1,溶于PBS)20 μL,继续在37 ℃、含有5% CO2的培养箱中培养4 h。吸出孔内培养液后,每孔加入150 μL DMSO,溶解活细胞与MTT结合形成的紫色晶体。室温下,将96孔板置于微孔板振荡器上振荡10 min,使结晶物溶解,采用酶标仪(Tecan Infinite F50)在492 nm波长下检测各孔吸光度值,细胞活力通过将对照组细胞活力当做100%来计算。
1.3.3 总蛋白浓度及抗氧化指标测定
细胞内总蛋白(TP)浓度,谷胱甘肽(GSH)浓度,丙二醛(MDA)浓度,过氧化物歧化酶(SOD)活性,过氧化氢酶(CAT)活性和活性氧自由基(ROS)浓度均采用南京建成试剂盒(中国南京建成生物工程研究所)来进行测定。操作过程参照我们以前发表的文献中报道的方法[22],采用考马斯亮蓝法测定蛋白含量,采用二硫代二硝基苯甲酸法测定GSH浓度,采用硫代巴比妥酸法测定MDA浓度,采用水溶性四唑盐法测定SOD活性,采用钼酸铵法测定CAT活性,采用DCFH-DA探针法测定ROS含量,具体测定操作和计算按南京建成生物工程研究所的试剂盒说明书进行。
1.4 数据处理
为确保实验结果的可靠性,实验数据均为6次独立实验的结果。用SPSS PASW(SPSS Inc.,Chicago, IL)软件进行组间差异显著性检验,P< 0.05被认为有显著差异。另外为了能够定量区分PAHs和SCCPs联合暴露的类型,我们选择了判定联合作用类型常用的IA(independent action)模型[23]来判定PAHs和SCCPs的联合作用类型,计算公式如下所示:
E= 1-(1-EPAHs)×(1-ESCCPs)
基于E值来判别联合暴露的作用类型,EPAH、ESCCP和E联合分别代表SCCPs、PAHs以及它们的联合暴露相对于对照组所引起的变化。当计算的E值接近E联合值时,联合作用类型被认为是“加和效应”;当计算的E值小于E联合值时,联合作用类型被认为是“协同效应”;当计算的E值大于E联合值时,联合作用类型被认为是“拮抗效应”。
2 结果(Results)
2.1 PAHs和SCCPs单独暴露和联合暴露对HepG2细胞增殖活性的影响
与对照组相比,PAHs和SCCPs以及它们的混合物暴露HepG2细胞24 h后,都能导致细胞活度的显著降低。如图1所示,在PAHs和SCCPs暴露组中,细胞活度的平均值分别降低了5%和2.5%。而在PAHs和SCCPs的联合暴露组中,细胞活度的平均值降低了6.2%。另外根据PAHs和SCCPs对细胞活度的影响计算的E值(7.4%)大于实际测得的E联合值(平均值6.2%),因此联合暴露对细胞活度的影响表现为拮抗效应。
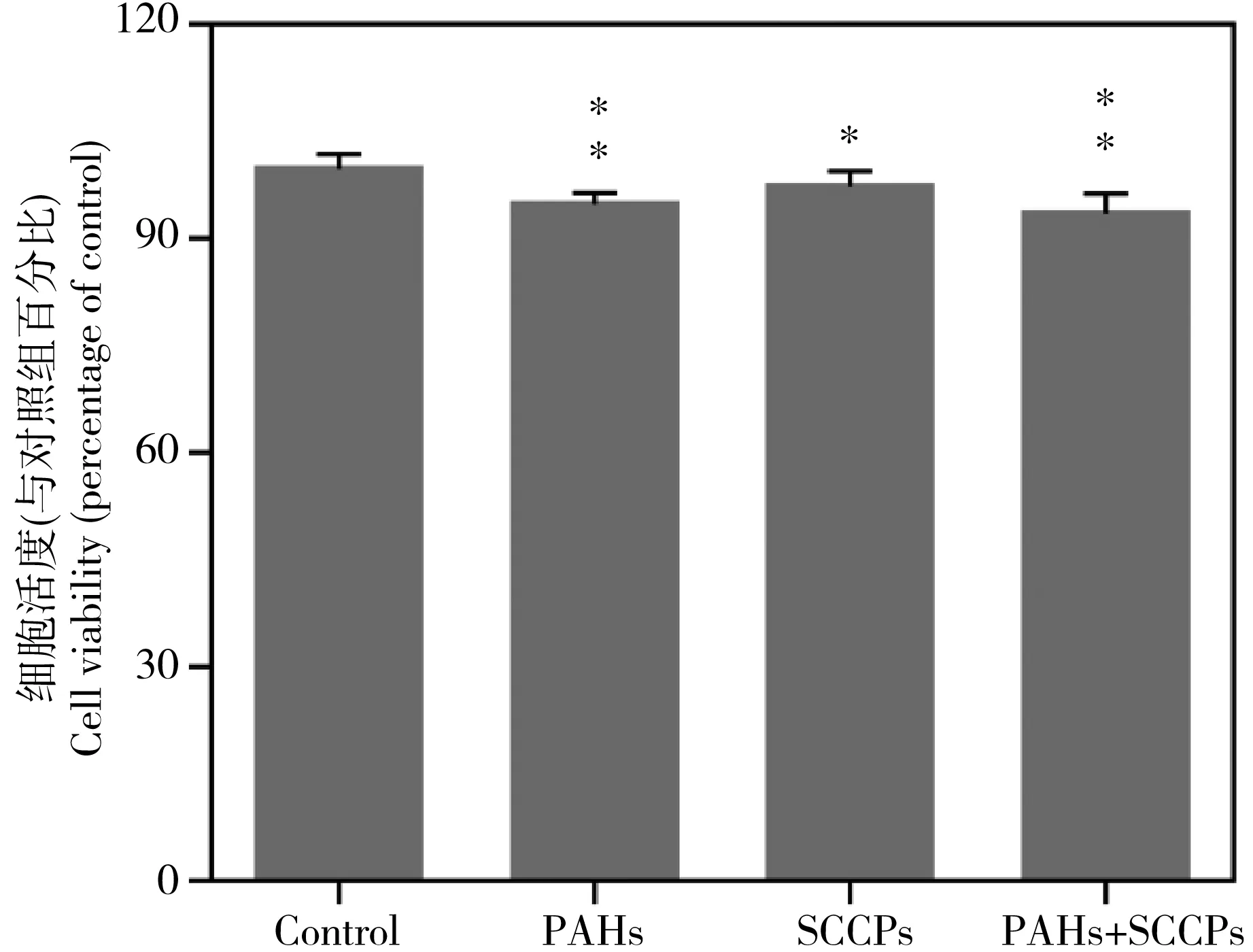
图1 PAHs、SCCPs以及它们的联合暴露对HepG2细胞增殖活性的影响注:PAHs为多环芳烃,SCCPs为短链氯化石蜡。显著性变化为暴露组与对照组相比的T统计结果,* P < 0.05;** P < 0.01。Fig. 1 Viability of HepG2 cells exposed to PAHs, SCCPs and their combination for 24 hNote: PAHs stands for polycyclic aromatic hydrocarbons, and SCCPs stands for short-chain chlorinated paraffins. Significant differences were indicated in comparison of the control by T-test. *, P < 0.05; **, P < 0.01.
2.2 PAHs和SCCPs单独暴露和联合暴露对HepG2细胞内ROS含量的影响
如图2所示,与对照组相比,ROS含量在PAHs、SCCPs和联合暴露组中都升高,但是只有在SCCPs和联合暴露组中显著升高(P<0.01)。ROS含量的平均值在PAHs和SCCPs暴露组中分别升高了5.5%和17.4%,用这2个变化值计算得到联合暴露组E值为22%,小于实际联合暴露引起的ROS含量相对升高量(平均值27.7%),因此联合暴露对ROS含量的影响表现为协同效应。
2.3 PAHs和SCCPs单独暴露和联合暴露对HepG2细胞内抗氧化酶活性的影响
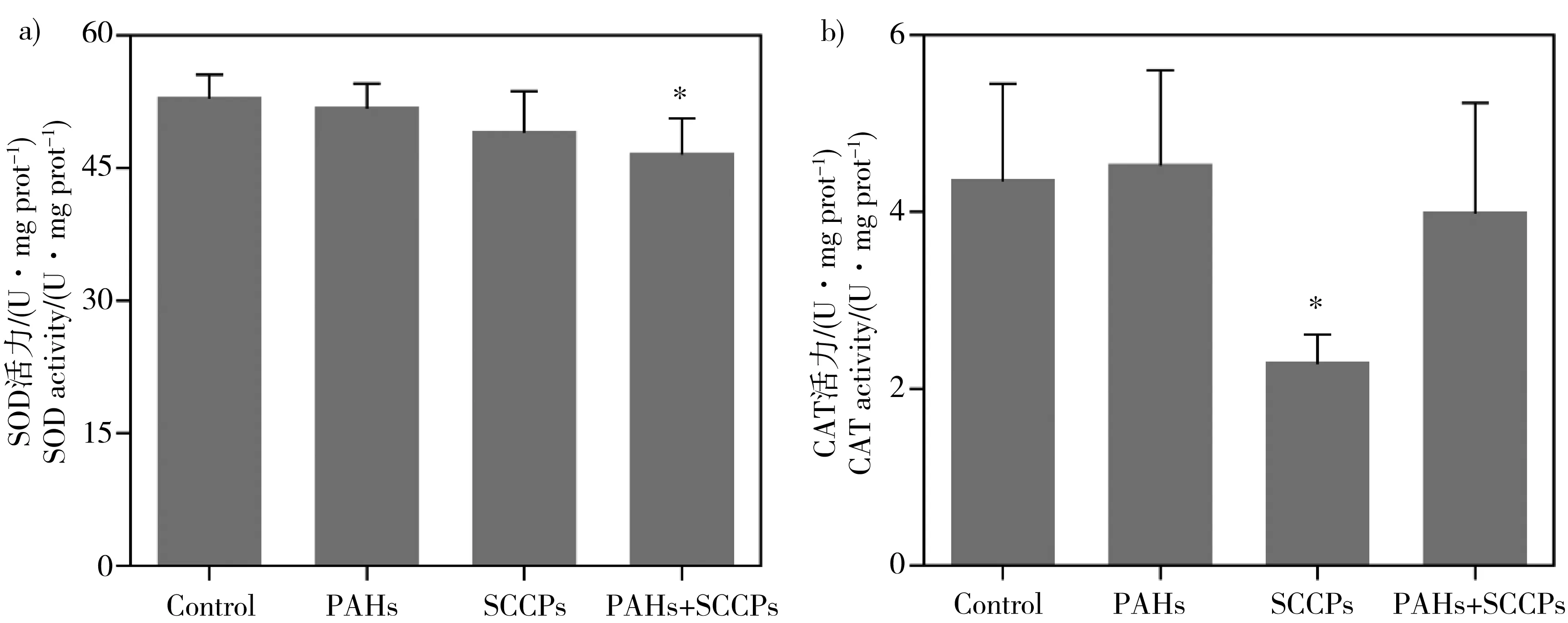
图3 PAHs、SCCPs及联合暴露24 h对HepG2细胞内SOD活性和CAT活性的影响注:显著性变化为暴露组与对照组相比的T统计结果,* P < 0.05;** P < 0.01。Fig. 3 Changes of SOD and CAT activities in HepG2 cells exposed to PAHs, SCCPs and their combination for 24 hNote: Significant differences were indicated in comparison of the control by T-test. *, P < 0.05; **, P < 0.01.

图4 PAHs、SCCPs及联合暴露24 h对HepG2细胞内GSH和MDA含量的影响注:显著性变化为暴露组与对照组相比的T统计结果,* P < 0.05;** P < 0.01。Fig. 4 Changes of GSH and MDA concentrations in HepG2 cells exposed to PAHs, SCCPs and their combination for 24 hNote: Significant differences were indicated in comparison of the control by T-test. *, P < 0.05; **, P < 0.01.
如图3a所示,与对照组相比,SOD的活性在3个暴露组中都呈现降低趋势,但是只有在联合暴露组中才显著降低。SOD活性平均值在PAHs和SCCPs暴露组中分别降低了2%和7%,用这2个值计算的联合暴露组E值为8.9%,小于联合暴露实际引起的SOD活性相对降低值(平均值12%),因此联合暴露对SOD活性的影响表现为协同效应。与对照组相比,细胞内CAT的活性在SCCPs暴露组中显著下降,而在PAHs和联合暴露组中分别呈现轻微的升高和降低趋势,但是都不具有显著性差异(图3b)。在PAHs和SCCPs暴露组中,CAT活性相对改变平均值分别为4%和47.4%,用这2个值计算的联合暴露组E值为49.5%,远大于联合暴露实际引起的CAT活性相对变化值(平均值8.4%),因此联合暴露对CAT活性的影响表现为拮抗效应。
2.4 PAHs和SCCPs单独暴露和联合暴露对HepG2细胞内GSH、MDA含量的影响
如图4a所示,与对照组相比,GSH的含量在PAHs和SCCPs单独暴露组中都有轻微下降趋势,而在联合暴露组中呈现出轻微上升趋势。GSH含量平均值在PAHs和SCCPs暴露组中分别降低了9.4%和6.6%,用这2个值计算的联合暴露组E值为15.4%,远大于联合暴露实际引起的GSH含量相对变化值(平均值3.3%),,因此联合暴露对GSH含量的影响表现为拮抗效应。与对照组相比,细胞内MDA的含量仅在SCCPs暴露组中显著升高(图4b)。在PAHs和SCCPs暴露组中,MDA含量平均值分别改变了0.8%和7.3%,用这2个值计算的联合暴露组E值为8%,大于联合暴露实际引起的MDA含量相对变化值(平均值5.8%),,因此联合暴露对MDA含量的影响表现为拮抗效应。
2 讨论(Discussion)
在以前的研究中,PAHs和SCCPs都被证明能够引起机体的氧化损伤,而氧化损伤则会引起一系列损伤,包括降低异柠檬酸脱氢酶活性、DNA损伤、细胞凋亡等等[8,15,24-27]。但是PAHs和SCCPs的联合暴露对细胞氧化损伤还没有得到研究。由于环境化学污染物通常以低浓度混合物形式存在,且PAHs和SCCPs是2种典型且环境介质中普遍存在的有机污染物,因此研究它们的联合暴露具有重要的意义。本实验以HepG2细胞为研究对象,探讨了环境浓度的PAHs和SCCPs单独暴露以及联合暴露对细胞增殖活性和抗氧化系统的干扰作用。结果表明PAHs、SCCPs以及它们的联合暴露都引起了细胞内ROS的产生,进一步导致抗氧化系统失调,最终导致细胞损伤,甚至凋亡。
正常情况下,ROS作为新陈代谢过程中产物在机体中会不断产生,同时体内的抗氧化酶以及非酶抗氧化剂能够清除细胞内多余的活性氧,抗氧化体系各成员之间通过相互协调维持机体氧化/抗氧化系统平衡。在以前多个研究中,PAHs被证明能够引起ROS的产生[26-28]。而在本研究中,PAHs、SCCPs以及联合暴露后,HepG2细胞内都产生大量的ROS,尤其是联合暴露组中ROS产生量最大,联合暴露在引发ROS产生的效应上表现为协同效应。ROS在与细胞生长相关的信号传导途径中扮演着极其重要的角色,例如PI3K/Akt信号通路等[29]。ROS对促进细胞有丝分裂,诱导细胞增殖是至关重要的,在一定浓度范围内,这种促细胞增殖的能力与的ROS水平呈正相关[30]。然而由于肿瘤细胞长期处于ROS高水平的状态,肿瘤细胞的氧化还原体系相对正常细胞更为脆弱,对ROS的调控能力更低,当ROS大量产生时肿瘤细胞受到ROS攻击,比正常细胞更易于死亡[31]。在以往的研究中,都观察到了PAHs和SCCPs对HepG2细胞活度显著的抑制效应[15,32-33]。在本研究中,PAHs和SCCPs以及它们的混合物暴露HepG2细胞24 h后,都能导致细胞活度的显著降低,且联合暴露也引起细胞活度的显著降低。
为了抵抗污染物带来的氧化压力,细胞内氧化/抗氧化系统发生了一系列变化。生物体内的抗氧化剂主要指SOD、CAT和过氧化物酶以及非酶抗氧化剂GSH。在以往的研究中,PAHs暴露后SOD和CAT的活性基本呈现升高的趋势,且GSH也被消耗,从而消除产生的ROS[34]。而在本研究中PAHs引起了CAT活性的升高和GSH含量的降低,但均无统计学意义,另外SOD的活性还呈现轻微的降低趋势,这可能与所用的受试模型以及浓度有关,在以前的一篇文献中PAHs在低剂量时也引起SOD活性的降低[35]。在本研究中,SCCPs暴露以及联合暴露后,SOD活性和CAT活性都大大降低,这也就导致了细胞内ROS不能得到及时清除,在细胞内大量积累。另外PAHs和SCCPs暴露后GSH含量有降低趋势,而联合暴露后GSH含量反而有轻微的升高趋势,推测联合暴露也抑制了GSH消除ROS的过程,导致联合暴露组中ROS的积累量最高。细胞内产生的ROS会攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化形成MDA。而研究结果表明SCCPs暴露引起了MDA含量显著升高,这可能与SCCPs能够诱导过氧化物酶体增殖有关,因为过氧化物酶体增殖通常能够加速脂肪酸β-氧化。然而PAHs和联合暴露并没能引起MDA含量的显著变化。与先前文献报道中PAHs也没能引起砂海螂体内MDA含量显著变化的结果相一致[36]。
总体来说,PAHs、SCCPs和它们的联合暴露都能够干扰HepG2细胞内部的抗氧化系统,破坏抗氧化系统和自由基之间的平衡,使细胞氧化性损伤。PAHs和SCCPs暴露都能引发ROS的产生,两者混合时更加剧了ROS的产生,表现为协同效应。另外,PAHs和SCCPs暴露都能引起SOD酶活性的降低,因此两者混合时共同抑制SOD酶活性,表现为协同效应。而PAHs引起CAT活性升高,SCCPs则显著抑制CAT酶活性,两者联合暴露时CAT酶活性仍然降低,但表现为拮抗效应。另外,PAHs和SCCPs联合暴露对GSH含量和MDA含量的影响也表现为拮抗效应。综上,PAHs和SCCPs联合暴露后,降低了SOD和CAT的活性,GSH也没有被大量消耗,从而导致细胞内ROS不能得到及时清除,造成细胞一系列的损伤变化甚至细胞凋亡。本研究选择了单一浓度的PAHs和SCCPs进行单独和联合暴露,而联合毒性与污染物的浓度范围和混合配比密切相关,因此不同的浓度和配比的PAHs和SCCPs对氧化系统的联合作用需要进一步的研究和确认。

