纳米四氧化三铁吸附水中六价铬后的复合物对HEK293细胞的毒性研究
李专,刘淼,陈明辉,张竹青
1. 吉林大学环境与资源学院,长春130012 2. 吉林省环境监测中心站,长春130011
随着现代社会经济和技术的快速发展,水体污染日益严重,已经成为威胁和制约人类健康和发展的重要因素。重金属污染由于具有潜在性、持久性和富集性,对生态环境和人类健康会产生广泛和严重的危害。其中,铬作为一种重要的工业原料,被广泛地应用于冶金、电镀、染料、皮革制造等行业[1],每年的含铬废物排放量高达4 080万吨,它会以各种化学形态存在于空气、水和土壤中,危害人们的健康并对区域生态体系造成严重的环境污染问题。传统用于去除铬的方法有化学沉淀、离子交换、膜分离和生物絮凝等方法[2-4],但是这些方法操作繁琐、成本高、效率低和且容易造成二次污染。
近年来,磁性纳米四氧化三铁作为一种新型材料越来越受到各国学者的广泛关注,它不仅具备常规纳米材料的比表面积大、反应活性高等优点[5-8],同时结合了四氧化三铁的磁性特征,使重金属的回收利用能够得以简单的实现[9]。因此,这种高效、经济的方法在污水治理行业中已被迅速地产业化。
虽然纳米材料的应用范围十分广泛,但是关于它们对生物和环境的毒性研究并不十分丰富,特别是,纳米粒子对污染物的吸附改变了纳米粒子和污染物各自的性质方面。因此,它们的复合物的对人类和生态系统的毒性可能和单独的污染物和纳米粒子的毒性有所不同。例如,相比于三丁基锡单独作用,三丁基锡/纳米TiO2复合物对鲍鱼胚胎的毒性更大[10]。Chen等[11]研究发现,与单独纳米二氧化钛相比,二氧化钛和葡萄糖联合对小鼠的毒性明显增大。Wang等[12]曾研究过,由于维生素C加速了ZnO纳米粒子的溶解和Zn离子的吸收,维生素C和纳米ZnO颗粒的复合物对上皮细胞和神经干细胞的毒性明显增大。因为协同或抑制效应,直接或间接机制都可以增强或抑制污染物的毒性,因此,纳米粒子和污染物的复合物的生物毒性需要谨慎的评价。近年来,有不少关于纳米粒子毒性的研究。然而,很少有对纳米颗粒/污染物复合物的毒性研究。实际上,纳米颗粒存在于任何地方,并且总是以与环境污染物的复合物形式存在。单个有毒的物质在和纳米颗粒联合后,往往会出现一些不可预知的变化,可能会产生加和、协同或是拮抗作用[13],研究纳米颗粒/污染物复合物的毒性效应,对于评价和预警可能导致的环境风险具有十分重要的意义。
本项研究中,使用纳米四氧化三铁(MNPs)吸附水中的铬离子,由于铬能够特异性地引起肾损伤[14],本实验选用人胚胎肾细胞HEK293作为生物模型,通过测定细胞活力、活性氧含量和细胞摄取量等,评估MNPs/Cr(VI)复合物对HEK293细胞的毒性影响。
1 材料与方法(Materials and methods)
1.1 实验材料
磁性纳米四氧化三铁(球形,99.0%)购自阿拉丁公司,人胚胎肾细胞系HEK293购自中国科学院上海生命科学研究院细胞资源中心,DMEM培养基购自康宁公司(Manassas, VA, USA),胎牛血清(FBS)购自GIBCO公司(Grand Island, NY, USA)。其他试剂均为分析纯,购自北京化工制药厂。
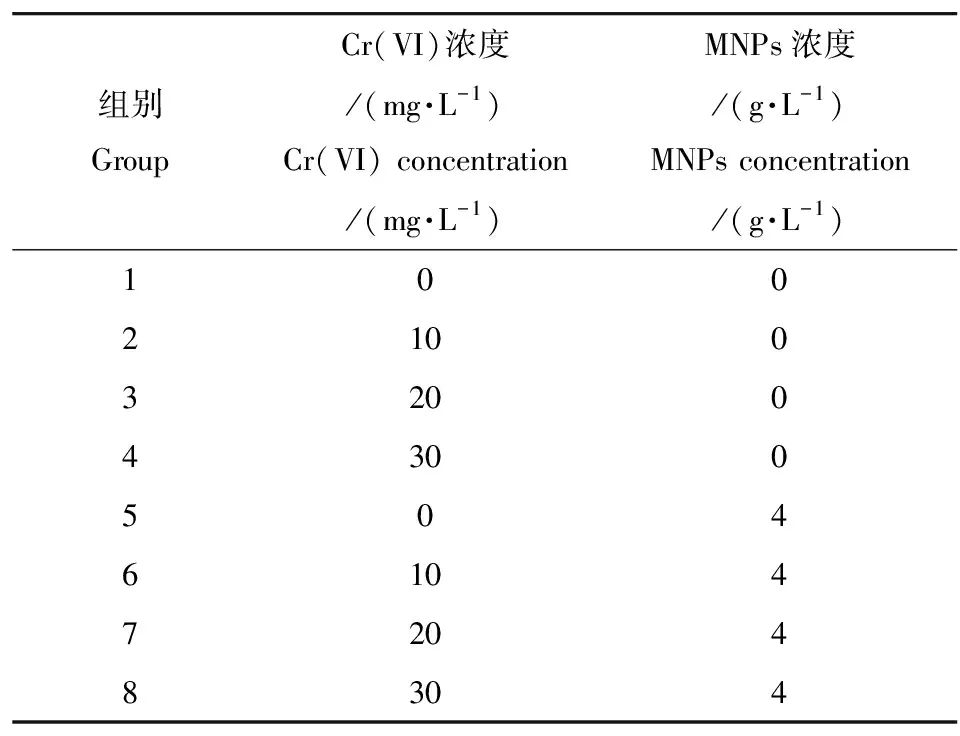
表1 实验组设计Table 1 Experimental group design
注:MNPs表示纳米四氧化三铁。
Note: MNPs stand for magnetite Fe3O4nanoparticles.
1.2 实验设计
本实验选取了人胚胎肾细胞HEK293作为实验对象,其为贴壁细胞,将其培养在含有10%胎牛血清(FBS)、100 U·mL-1青霉素和100 U·mL-1链霉素的改良的DMEM培养基中,在37 ℃、5% CO2的细胞培养箱中培养。实验所用的细胞均为对数生长期的细胞。
将浓度为500 mg·L-1重铬酸钾的储备液分别稀释至0、10、20和30 mg·L-1,用磁性纳米四氧化三铁分别吸附上述浓度的重铬酸钾溶液。吸附实验是通过适量的MNPs(4 g·L-1)与Cr(VI)溶液混合,在50 mL离心管中,用0.1 mol·L-1的HNO3和NaOH溶液调整pH,25 ℃下,150 r·min-1震荡4 h后,用超强磁铁进行分离,弃上清液,用去离子水将沉淀清洗2~3遍,真空干燥,制得粉末状的含有不同Cr(VI)含量的MNPs/Cr(VI)复合物,实验设计浓度请见表1。
取对数生长期的HEK293细胞接种于6孔板中,加入含10%胎牛血清的DMEM培养基,置培养箱(37 ℃、5% CO2)培养,细胞贴壁后,加入1.8 mL新鲜的培养基和0.2 mL的不同浓度的Cr(VI)溶液、MNPs及MNPs/Cr(VI)溶液,染毒时间为24 h。
1.3 测定指标与方法
1.3.1 吸附实验
将浓度为500 mg·L-1重铬酸钾的储备液分别稀释至0、10、20、30、40、50、60、70、80、90和100 mg·L-1,吸附实验步骤同上(1.2),吸附后用超强磁铁吸附MNPs,测定上清液中Cr(VI)含量,Cr(VI)离子的残留液浓度用二苯碳酰二肼分光光度法测定。所有的实验环境温度为(25±1) ℃。
1.3.2 表征
利用扫描电子显微镜(SEM, FESEM 6700F, JEOL, Japan)表征MNPs和MNPs/Cr(Ⅵ)复合物的形貌及粒径。使用动态光散射仪(DLS, Nano ZS90, Malvern, UK)检测MNPs和MNPs/Cr(Ⅵ)复合物的流体动力学大小,使用DLS分析之前样品需要先超声处理。利用X射线衍射仪(XRD, Bruker D8, Germany)进行样品扫描,表征其晶相组成和晶化程度,通过特定衍射峰确定物质的形态。
1.3.3 细胞活力
细胞暴露于各染毒组后,利用带相差的倒置光学显微镜(Leica, DMI3000B, Germany)观察各组细胞的形态,并选取典型成像记录,放大倍数为200倍。利用WST-1细胞增殖及细胞毒性检测试剂盒(碧云天,中国)测定细胞活力。实验步骤按说明书操作。
1.3.4 活性氧含量测定
活性氧检测试剂盒(Reactive Oxygen Species Assay Kit)是一种通过测量荧光探针DCFH -DA水平,测定细胞内ROS含量试剂盒。将细胞暴露于各染毒组后,去除细胞培养基,每孔加入1 mL稀释好的DCFH-DA溶液,37 ℃培养箱中孵育20 min,用PBS洗涤3次,收集细胞,用荧光分光光度计检测。具体实验步骤见说明书(南京建成生物工程研究所)。
1.3.5 纳米颗粒在细胞内的摄取
1.3.5.1 定性
将暴露于各染毒组下的HEK293细胞,弃培养基,PBS洗涤2次,用胰酶消化后,收集细胞,转移至1 mL离心管内离心10 min(2 000 r·min-1),然后固定于2.5%戊二醛(4 ℃),随后固定于1%锇酸中1 h,用PBS洗3次,然后用乙醇逐级脱水并包埋。对包埋好的细胞进行切片,最后在透射电镜下观察拍片(TECNAI G20 TWINW, FEI, USA)。
1.3.5.2 定量
将暴露于各染毒组下的HEK293细胞,分别用PBS洗涤3次,胰蛋白酶消化,收集细胞,3 000 r·min-1离心后,将细胞沉淀物在3 mL硝酸(HNO3)和1 mL的过氧化氢(H2O2)用超声波消化。通过ICP-MS(NexION 350X, USA)中测定细胞中铁和铬的含量。
1.4 统计学分析
所有实验每组做3个平行。实验数据用平均值(Mean)±标准偏差(SD)进行表示,采用SPSS13.0软件进行统计学分析。以P<0.05为差异有统计学意义。
2 结果与分析(Results and analysis )
2.1 吸附实验
饱和吸附量是通过等温线计算得出的。吸附等温线是指一定温度下,达到吸附平衡时,单位质量的吸附剂对吸附物质的吸附量与吸附物质的溶液浓度关系[15]。表征这一平衡有多种数学模型,其中Langmuir模型是最常见的表征吸附剂的吸附容量的数学模型[15],如下公式所示。
式中,qe(μg·mg-1)为平衡吸附量;qm(μg·mg-1)为饱和吸附量;Ce(μg·L-1)为吸附平衡时的浓度;b(L·μg-1)为Langmuir吸附平衡常数。拟合参数见表2。
根据实验数据,绘制了纳米Fe3O4颗粒对溶液中Cr(VI)的Langmuir模型等温吸附曲线(图1),并获得了吸附等温模型相对应的参数数据,吸附数据在Langmuir吸附模型下的相关系数(r2=0.999),在本实验设定的Cr(VI)浓度范围内,纳米Fe3O4颗粒对溶液中重金属Cr(VI)离子的吸附类型属于一种单层的吸附过程,通过等温吸附曲线,可以计算出纳米Fe3O4颗粒对Cr(VI)的单层饱和吸附量qm为13.42 mg·g-1(表2)。

图1 纳米Fe3O4颗粒对Cr(VI)的Langmuir模型等温吸附曲线注:qe为平衡吸附量;Ce为吸附平衡时的浓度。Fig. 1 Langmuir model isothermal adsorption curve of Cr(VI) with Fe3O4 nanoparticlesNote: qe stands for the equilibrium adsorption capacity; Ce stands for the equilibrium concentration.
2.2 表征
纳米材料的尺寸、形态及化学成分是纳米毒性研究的重要特征[16]。MNPs和MNPs/Cr(VI)颗粒大小一致,分布均匀,单分散性好,颗粒均呈球形,平均粒径为10~20 nm。MNPs和MNPs/Cr(VI)在培养基中的流体动力学直径分别为216 nm、512 nm(表3)。纳米颗粒在溶液中的直径远大于干燥时的直径,这是由于颗粒在溶液中容易聚团导致[17-19]。
利用X射线图谱分析了纳米Fe3O4晶体材料的物相组成(图2c)。MNPs样品在2θ为30.1°、35.6°、43.2°、56.9°和62.6°处均具有明显的特征峰,这些特征峰的位置分别对应Fe3O4反尖晶石结构的(220)晶面、(311)晶面、(400)晶面、(511)晶面以及(440)晶面。通过软件Jade6.0检索分析,MNPs样品的特征峰位置和强度均与JCPDS标准卡片NO.19-0629四氧化三铁的衍射峰位置相一致,归属于反尖晶石结构。与Cr(VI)反应后,纳米Fe3O4峰强度显著下降。同时,在反应介质中检测到Fe2O3和(Fe0.6Cr0.4)2O4颗粒。证明了MNPs/Cr(VI)复合物的形成。
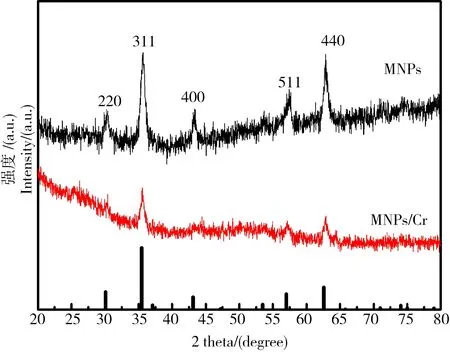
图2 MNPs和MNPs/Cr(VI)的X射线图Fig. 2 Characterization of MNPs and MNPs/Cr(VI) adducts by XRD

参数 Parameterqm/(μg·mg-1)b/(L·μg-1)r2数值 Value13.421.420.999
注:qm表示饱和吸附量;b是Langmuir吸附平衡常数;r2是模型相关系数。
Note:qmstands for the saturated adsorption capacity;bstands for the Langmuir equilibrium constant;r2stands for the correlation coefficient.

表3 MNPs和MNPs/Cr(VI)复合物的表征Table 3 Characterization of MNPs and MNPs/Cr(VI) adducts

图4 细胞活力测定结果注: *表示与对照组差异显著,a、b、c表示MNPs/Cr(Ⅵ)与对应浓度的Cr(VI)组差异显著,P<0.05。Fig. 4 Cell viability assessment by quantifying mitochondria dehydrogenase activityNote: Significant differences are indicated by * vs control; significant differences are indicated by a, b, c between MNPs/Cr(Ⅵ) group and the corresponding Cr(VI) group without MNPs; P<0.05.
2.3 细胞活力
利用光学显微镜对各染毒组处理后的HEK293细胞进行了细胞形态学比较(图3),空白对照组的细胞均贴壁生长,形态饱满,呈规则的多角棱形,边界清晰、排列整齐、大小均一,胞质清透,且细胞密度较大,细胞间间隙较小。Cr(VI)处理后的细胞,细胞数量有一定程度的降低,并且随着Cr(VI)浓度的增大,细胞的数量逐渐减少,细胞形态特异性发生了改变,呈现出胞体发亮,收缩,逐渐失去贴壁性,有部分漂浮死亡的现象,细胞密度降低。而且Cr(VI)浓度越高,这些变化越为明显。相比之下,用MNPs及MNPs/Cr(VI)处理的细胞和对照组相比,细胞表面可观察到少量的纳米颗粒,细胞形态学特征无显著差异,细胞呈单层贴壁成长,形态呈伸展的多角棱形,细胞形态均匀饱满、排列整齐、细胞间隙较小,细胞密度较空白组并未发生显著改变,也未发现大量脱落的悬浮细胞。只是随着MNPs/Cr(VI)浓度加大,细胞表面颜色加深,这可能是由于MNPs及MNPs/Cr(VI)附着于细胞表面导致。MNPs/Cr(VI)复合物诱导的毒性远低于Cr(VI)。因此,我们推断,与游离Cr(VI)相比,MNPs/Cr(VI)可能导致的细胞毒性较小。
为了验证这一观点,本实验选择通过测定线粒体脱氢酶的活性来确定细胞的活力。细胞活力的测定结果见图4。和细胞形态观测结果相似,与对照组相比,Cr(VI)处理后的细胞活力浓度依赖性降低,Cr(VI)处理后的各组细胞活性分别降低至81.2%、73.7%和55.3%。暴露于MNPs下细胞活力为86.2%,与对照组相比活性略有下降。暴露于MNPs/Cr(VI)复合物后的各组细胞活力分别为85.1%、83.6%和81.4%,与对照组相比,细胞活性略有下降;与MNPs组比较,细胞活性无显著性差异;与对应浓度Cr(VI)作用的细胞相比,MNPs/Cr(VI)作用的细胞活性均显著升高。同时,细胞活性没有随着MNPs/Cr(VI)中Cr(VI)浓度的增加而下降;这说明MNPs/Cr(VI)复合物性质比较稳定,没有大量的Cr(VI)溶出。同时可以推断,MNPs及MNPs/Cr(VI)复合物对细胞的毒性影响很小。
2.4 活性氧测定
活性氧含量是纳米颗粒诱导细胞毒性的最常见评价手段之一[20-21]。当细胞受到外界刺激后,体内的ROS会明显上升,过量的ROS会导致氧化应激,产生氧化损伤。结果显示(图5):和对照组相比,在Cr(VI)的作用下,细胞的ROS水平明显上升,且具有浓度依赖性关系;与各浓度Cr(VI)组别相比,对应浓度组的MNPs/Cr(VI)复合物处理后的HEK293细胞的ROS水平显著降低。和单独MNPs组相比较,各浓度MNPs/Cr(VI)复合物组的ROS水平没有显著差异。

图5 各处理组细胞的ROS活性注: *表示与对照组差异显著,a、b、c表示MNPs/Cr(Ⅵ)与对应浓度的Cr(VI)组差异显著,P<0.05。Fig. 5 ROS generation in HEK293 cells from different treatment groupsNote: Significant differences are indicated by * vs control; significant differences are indicated by a, b, c between MNPs/Cr(Ⅵ) group and the corresponding Cr(VI) group without MNPs; P<0.05.
2.5 纳米颗粒在细胞中的摄取
为了进一步评估细胞毒性,利用透射电镜观察MNPs和MNPs/Cr(VI)复合物在HEK293细胞中的整个内化过程(图6)。由图6观察到HEK293细胞的细胞质内,仅有极少量的MNPs及MNPs/Cr(VI)颗粒,颗粒位于质膜附近的囊泡之中;颗粒没有出现在细胞核内和线粒体附近。与空白组比较,Cr(VI)刺激下的细胞形态变形,细胞膜破裂、细胞质溢出[22]。而MNPs组和MNPs/Cr(VI)组的细胞形态基本完整,在亚细胞水平上没有发现明显的细胞损伤。因此推断,纳米颗粒可能是以非损伤细胞的内吞作用进入细胞内的。
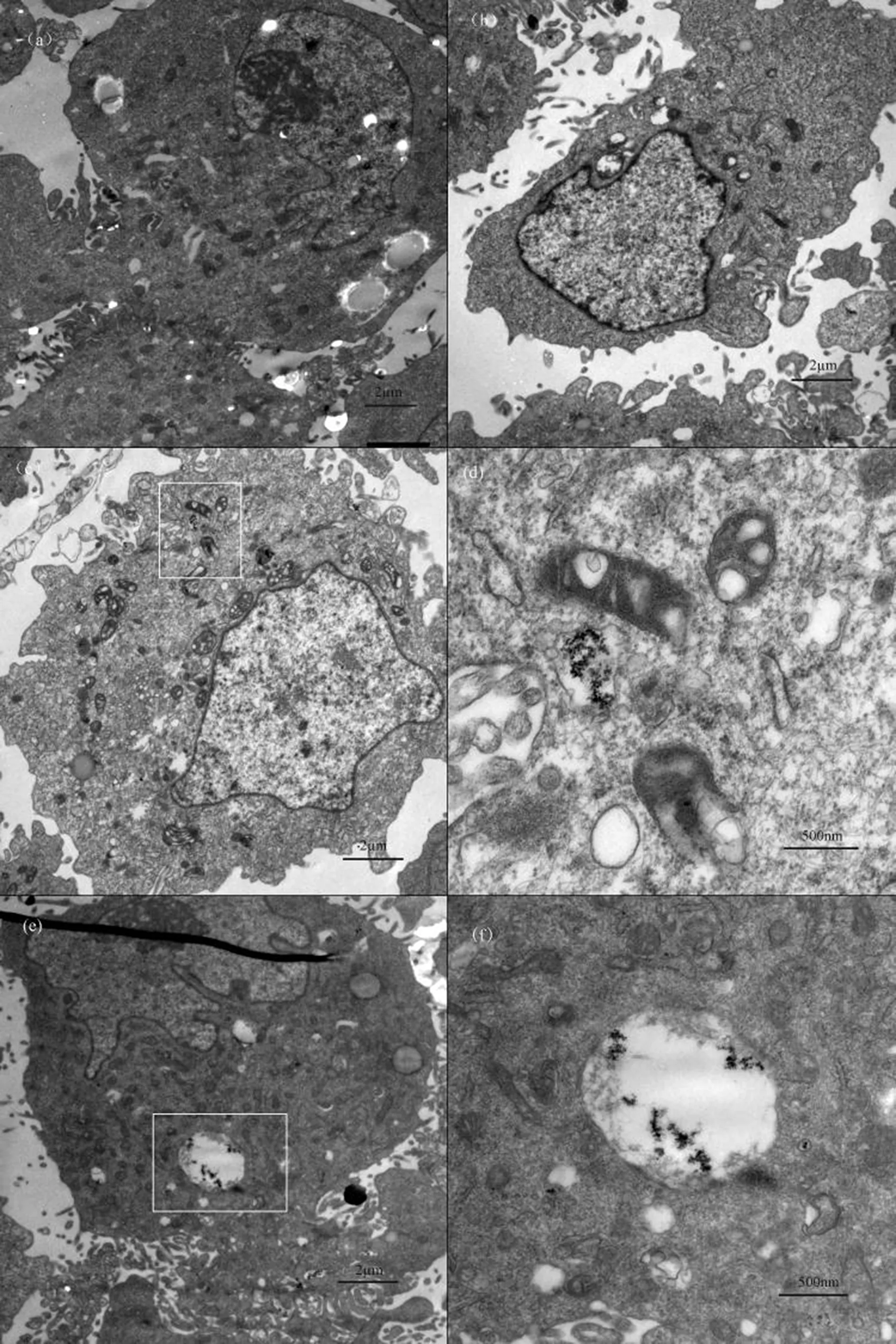
图6 透射电镜下纳米颗粒在HEK293细胞的定位注: (a) 对照组;(b) Cr(VI);(c) MNPs;(e) MNPs/Cr(VI)复合物;(d)和(f)是(c)和(e)的放大图。Fig. 6 Electron micrograph of MNPs and MNPs/Cr(VI) adducts before and after uptake into HEK293 cellsNote: TEM images of HEK293 cells from group (a) control, (b) Cr(VI), (c) MNPs, and (e) adducts; (d) and (f) are enlarged from (c) and (e).
为了量化MNPs和MNPs/Cr(VI)在细胞中的摄取,用ICP-MS测定细胞内的金属含量。经MNPs和MNPs/Cr(VI)复合物处理后的细胞,铁和铬含量如图7~8所示,细胞内检测出的铁和铬元素,是细胞摄取了MNPs和MNPs/Cr(VI)复合物导致的;与透射电镜观察结果一致,进入细胞的MNPs和各浓度组MNPs/Cr(VI)颗粒分别为总添加量的1.1%、0.65%、0.72%和0.58%,MNPs/Cr(VI)组在细胞中检测到的Fe含量较MNPs组更低,说明细胞对MNPs/Cr(VI)的摄取量比MNPs组更少。从铬在细胞内的摄取量的结果分析,MNPs/Cr(VI)复合物比较稳定,没有出现大量的Cr(VI)溶出。
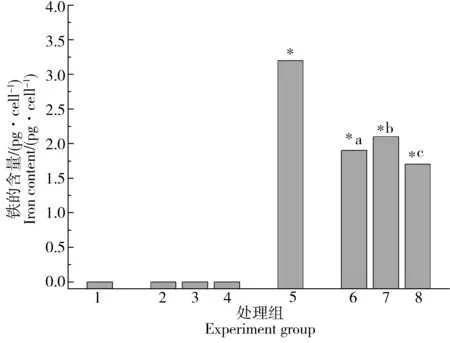
图7 MNPs和MNPs/Cr(VI)复合物处理后细胞内的铁含量注: *表示与对照组差异显著,a、b、c表示MNPs/Cr(Ⅵ)与对应浓度的Cr(VI)组差异显著,P<0.05。Fig. 7 Cell uptake of iron after being treated with MNPs and MNPs/Cr(VI) adductsNote: Significant differences are indicated by * vs control; significant differences are indicated by a, b, c between MNPs/Cr(Ⅵ) group and the corresponding Cr(VI) group without MNPs; P<0.05.
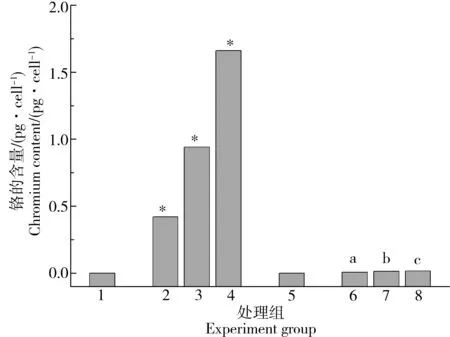
图8 MNPs和MNPs/Cr(VI)复合物处理后细胞内的铬含量注: *表示与对照组差异显著,a、b、c表示MNPs/Cr(Ⅵ)与对应浓度的Cr(VI)组差异显著,P<0.05。Fig. 8 Cell uptake of chromium after being treated with MNPs and MNPs/Cr(VI) adductsNote: Significant differences are indicated by * vs control; significant differences are indicated by a, b, c between MNPs/Cr(Ⅵ) group and the corresponding Cr(VI) group without MNPs; P<0.05.
3 讨论(Discussion )
体外毒性评估是纳米毒理学的重要评估工具。本研究使用人类胚胎肾细胞HEK293作为研究对象,评估MNPs/Cr(VI)复合物诱导细胞毒性的能力。细胞活力实验结果说明:MNPs和MNPs/Cr(VI)复合物并未导致细胞形态和密度的显著改变,在MNPs的吸附下,MNPs/Cr(VI)复合物显著改善了Cr(VI)诱导的破坏效应。这是Cr(VI)离子累积水平降低所产生的结果。该结果同时证明了MNPs/Cr(VI)复合物对HEK293细胞没有显著的细胞毒性。
氧化应激是细胞毒性最重要的机理之一[23]。众所周知,氧化剂会通过干扰氮代谢来抑制细胞生长,Cr(VI)是一种强大的氧化剂,能够与化合物发生氧化还原反应直接产生ROS,同时也可以与巯基(-SH)结合,消耗各种抗氧化物(如超氧化物歧化酶SOD,谷胱甘肽GSH等)间接产生ROS,引起氧化应激,导致氧化损伤[24]。产生的ROS将扰乱氮代谢抑制细胞生长。细胞毒性通常是来自颗粒毒性和氧化损伤[25-26]。因此,细胞活力的降低可能是纳米颗粒与代谢中间体(如H2O2或H+)相互作用的结果[27]。本研究的结果表明,经MNPs处理后,显著降低了Cr(VI)对HEK293细胞诱导产生的破坏作用。同时,MNPs/Cr(VI)复合物没有引发细胞的氧化损伤。Heike等[28]曾研究过,纳米钯/磁性铁对选定的哺乳动物和鱼细胞系的活力几乎没有产生影响,也没有引发氧化损伤,这一研究结果与本项研究的结果基本一致。
纳米颗粒在细胞内的摄取与细胞毒性直接相关,只有极少的MNPs和MNPs/Cr(VI)复合物被内化,并且这些颗粒都积聚在细胞质内,并没有进入到细胞核。大多数的颗粒都附着在细胞膜表面,这些颗粒在成像之前很容易被PBS洗掉。纳米颗粒通过内吞的形式被细胞吸收,内吞作用主要分为3种类型:吞噬作用、吞饮作用、受体介导的内吞作用。其中最常见的是非特异性途径的吞饮作用,包括胞饮作用和巨胞饮作用,通常以质膜内陷形成囊泡,将颗粒物包裹运送至细胞内的方式实现。当细胞培养液中加入MNPs,聚集、沉淀、黏附在细胞周围的纳米颗粒逐渐被细胞质膜包围、内陷,使包有纳米颗粒的质膜在胞内与细胞膜完全分离,形成质膜包被的囊泡,即初级溶酶体。尽管内吞作用的影响因素很多,包括纳米颗粒粒径、浓度、细胞种类以及数量等因素,然而纳米颗粒的大小,被普遍认为是影响细胞摄取纳米颗粒的最主要因素[30-31。由于MNPs/Cr(VI)复合物的水合粒径尺寸相对MNPs较大,当细胞暴露于MNPs/Cr(VI)时,细胞膜需要更多努力来启动内吞作用。因此,与MNPs相比,MNPs/Cr(VI)复合物在细胞中的数量更少。
由于纳米颗粒的定位对细胞毒性起着很重要作用,存在于线粒体和细胞核中的纳米材料可能会对细胞正常功能产生干扰。然而,纳米材料在细胞中定位的最常见部位是内涵体和溶酶体[32-33]。近年来有不少相关研究报道,例如,纳米银颗粒只进入细胞的内涵体和溶酶体,其对细胞没有产生明显毒性[34]。本项研究表明,只有少量的MNPs/Cr(VI)纳米颗粒从细胞外液中被内吞,这些细胞外液滞留在消化液泡中,通过正常途径代谢并且不会导致细胞凋亡[35]。
在本研究的实验浓度和作用时间下,磁性纳米四氧化三铁吸附Cr(VI)后的复合产物MNPs/Cr(VI)对HEK293细胞无明显毒性效应。只有极少量的MNPs/Cr(VI)复合物能够进入细胞内,这些颗粒是从细胞外通过内吞作用嵌入囊泡中进入细胞,同时,MNPs/Cr(VI)复合物没有进入细胞核中,因此,没有导致细胞凋亡。
本研究结果对纳米技术在环境修复中的应用有着重要的意义。由于磁性纳米四氧化三铁具有体积小、比表面积大、反应活性高、易回收利用等特点,相比传统的废水处理方法,使用磁性纳米四氧化三铁处理环境污染物具有处理效率高、成本低、可再利用等优点。本项研究表明,MNPs/Cr(VI)在一定条件下性质较为稳定,且对HEK293细胞没有明显毒性效应,本实验的研究结果为深化了解MNPs及其重金属复合物对环境的影响提供了实验依据和参考价值。

