磷酸三(1,3-二氯-2-丙基)酯对L-02肝细胞氧化应激及凋亡损伤机制
夏沪彬,陈超,李辉,*,张运超,王平,庄金龙,安澈,鲁军,#
1. 华东理工大学 资源与环境工程学院,上海 200237 2. 华东师范大学 上海市城市化生态过程与生态恢复重点实验室,上海 200062 3. 华东理工大学 生物工程学院,上海 200237
随着多溴联苯醚(PBDEs)和六溴环十二烷(HBCD)的逐步禁用,作为新兴的阻燃剂材料,有机磷酸酯阻燃剂(OPFRs)的使用频率和用量大大增加[1]。据统计,我国有机磷阻燃剂在2007年产量达到了70 000吨,并且以15%速率持续增长[2]。磷酸三(1,3-二氯-2-丙基)酯(TDCPP)是最常见的一种有机磷酸酯阻燃剂,通过非化学键合的方式添加到各种使用材料中,在生产、消费的环节中,它们都可能释放到水体、气体和土壤环境介质中。TDCPP一般作为阻燃剂添加到聚氨酯泡沫、聚氯乙烯、聚酯纤维、环氧树脂等材料中,这导致家庭纺织品、家具、装修材料等成为室内阻燃剂重要污染源[3],在对美国各州抽取的125户室内气体样品检测结果中发现,TDCPP检出率达到100%,检出平均浓度为2.021 mg·g-1[4]。随着这些材料的废弃、焚烧,TDCPP可能会进入到水体和室外空气中,从中国的黄海、东海海域采集的水体样本中检测出TDCPP存在,均值浓度达到109.28 ng·g-1[5],有研究报道表明OPFRs有很大一部分可能从大气中通过降水或降雪进入土壤,学者在德国大学校园采集的土壤样品中检测到OPFRs,并且不同月份的土壤样品中的OPFRs的含量差别较大,并且雨水和降雪中TDCPP浓度为46~100 ng·L-1,但在土壤中TDCPP的浓度低于检出限,这可能和天气条件有关[6]。环境介质中TDCPP广泛存在,然后通过生物富集进入生物体,在瑞典深海湖中的鲈鱼和中国南方珠江三角洲地区采集的淡水鱼肌肉组织样本检测出TDCPP的存在,高达140 ng·g-1脂重和251 ng·g-1脂重[7]。研究表明甚至在代谢物、人体脂肪、精液以及母乳中有检出[8]。
目前,国内外学者在TDCPP的毒理学方面已开展了一些研究,发现其具有内分泌干扰毒性、生殖发育毒性、神经毒性以及潜在致癌性[9-11],但对肝毒性方面研究明显不足。研究显示,TDCPP可经皮和经口途径进入生物体,并随血液流动扩散到肺、肝脏以及肾脏等人体器官[12]。经TDCPP暴露后会影响大鼠肝脏,导致其脏器重量明显增加,并且在慢性暴露实验中,通过喂食含有一定浓度的TDCPP的饲料发现其可诱发小鼠肾脏、睾丸和肝脏等组织产生肿瘤[13]。Crump等[14]研究了TDCPP和TCPP对鸟类肝细胞的影响,结果表明肝细胞的外源化合物代谢、脂肪代谢易受TDCPP和TCPP暴露的影响,并且CYP3A37基因在培养的鸡胚肝细胞中对TDCPP暴露具有高度敏感性。利用稀有鮈鲫探究TDCPP的毒性过程中发现,鱼类肝脏组织中的超氧化物歧化酶和谷胱甘肽过氧化物酶受到TDCPP的暴露影响,活性受抑制。在Sprague-Dawley大鼠的暴露实验中发现,肝脏中代谢(细胞色素P450-3A1、CYP3A1)和甲状腺激素(TH)清除(UGT1A6)相关基因的mRNA和蛋白表达水平有显著依赖性增加,2个高剂量组中观察到肝重量的显著增加,并且肝细胞中TRβ、TTR、UGT1A6和CYP3A1的基因和蛋白表达受到明显的影响[15]。以上报道中均发现TDCPP对动物肝脏能够造成影响,但文献中并未对其毒性作用及凋亡机制进行具体研究。且在动物和人体上存在种间上的差异。因此利用人体肝细胞为模型,研究其细胞和分子水平上TDCPP其对肝细胞毒性,不仅具有重要的学术理论价值,对于全面评价TDCPP的环境与人体健康风险具有重要的参考研究意义。
1 材料与方法(Materials and methods)
1.1 细胞系
人正常肝细胞HL-7702(L-02)细胞,由华东理工大学生物反应器工程国家重点实验室惠赠。
1.2 实验主要仪器与试剂
酶标仪(TECAN GENios, Switzerland),荧光酶标仪(FLX800,BioTek公司,USA),流式细胞仪(FACSCalibur, BD公司,USA),荧光定量PCR仪(LightCycler480II, Roche公司,Switzerland),荧光显微镜(Nikon Eclipse 80i, Japan),水平电泳仪(HE-120,上海天能科技有限公司),超净台(BHC-1300ⅡA/B2,上海苏净实业有限公司)。
TDCPP(纯度>96%,上海泰坦科技股份有限公司),高糖培养基DMEM(gibco公司),胎牛血清(gibco公司),荧光定量PCR试剂盒(北京天根生化科技有限公司),青链霉素(上海生工生物工程股份有限公司),胰蛋白酶(北京索莱宝科技有限公司),MTT(北京索莱宝科技有限公司),Annexin V -FITC/PI凋亡试剂盒(北京索莱宝科技有限公司),活性氧检测试剂盒(北京索莱宝科技有限公司),Beta actin mouse monoclonal抗体(Proteintech Group公司),Bax rabbit polyclonal抗体(Proteintech Group公司),Bcl-2 rabbit polyclonal抗体(Proteintech Group公司),Caspase-3 rabbit polyclonal抗体(Proteintech Group公司),N-乙酰半胱氨酸(NAC, 纯度99%,上海阿拉丁试剂有限公司),其余试剂为分析纯。
1.3 细胞培养与TDCPP溶液配制
L-02细胞接种含10%胎牛血清和1%青链霉素的培养基中,用25 cm2无菌的细胞培养瓶培养,置于CO2培养箱中,37 ℃、5% CO2条件下生长。24 h后,37 ℃的磷酸盐缓冲液(PBS)轻缓漂洗细胞2次,再加5 mL培养液继续培养,每隔2日更换培养液。显微镜下观察到细胞生长达70%~80%时,用0.25%含EDTA胰酶消化,4 ℃条件下1 000 r·min-1离心5 min后传代。
TDCPP溶液配制:称取430.9 mg TDCPP于10 mL容量瓶中,二甲基亚砜(DMSO)定容,得到100 mmol·L-1母液,4 ℃储备,临用前,用完全培养基依次配制成100、50、25、5、1 μmol·L-1的TDCPP溶液。以含1‰ DMSO的完全培养基作为对照组。
1.4 细胞相对活力检测
取一瓶对数生长期细胞,PBS漂洗细胞2次,胰蛋白酶消化后制成浓度约为1×104个·mL-1的细胞悬液,再转移至50 mL无菌离心管摇匀,均匀接种于96孔培养板中(6×10排孔加200 μL细胞悬浮液,孔板周围一圈加入200 μL PBS),每取加6孔摇匀一次。于37 ℃、5% CO2恒温培养箱内培养过夜(16 h)。弃液,加入含100、50、25、5、1、0 μmol·L-1的TDCPP污染物培养基,每个浓度设5个重复孔,并设置调零孔,继续培养1、2、3 d。培养结束后,每孔加入20 μL MTT液(5 g·L-1),继续培养4 h。吸去上液,加150 μL DMSO至每孔中,37 ℃条件下振荡10 min后于用酶标仪490 nm处检测各孔吸光度值(OD),3次重复,并计算其平均值,并按公式(1)计算细胞相对活力。
RAC(%)=(OD浓度-OD调零)/(OD对照-OD调零)×100%
(1)
RAC为细胞相对活力;OD浓度为实验组吸光度值;OD调零为调零组吸光度值;OD对照为对照组吸光度值。
1.5 细胞凋亡检测
利用Annexin V -FITC/PI双染标记,流式细胞术(flow cytometry, FCM)来对细胞凋亡进行检测。当细胞密度生长达到70%~80%,胰蛋白酶消化后制成浓度约为1×105个·mL-1的细胞悬液,接种于6孔板中,每孔加入2 mL,在37 ℃、5% CO2培养箱内培养过夜(16 h),吸去旧液,加入含不同浓度的TDCPP污染物的完全培养基以及NAC(1 mmol·L-1)和NAC(1 mmol·L-1)+100 μmol·L-1TDCPP的完全培养基,对照组为含1‰ DMSO的完全培养基,设置3复孔于每组浓度。于37 ℃、5% CO2的培养箱内培养24 h后,弃旧培养基,用PBS清洗细胞2次,每孔加入0.25%不含EDTA胰蛋白酶400 μL,将消化细胞收集于离心管中,1 000 r·min-1离心5 min,弃上清,再用1 mL PBS洗细胞2次,然后弃上清,每管加入350 μL Binding Buffer悬浮细胞,加入5 μL的Annexin V-FITC染液,室温避光条件下孵育15 min,再加入10 μL PI染液,室温下避光染色5~10 min,1 h内用流式细胞仪进行凋亡率检测,使用Flowjo 7.6.1软件对结果进行分析。
1.6 细胞活性氧水平(ROS)测定
取对数生长期的细胞,胰酶消化将细胞制成分散的单细胞悬液,调整细胞密度至5×104个·mL-1,然后接种于96孔培养板中,在每孔中加入100 μL细胞悬液,在37 ℃、5% CO2条件下培养过夜,弃液,将含不同浓度的TDCPP污染物完全培养基加入黑孔板,阳性对照组按活性氧试剂盒说明1:1 000稀释使用(Positive组),阴性对照组加入为含1‰ DMSO的完全培养基,每组5复孔。在37 ℃、5% CO2的培养箱内培养24 h后,移去上清液,每孔加入100 μL DCFH-DA应用液(10 μmol·L-1),37 ℃条件下避光孵育25 min后,去DCFH-DA染液,用无血清培养液清洗细胞3次,然后加入100 μL PBS,用荧光酶标仪(Ex: 480 nm, Em: 538 nm)测定荧光强度,通过荧光强度反映细胞内的氧自由基水平。
1.7 实时荧光定量PCR(qRT-PCR)
细胞总RNA提取:接种于6孔板中的细胞经过不同浓度的TDCPP暴露后,按试剂盒说明书方法提取细胞总RNA,并用Nanodrop2000C型分光光度计检测RNA纯度和含量。
cDNA合成:按天根公司试剂盒说明书合成cDNA。
目的基因检测:按表1加qRT-PCR反应体系,定量的相关引物序列如表2,以β-actin作为内参基因。
1.8 蛋白免疫印迹法(Western Blot)
收集不同浓度暴露后的细胞,使用细胞裂解液提取总蛋白,根据BCA法测得的蛋白浓度确定上样体积(以上样量为50 μg计算体积),垂直电泳后将蛋白电转至不同的硝酸纤维素膜上,5%的脱脂奶粉封闭2 h,分别加Bax、Bcl-2或caspase-3兔源多克隆抗体,4 ℃条件下封闭过夜,TBST(三羟甲基氨基甲烷吐温)缓冲液晃洗3次,每次15 min。然后加入鼠抗兔IgG二抗,常温晃洗1 h,TBST洗3次,每次10 min。以β-actin为内参对照,以红外激光成像系统扫描和分析图像,最后计算蛋白相对表达量。
1.9 数据分析方法
采用SSPS 22.0软件(SPSS Inc.)对实验数据进行方差分析和回归分析。采用ANOVA方法分析实验暴露组与空白对照组之间的差异,P<0.05、P<0.01表示差异显著。数据分析结果表示方式为均值±标准误差。

表1 实时荧光定量PCR反应体系Table 1 Components of real time qPCR

表2 研究中的目的基因与引物序列Table 2 Genes and primers used in this study
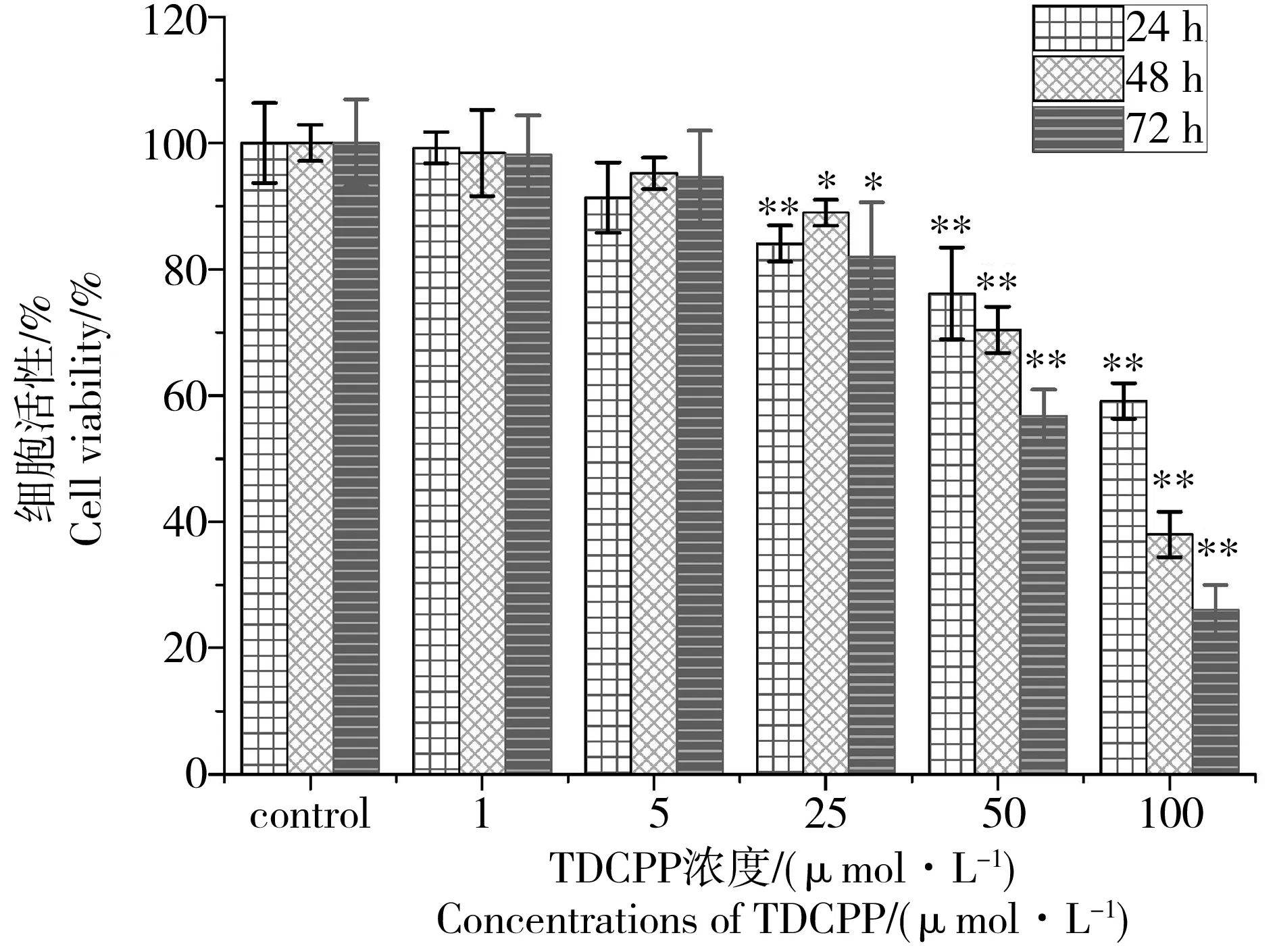
图1 磷酸三(1,3-二氯-2-丙基)酯(TDCPP)对L-02细胞生存率的时间、剂量影响效应注:数据表达采用均值±标准误差,n=6;*P<0.05、** P<0.01,与对照组比较。Fig. 1 Dose and time-dependent toxic effects of tris(1,3-dicholor-2-propyl)phosphate (TDCPP) on cell viability of L-02 cellsNote: All data were expressed as mean±SEM, n=6; *P<0.05, **P<0.01, compared with control.
2 结果(Results)
2.1 TDCPP对人体肝细胞相对活力影响
如图1所示,有机磷酸酯类阻燃剂TDCPP能影响L-02肝细胞存活率,并且细胞存活率与TDCPP存在时间、剂量效应关系。随着染毒浓度从0 μmol·L-1向100 μmol·L-1的增加,染毒24 h的L-02细胞的存活率相对于对照组降至59.2%±2.8%,染毒48 h的L-02细胞的存活率相对于对照组降至38.0%±3.6%,染毒72 h的L-02细胞的存活率相对于对照组降至26.1%±3.9%。用SSPS22.0的线性回归分析,计算得到相应的回归方程y=a×x+b中a和b常量值,再将x(%)代表的存活率值设置为50,最后计算得到24 h、48 h、72 h的半数致死浓度(LC50)分别为116.56 μmol·L-1、81.89 μmol·L-1、65.11 μmol·L-1。对细胞活存活率影响表明TDCPP具有细胞毒性。
2.2 TDCPP影响人体肝细胞的凋亡
如图2所示,TDCPP影响L-02细胞凋亡,使其凋亡率增加,且存在剂量效应关系。L-02细胞随着染毒浓度增加其凋亡率均呈现递增的趋势,在低浓度1 μmol·L-1、5 μmol·L-1,细胞的早期凋亡率及晚期凋亡率增加不明显。但在25 μmol·L-1时,细胞早期凋亡率增加,与对照组差异显著(P<0.01),细胞晚期凋亡率减少,50 μmol·L-1暴露条件下,细胞早期凋亡率和晚期凋亡率均显著增强,在100 μmol·L-1TDCPP染毒总凋亡率相对对照组具有显著性差异,高达25.58%±1.612%。NAC组总凋亡率为2.30%±0.110%。NAC+100 μmol·L-1组总凋亡率为9.10%±0.631%,相对于100 μmol·L-1TDCPP总凋亡率明显减少。但总体上看,在TDCPP暴露24 h条件下,L-02细胞的凋亡率明显增强。

图2 Annexin V-FITC/PI法检测暴露于TDCPP的细胞凋亡率注:A为对照组;B为1 μmol·L-1组;C为5 μmol·L-1组;D为25 μmol·L-1组;E为50 μmol·L-1组;F为100 μmol·L-1组;G为NAC+100 μmol·L-1组;H为NAC组;NAC为N-乙酰半胱氨酸。Fig. 2 Annexin V-FITC/PI assay of the apoptosis ratio of TDCPP-exposed L-02 cellsNote: A, control; B, 1 μmol·L-1; C, 5 μmol·L-1; D, 25 μmol·L-1; E, 50 μmol·L-1; F, 100 μmol·L-1; G, NAC+100 μmol·L-1; H, NAC; NAC stands for N-acetylcysteine.
2.3 TDCPP影响细胞活性氧水平
生物在代谢过程中会产生ROS这一中间产物,它具有重要的生理功能。在有害刺激条件下过量产生时,可造成机体细胞不同程度的氧化损伤。荧光探针DCFH-DA,是目前应用最为广泛的一种检测ROS的方法。本研究发现:24 h暴露后,细胞活性氧水平开始随着TDCPP暴露浓度的增加而递增,从5 μmol·L-1开始,ROS水平的变化与对照组相比具有显著性差异(P<0.05),在100 μmol·L-1时达到一个最高水平,为对照组2.07±0.07倍,差异显著(P<0.01),这可能与高剂量刺激造成大量细胞氧化应激有关。
2.4 TDCPP影响p53凋亡信号通路基因表达
p53凋亡信号通路指的是p53介导的线粒体凋亡途径:由于一些外界刺激,通过DNA损伤等引起细胞内p53蛋白水平升高,然后激活下游的线粒体凋亡途径(细胞凋亡3条主要通路之一)中关键基因(基因包括p53、Bax、Bcl-2、Apaf-1、caspase-9、caspase-3等)的转录,诱导细胞凋亡[17]。p53凋亡信号通路是凋亡过程中重要的一条通路。
研究结果表明,随着TDCPP浓度增加可以促凋亡基因Bax的表达,抑制抗凋亡基因Bcl-2的表达,Bax/Bcl-2随着暴露浓度增加而增加。此外,TDCPP处理组caspase-3、caspase-9、p53和Apaf-1的表达也增强(图4)。p53基因是调控细胞增殖、细胞生长、DNA修复和凋亡相关基因,随着暴露浓度增加p53mRNA的表达增强,在50 μmol·L-1、100 μmol·L-1表达量为对照组4.25±0.439,5.84±0.107倍,这可能部分解释了本研究中TDCPP诱导的细胞凋亡率改变。caspase-9是凋亡执行基因caspase-3的上游,其表达量(表4)也随着TDCPP浓度增加而增加。基因caspase-3的作用是作为凋亡最终的执行基因,在25 μmol·L-1暴露条件下暴露24 h后,其mRNA相对对照组表达量达到4.38±0.633倍。

图4 不同浓度TDCPP暴露影响L-02细胞凋亡相关基因表达注:将β-actin作为内参基因;数据结果为与对照组的比值;n=3。Fig. 4 Effects of different concentrations of TDCPP on L-02 cell apoptosis-related gene expressionsNote: take β-actin as a reference gene; the results were relative to the control group and normalized using β-actin mRNA; n=3.
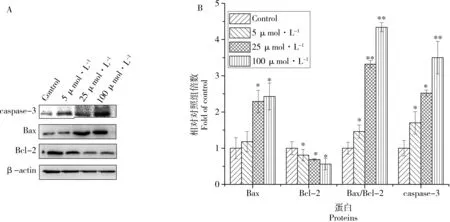
图5 TDCPP影响L-02细胞凋亡蛋白表达(A:蛋白印迹;B:量化)Fig. 5 Effects of TDCPP on the protein expressions related to apoptosis in L-02 cells (A: Western blot; B: quantitation of the expressions)

实验组Experiment groups早期凋亡/%Early stage apoptosis/%晚期凋亡/%Late stage apoptosis/%总凋亡/%Total apoptosis/%Control2.42±0.0570.38±0.3322.80±0.2761 μmol·L-13.00±0.0070.29±0.0143.29±0.0215 μmol·L-15.66±0.3251.08±0.3186.74±0.007∗25 μmol·L-18.29±0.12∗∗0.53±0.1068.81±0.014∗50 μmol·L-117.75±1.344∗∗5.74±0.742∗∗23.49±0.601∗∗100 μmol·L-125.30±1.556∗∗0.28±0.05725.58±1.612∗∗NAC+100 μmol·L-18.77±0.278∗0.33±0.4119.10±0.631∗NAC2.16±0.0370.14±0.0162.30±0.110
注:P<0.05、**P<0.01,与对照组比较。
Note: *P<0.05, **P<0.01, compared with control.

表4 不同浓度TDCPP暴露后L-02细胞凋亡相关基因的相对表达量(平均值±标准误差)Table 4 Relative gene expressions in L-02 cell after exposure to different concentrations of TDCPP (mean±SEM)
2.5 TDCPP影响Bax、Bcl-2和caspase-3蛋白表达
Bax、Bcl-2和caspase-3是线粒体凋亡途径中的关键蛋白。如图5所示,L-02肝细胞经不同浓度TDCPP作用24 h后,促凋亡Bax蛋白表达水平随浓度逐渐增加而递增;抗凋亡Bcl-2蛋白表达水平随浓度增加而递减,且与对照组均有显著差异性(P<0.05);此外,Bax/Bcl-2两蛋白间的比值关系是决定细胞凋亡的关键因素,在5 μmol·L-1、25 μmol·L-1和100 μmol·L-1TDCPP作用后,Bax/Bcl-2比值呈现上升趋势,最高为对照组的4.34倍。同样,caspase-3蛋白表达水平也随浓度增加而增加,100 μmol·L-1时为对照组的3.50倍。
3 讨论(Discussion)
肝脏是动物最重要的代谢器官,负责体内多种酶的合成以及外源有害物质的清除,对于维持生物体代谢平衡和消除外源物质毒性具有重要作用。在美国麻省总医院的男性成人[18]和西雅图地区儿童[19]的尿液样品中都检测到TDCPP主要代谢物BDCPP的存在,这表明TDCPP对人体健康有直接影响,并且人体肝脏是其重要的一个作用靶器官。因此研究利用人体正常肝细胞,研究其毒性效应及机制,对肝毒性具有直接的指示作用。Zhang等[20]利用人体肝癌细胞系HepG2/C3A研究TDCPP的半数效应浓度24 h-EC50和72 h-EC50为167.9 μmol·L-1和84 μmol·L-1,Crump等[14]利用禽类原代肝细胞的暴露实验得到的半数致死浓度24 h-LC50为(62.0±37.7) μmol·L-1,本研究中利用MTT实验评估TDCPP对人体正常肝细胞L-02暴露24 h、48 h、72 h的半数致死浓度(LC50)分别为116.56 μmol·L-1、81.89 μmol·L-1、65.11 μmol·L-1,结果表明对于TDCPP暴露的敏感性:禽类原代肝细胞<人体正常肝细胞<人体肝癌细胞。
生物机体广泛存在的一种应激反应叫做氧化应激反应,在引起人类机体损伤中发挥十分重要作用。己有研究显示,当机体组织中氧化与抗氧化调节系统失去平衡,脂质过氧化物含量增加,抗氧化酶活性降低,从而引起氧化应激反应,诱导细胞毒性发生。Zhao等[15]的研究表明,TDCPP暴露通过诱导细胞中ROS的产生,引起氧化应激和炎症反应,进而引起细胞损伤。TDCPP暴露通过影响SH-SY5Y细胞的ROS生产,介导下游凋亡信号通路,引起细胞凋亡,在25、50、100 μmol·L-1时,ROS是对照组的1.3±0.1、2.2±0.1、2.9±0.2倍,凋亡率为7.1%±0.8%、10.3%±0.6%、30.3%±0.2%[21]。本研究中的L-02细胞中ROS水平和细胞凋亡率均与TDCPP的暴露浓度呈现正相关,并且在100 μmol·L-1时为对照组2.07±0.07倍,同时细胞凋亡率也高达25.58%±1.612%,但在加入抗氧化物质NAC时,细胞凋亡率降低,说明TDCPP引起的活性氧是引起细胞凋亡增加的原因。并且在5 μmol·L-1开始才与对照组有显著性差异,这可能由于低浓度时细胞内ROS和自由基清除系统共同维持机体的氧化与抗氧化平衡,低浓度TDCPP对机体没有明显伤害。但是当ROS产生量超过机体本身系统处理的平衡时,机体会刺激形成氧化应激反应,引起组织或细胞内氧化还原信号蛋白质发生氧化性修饰、脂质过氧化、内质网应激、线粒体功能改变、DNA氧化损伤等,进而引发特定信号级联激活,诱导细胞凋亡[22]。线粒体凋亡途径是细胞凋亡的2个主要途径之一,主要特征是细胞色素C渗漏到细胞质中,而细胞色素C由Bcl-2蛋白家族控制,其中促凋亡基因Bax和抗凋亡基因Bcl-2的是2个关键成员,在细胞凋亡调控过程中起着重要的作用,并且细胞色素C可以与Apaf-1相互作用而激活caspase家族,最终导致细胞凋亡[23]。本研究结果表明,TDCPP可以增加促凋亡基因BaxmRNA的表达,抑制抗凋亡基因Bcl-2 mRNA的表达,证明TDCPP的增加激活了线粒体相关的凋亡通路。Bax/Bcl-2是凋亡信号传导的重要参数,利用蛋白印迹法检测蛋白表达结果,随着TDCPP浓度增加Bax/Bcl-2比值也逐渐增大,caspase-3蛋白变化也具有同样变化趋势。p53基因是调控细胞增殖、细胞生长、DNA修复和凋亡相关基因,研究发现p53 mRNA的表达量与TDCPP的暴露浓度呈现正相关,说明TDCPP能够将线粒体相关的凋亡通路中p53通路激活,从而影响细胞凋亡。caspase-9是起始凋亡基因,caspase-3是凋亡执行基因,本研究中TDCPP处理组caspase-3、caspase-9和Apaf-1的表达也明显增强。这也从影响caspase家族基因表达方面解释了本研究中TDCPP诱导细胞凋亡率逐渐增加的现象。
综上所述,TDCPP对人体正常肝细胞L-02细胞活力具有明显抑制作用。此外,TDCPP造成细胞氧化应激反应,引起细胞内ROS水平增加,同时通过影响p53、Bax、Bcl-2、Apaf-1、caspase-3、caspase-9 mRNA的表达,从而激活线粒体凋亡通路,进而诱导细胞凋亡,引起细胞凋亡率增加。本文从细胞、生化和基因水平上系统评估TDCPP对L-02细胞的毒性作用,对TDCPP的环境与人体健康风险评价具有重要意义。
致谢:感谢课题组全体成员在实验研究过程中的帮助与支持。

