2种新烟碱类杀虫剂对秀丽隐杆线虫神经毒性研究
何雪珠,李洪博,胡亚茹,刘馥雯,林森,陆强,林匡飞
华东理工大学资源与环境工程学院,国家环境保护化工过程环境风险评价与控制重点实验室,上海 200237
新烟碱类杀虫剂是目前全世界增长最快,使用最广泛的内吸性杀虫剂,自拜耳公司于1991年推出第一代吡虫啉之后,一系列的新烟碱类杀虫剂相继投入市场[1]。新烟碱类杀虫剂具有类似烟碱吡啶环的特征结构,具有高效、广谱的杀虫活性,与昆虫神经系统后突触乙酰胆碱受体(nAChRs)结合,阻断中枢神经正常传导,进而导致昆虫麻痹、死亡[2-3]。这类杀虫剂具有持久性和水溶性的特性,既能在土壤中富集,又能迁移到水环境中[4]。全球水体和土壤环境中都有检出的报道,同时还有其导致蜜蜂种群数量锐减及对水生生物大型溞、摇蚊、蜉蝣等负面影响的报道[5-7],从而引起了人们对其导致非靶标生物潜在危害的关注[8]。目前,我国对于这类农药的生态毒性研究主要集中在蜜蜂等传粉性昆虫[9],而对其他土壤非靶标生物的毒性作用却知之甚少。因此,研究新烟碱类杀虫剂对土壤非靶标生物的神经毒性的影响,对于该杀虫剂的安全应用具有重大意义。
秀丽隐杆线虫(C.elegans)生活在土壤和间隙水中,具有生命周期短,便于实验室培养,对外部环境变化敏感,全基因组已知等特点,是毒理学研究中推荐的模式生物。目前秀丽线虫的运动行为、摄食行为、生殖水平、寿命等指标已广泛运用于重金属、纳米材料和有机农药的毒性评价中[10-12]。秀丽线虫的神经结构相对简单,但神经细胞体系功能完整,控制神经递质产生、代谢和传递的基因具有高度保守性[13],因此在神经毒性效应评价的应用上具有很大潜力。
本研究将秀丽线虫分别暴露于吡虫啉和呋虫胺农药24 h后,观察其运动行为、摄食行为、乙酰胆碱酶活性,以及乙酰胆碱酶编码基因(ace基因)和金属硫蛋白基因(mtl基因)转录水平的变化,探讨这2种新烟碱类杀虫剂在环境浓度暴露下对秀丽线虫的神经毒性作用,从而为新烟碱类杀虫剂的生态风险评估提供依据。
1 材料与方法(Materials and methods)
1.1 线虫培养与同步化
实验用秀丽隐杆线虫(Caenorhabditiselegans)为N2 Bristol野生型,由国际线虫种质中心(CaenorhabditisGenetics Center,CGC)赠送。秀丽线虫置于涂布OP 50大肠杆菌并过夜培养的线虫生长培养基(NGM)上。配制新鲜的线虫裂解液(质量分数1% NaClO和0.5 mol·L-1NaOH)裂解成熟期线虫,获取同步化虫卵,20 ℃恒温培养48 h,对生长至L4期线虫进行暴露。
1.2 供试药剂及设备
试剂药品:吡虫啉(95%,源叶生物);呋虫胺(96%,麦克林);BCA法蛋白含量测定试剂盒(苏州科铭生物技术有限公司);乙酰胆碱酶活性测定试剂盒(苏州科铭生物技术有限公司);RNAprep pure Micro Kit(天根生化科技(北京)有限公司)和FastQuant RT Kit (with gDNase)(天根生化科技(北京)有限公司);SYBR Green Master Mix(罗氏诊断产品(上海)有限公司);无水乙醇、氯化钠、氯化钾、次氯酸钠等化学药品均为分析纯,购自国药集团化学试剂有限公司。
仪器设备:SZM45B1型体视显微镜(舜宇光学科技(集团)有限公司);TECAN GENios酶标仪(帝肯(上海)贸易有限公司);LightCycler®480定量PCR仪(罗氏公司)。
1.3 杀虫剂配制及染毒方法
吡虫啉和呋虫胺分别溶于酒精后,配制成100 mg·L-1的储备液,用K-medium(0.032 mol·L-1KCl和0.051 mol·L-1NaCl,高温灭菌)分别稀释至浓度为1 μg·L-1, 10 μg·L-1, 100 μg·L-1, 1 mg·L-1, 10 mg·L-1,最终酒精体积分数为0.1%。
用K-medium将同步化培养到L4期的秀丽线虫从培养基转移至装有染毒液的24孔板中,每种农药、每个浓度设置3个平行,20 ℃恒温染毒24 h。收集染毒后的秀丽隐杆线虫,用K-medium清洗3次用于后续指标测定。所有指标设置3次平行。空白对照组是含0.1%体积的酒精的K-medium溶液,与染毒液中溶剂保持一致。
1.4 运动行为及摄食行为指标
运动行为指标包括头部摆动频率和身体弯曲,参照已有的文献报道方法[14],在配备视频捕捉设备的体式显微镜下录像保存。测定方法如下:将线虫转移至滴有K-medium的未涂菌的光滑培养基上,记录1 min内线虫头部摆动的次数作为头部摆动频率指标,线虫头部从一侧摆回另一侧后,再摆动回来定义为1次头部摆动。将线虫转移至未涂菌的光滑培养基上,记录1 min内线虫身体弯曲的数目作为身体弯曲指标。线虫相对于身体长轴上一个波长的移动定义为1次身体弯曲。每个处理组至少测定20条线虫。
摄食行为通过测定线虫食物(OP 50)的改变量来进行定量分析[15]。在570 nm波长下测定暴露前后菌液吸光度值的变化量(ΔOD)。暴露前,用染毒液置换培养OP 50的LB液体培养基,调节起始OD值到1.0,将未染毒的L4期线虫转移至24孔板中进行染毒,于20 ℃恒温、轻微振荡24 h。各浓度分别设置一组不含线虫的培养液作为对照组,以矫正大肠杆菌自身生长或死亡引起的吸光度值的变化。每一个暴露浓度重复3次。
1.5 乙酰胆碱酶活性
将染毒后的线虫用K-medium冲洗收集到1.5 mL离心管中,在2.5 mL的Tris-EDTA缓冲液(pH 7.8)中低温下匀浆,将匀浆粗提液在8 000 × g、4 ℃条件下离心10 min,上清液即为粗酶液,每份粗酶液分别用BCA法蛋白含量测定试剂盒和乙酰胆碱酶活性测定试剂盒测定总蛋白含量和乙酰胆碱酶活性,每个样品中的乙酰胆碱酶活性表达为单位质量蛋白中乙酰胆碱酶活性,以消除样品之间生物量不同引起的差异。每个处理组的样品重复3次。
1.6 基因表达定量分析
参照RNAprep pure Micro Kit和FastQuant RT Kit (with gDNase)说明手册提取染毒后秀丽线虫总RNA并逆转录合成cDNA。随后,用荧光染料法在定量PCR仪进行定量PCR的实验。用actin基因作为内参基因,选取基因引物序列如表1,并通过2-ΔΔCT法计算和分析目的基因[16],公式为:
2-ΔΔCT=2-(ΔCT,q-ΔCT,cd)
其中,ΔCT=CT目的基因-CT内参基因;CT为循环次数,q代表处理组,cd代表对照组。
1.7 数据分析
所有数据均通过空白组进行归一化处理后用百分比表达,并采用平均值±标准误差(Mean±SEM)表示。运用SPSS软件进行单因素方差分析(ANOVA),显著性差异为P<0.05和P<0.01。
2 结果(Results)
2.1 吡虫啉和呋虫胺对线虫运动和摄食行为的影响
吡虫啉和呋虫胺对秀丽线虫运动行为和摄食行为的抑制如图1所示。暴露24 h后,2种农药对秀丽线虫运动行为和摄食行为的抑制作用随着暴露浓度升高而增加。100 μg·L-1吡虫啉暴露时,身体弯曲出现显著抑制,呋虫胺则达到10 mg·L-1才出现显著抑制(P<0.01)。头部摆动频率比身体弯曲的指标更为敏感,在10 μg·L-1吡虫啉暴露和100 μg·L-1呋虫胺暴露后出现了显著抑制(P<0.01)。摄食行为的敏感程度仅次于头部摆动频率,显著的抑制作用出现在100 μg·L-1吡虫啉暴露(P<0.01)和100 μg·L-1呋虫胺暴露(P<0.05),吡虫啉和呋虫胺对摄食水平的最大抑制率分别达到30.8%和36.4%,呋虫胺显示出更强的抑制作用。
2.2 吡虫啉和呋虫胺对线虫乙酰胆碱酶活性的影响
吡虫啉和呋虫胺对秀丽线虫乙酰胆碱酶活性的抑制如图2所示,秀丽线虫在吡虫啉和呋虫胺暴露后,对乙酰胆碱酶的活性的抑制作用随着浓度增加而增加。当吡虫啉暴露浓度达到10 mg·L-1后,乙酰胆碱酶活性受到明显抑制(P<0.05),最高抑制率达到39.9%,而呋虫胺暴露浓度从1 mg·L-1开始对线虫的乙酰胆碱酶活性出现明显抑制(P<0.01),最大抑制率达到51.8%,呋虫胺对线虫乙酰胆碱酶活性的抑制作用更强。

表1 基因的引物序列Table 1 The primers of ace, mtl genes and actin gene of C. elegans
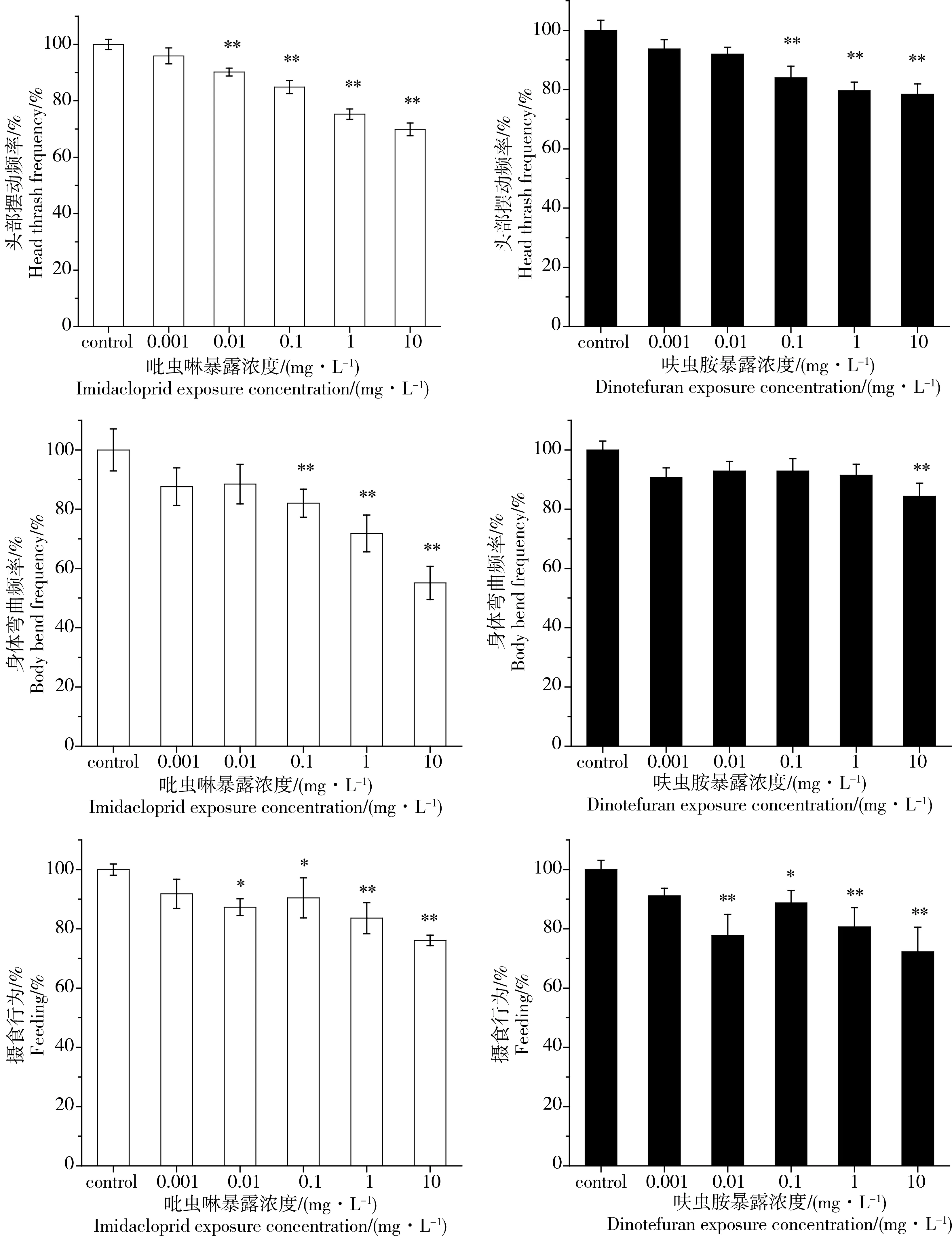
图1 吡虫啉和呋虫胺对秀丽线虫运动行为和摄食行为的抑制注:* P<0.05,** P<0.01。Fig. 1 Locomotion behavior and feeding inhibition of C. elegans after exposed to imidacloprid and dinotefuranNote: *P<0.05, ** P<0.01.
2.3 吡虫啉和呋虫胺对线虫相关基因表达的影响
吡虫啉和呋虫胺对秀丽线虫相关基因转录水平的影响如图3所示。秀丽线虫暴露于吡虫啉和呋虫胺后,乙酰胆碱酶编码基因ace的表达水平都出现了不同程度的改变,ace-1、ace-3和ace-4基因出现表达上调,而ace-2基因出现表达下调,其中改变最大的是ace-1基因,在吡虫啉暴露浓度为100 μg·L-1时,比对照组上调了6.30倍,而呋虫胺暴露1 mg·L-1时,表达上调了6.11倍。吡虫啉暴露后,mtl-1和mtl-2基因表达水平都有一定程度下调,而在呋虫胺暴露后,mtl-1和mtl-2基因表达水平有部分上调。

图2 吡虫啉和呋虫胺对秀丽线虫乙酰胆碱酶活性的抑制注:* P<0.05,** P<0.01;AchE的活性为相对活性。Fig. 2 Concentration response of the inhibitory effect on AChE activity in C. elegans exposed to imidacloprid and dinotefuranNote: *P<0.05, ** P<0.01; AchE activity is relative activity.
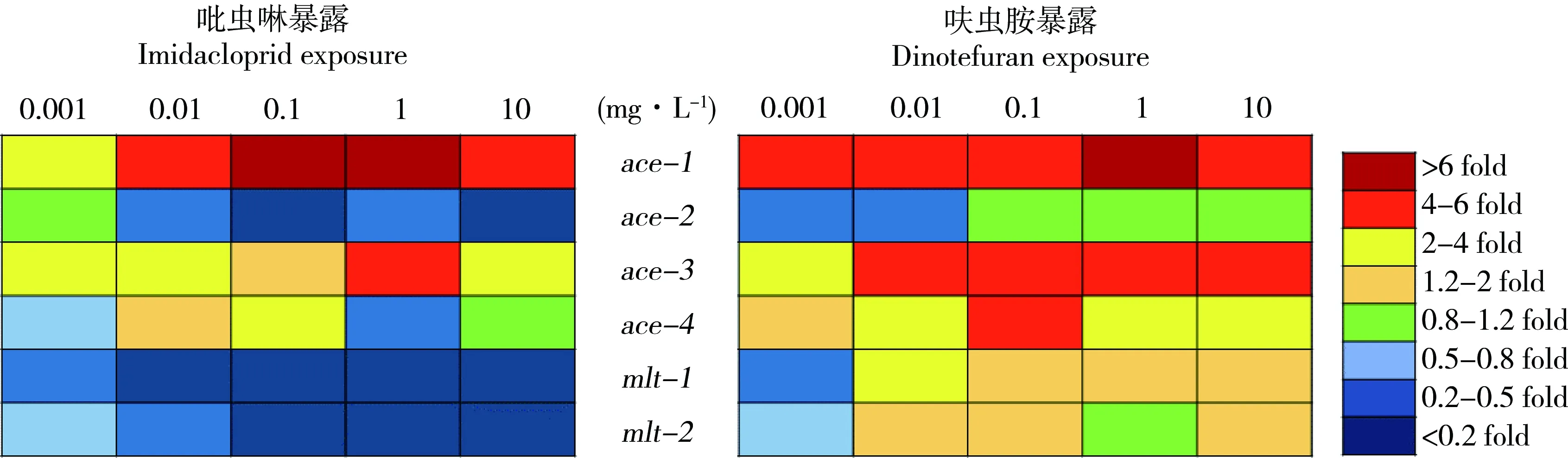
图3 吡虫啉和呋虫胺对秀丽线虫相关基因转录水平的影响Fig. 3 Transcriptional response of related genes in C. elegans following exposure to imidacloprid and dinotefuran
3 讨论(Discussion)
秀丽线虫部分乙酰胆碱位点的亚基与摄食、运动和生殖具有一定的相关性[17]。Williams和Dusenbery[18]首次在评价农药时,引入了线虫的运动行为作为指标,并发现马拉硫磷和敌敌畏对线虫行为的阻滞效应。而摄食行为是在运动行为之后引入的对毒性敏感的指标[17]。因此,虽然这些指标并不是特定的神经毒性,但是可以通过对神经细胞的间接影响来解释,并作为一个量化指标来评估农药的毒性[19]。吡虫啉和呋虫胺对秀丽线虫摄食和运动行为的抑制效应,间接反映了新烟碱类杀虫剂对秀丽线虫的神经毒性作用。
新烟碱类杀虫剂作为烟碱乙酰胆碱受体(nAChRs)激动剂与乙酰胆碱受体选择性结合,与昆虫乙酰胆碱(ACh)产生竞争,阻断昆虫中枢神经系统正常传导,导致昆虫出现麻痹而死亡[3]。而乙酰胆碱酶(AChE)是水解乙酰胆碱的酶,可进而终止胆碱能突触中的脉冲传递。在其他生物毒性试验中,Azevedopereira等[7]发现96 h的吡虫啉暴露导致了摇蚊(Chironomusriparius)AChE活性以及运动行为能力降低。Wang等[20]将赤子爱胜蚓(Eiseniafetida)暴露于吡虫啉14 d后发现了AChE活性降到最低值。秀丽线虫在经吡虫啉和呋虫胺暴露后乙酰胆碱酶活性均有随着浓度增加而受到抑制。这反映了新烟碱类农药对秀丽线虫有与靶标生物相似的作用机制,与乙酰胆碱位点结合导致秀丽线虫生理指标上的异常。
吡虫啉和呋虫胺在各项生理指标中表现出不同程度的抑制效应。吡虫啉和呋虫胺杀虫活性的结构不尽相同,在呋虫胺出现以前,几乎所有的新烟碱类化合物都有一个芳香杂环(吡虫啉中的吡啶环),它被认为是杀虫活性不可或缺的环,而呋虫胺的杀虫活性部位是它的四氢-3-呋喃甲基基团[21]。可能正是由于这种结构上的差异造成了乙酰胆碱结合位点的不同,也最终导致了吡虫啉和呋虫胺对秀丽线虫各项生理指标的抑制程度的不同。
ace基因是编码线虫体内乙酰胆碱酶的基因,不同的ace基因表达共同调控线虫体内乙酰胆碱酶的表达,但不同的ace基因在线虫体内表达区域有一定的差异。研究表明,ace-1基因在所有外表皮细胞和阴泵肌肉细胞中有表达,ace-2基因表达主要在神经元中,而ace-3和ace-4基因先在体内转录为双顺反子信使,从而构成操纵子,在咽肌细胞和2个神经管相关神经元中均有检测[22]。暴露于新烟碱类杀虫剂后,这4种ace基因的表达水平表现出了差异,ace-1、ace-3和ace-4基因分别都有上调,而ace-2基因表现为下调。但是不管是吡虫啉暴露或者是呋虫胺暴露之后,这种上调和下调却是具有一致性,尽管这种影响程度也是有差异的。吡虫啉暴露对ace-1基因的表达干扰程度更大,而其他基因受到呋虫胺暴露的干扰程度更多。ace基因表达水平的变化也再次验证了新烟碱类杀虫剂对秀丽线虫的神经毒性。mtl是编码硫蛋白的基因,Reichert和Menzel[23]在对5种外源性污染物引起的线虫基因改变的研究中发现mtl基因是对环境变化十分敏感的基因,也是观察线虫通道中重要的基因,建议可作为线虫对外源污染物评价的指示基因之一。mtl基因在低浓度的吡虫啉和呋虫胺暴露下都分别有明显的表达变化,因此mtl基因表达水平可以作为新烟碱类杀虫剂生态效应的生物标志物。
在本研究中,吡虫啉和呋虫胺从近环境浓度开始暴露,秀丽线虫的运动行为和摄食行为、乙酰胆碱酶活性都受到一定程度的抑制,且具有浓度剂量效应关系,相关酶表达基因的转录水平也有所变化,显示出新烟碱类杀虫剂对秀丽线虫的神经毒性。基因表达比其他生理学指标都更为敏感,在环境浓度下也出现了明显的改变。调控乙酰胆碱酶的ace基因转录水平的变化,影响了神经递质功能调节中起重要作用的乙酰胆碱酶,最终导致秀丽线虫运动及摄食行为的改变。吡虫啉和呋虫胺暴露对秀丽线虫表现出的神经毒性,表明新烟碱类杀虫剂对秀丽线虫具有与对靶标生物相似的作用模式。但本研究选取的暴露浓度和时间是基于实验室的评价,为了更好地评估新烟碱类农药对土壤非靶标生物的风险,仍需进一步研究低浓度长时间暴露下对秀丽线虫的毒性效应。
致谢:在实验探索过程中,感谢各位老师提供的指导和课题组同学们的帮助。

