纳米银的迁移转化对环境微生物毒性的影响
卢雪蓉,冯晓丽,刘朝莹,李潜
江苏大学环境与安全工程学院,镇江 212013
随着社会工业化的进程,纳米材料的生产和使用已被广泛应用于化工、电子、医疗、环境治理等相关领域,并呈现逐年增长的趋势[1]。其中,纳米银由于优良的抑菌性能而被广泛应用于纺织品、个人护理品、医疗器械、包装甚至食品添加剂等各类产品中[2-3]。据统计,全球AgNPs用量占纳米材料总用量的50%[4]。然而,纳米银产品在生产、运输、洗涤、侵蚀、丢弃的过程中将不可避免地释放到自然环境中并对生态系统中的微生物产生严重影响[5-6]。AgNPs的抑菌机制主要归因于释放的Ag+及诱导产生的活性氧自由基(reactive oxygen species, ROS)所引发的蛋白失活、细胞膜破损、能量代谢受阻、DNA损伤等毒理效应。但在实际环境暴露过程中,AgNPs易受到天然有机物质(natural organic matter, NOM)、pH值、溶解氧(dissolved oxygen, DO)、阴/阳离子、光照等环境因素以及自身粒径大小、形貌、表面包埋剂等理化性质的影响,导致其出现溶解、团聚、沉淀等赋存状态的改变,并进而影响其微生物毒性。因此,AgNPs在环境中的迁移转化行为及其对环境微生物毒性的影响已成为当前环境领域的研究热点。本文拟对近年来国内外的相关研究进行概述,旨在为我国在该领域的研究提供参考。
1 AgNPs在环境中的迁移转化行为(Migration and transformation of AgNPs in the environment)
1.1 环境中AgNPs的来源
近年来,AgNPs被大规模生产及广泛应用于日常生活,因此AgNPs在其生产和使用过程中将不可避免地释放到环境中[7]。据Gottschalk等[8]调查发现绝大部分AgNPs是在使用过程中由于机械磨损、材料老化、废水排放等原因而被释放到环境中。不过,环境中的Ag+经过一系列的生物化学过程也可形成AgNPs。Li等[9]证实胞外聚合物(extracellular polymeric substances, EPS)中的一些还原性基团能导致Ag+还原;Yin等[10]报道光照条件下自然环境中NOM可充当光敏剂和稳定剂以促进Ag+还原;Wang等[11]发现厌氧条件下电化学活性细菌Shewanellaoneidensis能介导AgNPs的生物合成。除此之外,还有少量AgNPs可来源于火山喷发、岩石风化、深海热泉等自然活动[7]。
1.2 AgNPs在环境中的迁移
环境中人为释放或者自然形成的AgNPs会在大气、土壤、水体等环境介质中发生迁移。AgNPs在环境中的迁移取决于其自身理化特性(粒径大小、形貌、表面包埋剂等)和不同的环境因素(NOM、pH值、DO、电解质浓度及类型、光照等)。
在大气中,AgNPs可以气溶胶的形式均匀分散,也可附着于尘埃颗粒表面,从而严重影响空气质量甚至引起一系列的呼吸道疾病。通常AgNPs在空气中不能长期稳定存在,最终会由于自身团聚或者降雨而汇入土壤和水体环境[12]。
在土壤环境中,AgNPs的迁移行为主要分为3种:重力沉降、滞留、自由扩散,这取决于AgNPs自身特性和土壤的物理化学性质[13]。AgNPs粒径对其土壤迁移过程有重要影响。对于粒径较大的AgNPs而言,重力沉降和滞留是主要的迁移行为。除少部分随着水流渗透进入地下水,大部分AgNPs则被过滤拦截于土壤中;而粒径较小的AgNPs则较易在土壤中自由迁移[14]。土壤本身的理化特性也会制约AgNPs的迁移过程。研究发现AgNPs在粘质土中易滞留,而在沙质土中迁移最快[15]。目前许多研究利用玻璃微珠、石英砂等多孔介质模拟土壤环境来探究AgNPs在土壤中的迁移行为[16-17]。但此类模拟实验因其自身的局限性,常难以准确反映AgNPs在实际土壤中的迁移过程[14]。
关于AgNPs在水体环境中的迁移,目前的研究着重从自然水体和废水体系两方面阐述。自然水体环境中,一部分环境释放的AgNPs随着地表径流汇入江河湖海或者渗透进入地下水[18]。而另一部分则随着生活废水和工业废水的排放而进入污水管道中。除少部分沉积于管道中或吸附于生物膜上,绝大部分AgNPs最终进入污水处理厂[19]。
1.3 AgNPs在环境中的赋存状态及其对微生物毒性的影响
1.3.1 表面性质改变
为了便于AgNPs的分散及实现其功能化,工业生产一般会选择聚乙烯吡咯烷酮(PVP)、聚乙烯醇(PVA)、聚乙二醇(PEG)、分枝状聚乙烯亚胺(BPEI)、柠檬酸钠、硼氢化钠等作为其包埋剂。其中,大分子亲水聚合物PVP、PVA和PEG利用空间位阻使AgNPs稳定。小分子带电荷的柠檬酸钠、硼氢化钠利用静电力使AgNPs稳定。而BPEI利用空间位阻和静电力的共同作用使其稳定[20]。AgNPs在环境迁移的过程中,表面原有的包埋剂常因吸附解离或降解脱落,而被环境中广泛存在的腐殖质(humic acid, HA)、黄腐酸(fulvic acid, FA)、EPS、蛋白质等天然有机质取代或者二次包埋。据Li等[21]和Yu等[22]报道,PVP和柠檬酸盐包埋剂在太阳光和紫外光照射下易发生光解[21-22]。Levak等[23]研究发现牛血清蛋白取代柠檬酸包埋剂吸附于AgNPs表面,使得AgNPs更稳定地存在。Gunsolus等[24]报道NOM与AgNPs之间相互作用取决于NOM化学组成以及AgNPs与包埋剂结合的紧密程度。富含S、N元素的NOM更易吸附于AgNPs表面形成二次包埋,因为S、N位点与AgNPs表面有较强的亲和力;NOM更易取代与AgNPs结合较疏松的包埋剂。Sanchez-Cortes等[25]报道pH值、NOM分子量及AgNPs包埋剂类型可影响NOM吸附能力。中性pH值条件下,HA利用芳烃位点吸附于柠檬酸盐包埋的纳米银(Cit-AgNPs),酸性pH值条件下,则通过羧酸基团位点吸附;pH值为7时,只有高分子量HA(100~300 kDa)可紧紧吸附于Cit-AgNPs,而低分子量FA(0.5~1 kDa)倾向于吸附在NaBH4-AgNPs表面。Badawy等[26]发现离子强度、pH值对PVP包埋剂没有影响,但在高离子强度及低pH值条件下柠檬酸盐包埋剂稳定性变差。相比之下,PVP作为空间位阻型包埋剂抗外界干扰的能力更强。
表面包埋剂能通过静电作用力和空间位阻调控AgNPs的稳定性及颗粒溶解速率,从而对AgNPs微生物毒性产生影响[27]。Badawy等[28]发现表面包埋剂可以改变AgNPs表面电荷,进而影响AgNPs对Bacillus的毒性,表面带负电荷的Cit-AgNPs(ζ=-38 mV)的毒性最小,表面带正电荷的BPEI-AgNPs(ζ=+40 mV)的毒性最大,未包埋的AgNPs(ζ=-22 mV)和PVP-AgNPs(ζ=-10 mV)毒性介于二者之间。
1.3.2 团聚与沉淀
团聚包括均质团聚和异质团聚。均质团聚是指理化性质相同的纳米粒子之间的团聚,异质团聚是指理化性质不同的粒子之间的团聚。而团聚最终诱导纳米材料沉淀[29]。
AgNPs均质团聚受很多环境因素的影响,包括:AgNPs粒径、形貌、pH值、电解质浓度及类型等。因为比表面积越大表面能越大,稳定性也随之变差,相对于大粒径的AgNPs,小粒径AgNPs更易团聚;相对于AgNPs,银纳米线更易稳定地存在[30-31]。pH值对Cit-AgNPs稳定性影响较大,能通过降低其颗粒表面的ζ电势而导致纳米颗粒团聚[26]。而电解质浓度和类型也会改变AgNPs表面的电荷类型,并进而影响其ζ电势。相比于一价型的电解质,二价型的电解质能更有效地降低Cit-AgNPs的稳定性[32]。虽然目前大多数研究都围绕AgNPs均质团聚展开,但AgNPs与环境中存在的胶体相互作用而导致的异质团聚也不可忽视。Zhou等[33]发现在pH值为4的条件下带负电荷的AgNPs能与边缘带正电荷的片状蒙脱石发生共团聚,使其稳定性下降,并随着时间的推移最终形成沉淀。
AgNPs团聚通常会导致其对微生物毒性的降低。一方面团聚会减少AgNPs与细胞表面接触的有效位点,另一方面AgNPs团聚也会显著降低其溶解释放Ag+的速率。Li等[34]研究发现吐温包埋处理的AgNPs相比于未包埋的AgNPs及柠檬酸盐包埋的AgNPs更易稳定地分散,并具有更快的离子释放速率,从而对水体微生物导致更高的毒性。
1.3.3 氧化溶解
近年的研究表明AgNPs对微生物产生毒性主要归咎于其释放出Ag+。而水体中Ag+首先来源于AgNPs氧化溶解。目前,AgNPs在环境中的氧化溶解行为成为研究热点。AgNPs发生氧化溶解分为两步:
4 Ag(0)+Q2=2 Ag2O
(1)
2 Ag2O+4 H+=4 Ag++2 H2O
(2)
O2和H+都参与了AgNPs的氧化溶解,因而水体DO和pH对AgNPs的溶解具有重要影响。酸性和有氧条件会加速AgNPs的溶解。AgNPs自身的粒径大小会影响其比表面积,从而影响其在水体中的稳定性。Peretyazhko等[35]报道,不管是中性还是酸性条件下,AgNPs的溶解速率随粒径的增加而减小。而温度、光照、天然有机物质等环境因素也能影响AgNPs的溶解。Liu等[36]报道,AgNPs的溶解速率随温度的升高而增加。Shi等[37]发现吸附于AgNPs表面的Ag+能在光照条件下重新还原为Ag单质。Liu等[38]发现含有半胱氨酸和谷胱甘肽等含有还原性硫醇基的有机物可以还原AgNPs表面具有氧化倾向的位点。而Gondikas等[39]却报道半胱氨酸可以促进Cit-AgNPs和PVP-AgNPs溶解。这二者矛盾的结果可能是由于不同的检测方法所导致。Liu等[38]是利用银离子选择电极直接测定溶解银。而Gondikas等[39]则是先将样品过滤酸化后用ICP-MS检测溶解银。

图1 环境因素对AgNPs赋存状态转化的影响Fig. 1 Effect of environmental factors on the transformation of AgNPs
AgNPs氧化溶解所释放的Ag+是导致微生物毒性的关键因素。Chen等[4]研究表明氧气能促进Ag+的释放,导致好氧条件下AgNPs对Pseudomonasaeruginosa的毒性要高于厌氧条件下的毒性。Kittler等[40]报道老化的AgNPs溶胶毒性高于新鲜制备的AgNPs毒性,因为存储时间的增加导致其溶解释放Ag+。
1.3.4 氯化
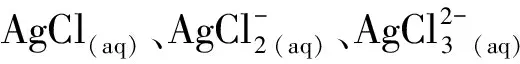
1.3.5 硫化
污水处理系统中的生物厌氧代谢会产生大量的S2-。这导致AgNPs在环境迁移转化过程中将不可避免地发生硫化反应。AgNPs的硫化既可以在好氧条件下发生,也可以在厌氧条件下发生,其机制取决于水体中S2-的浓度。高浓度条件下,S2-能直接与AgNPs反应。而低浓度条件下,S2-则与AgNPs溶解产生的Ag+相结合[47-49]。由于产生的Ag2S具有极低的溶解度(Ksp=5.92×10-51),这使得AgNPs经硫化后其对微生物的毒性作用得到显著缓解[50-51]。此外,在S2-存在条件下,AgCl(s)因其溶解度(Ksp=2×10-10)远大于Ag2S,所以会最终转化为溶解度更小的Ag2S,从而影响了AgNPs生物毒性(如图1)。
2 AgNPs对微生物的毒性效应及毒理机制(Toxic effect and toxic mechanism of AgNPs towards microorganism)
2.1 微生物毒性效应
AgNPs作为一种广谱性的抗菌剂,虽然能有效抑制革兰氏阴性菌和阳性菌的生长[52],但对其抗菌效能还存在一些争议。据Taglietti等[53]报道,革兰氏阴性菌E.coli对谷胱甘肽包埋的AgNPs耐受能力要低于革兰氏阳性菌Staphylococcusaureus。这可能是因为S.aureus较厚的细胞壁阻止了AgNPs渗透进入细胞质。然而,Yoon等[54]却发现革兰氏阴性菌细胞外膜的脂多糖能提供菌体对AgNPs的抗性。这使得革兰氏阴性菌E.coli和S.oneidensis对AgNPs的耐受能力要高于革兰氏阳性菌B.subtilis。除了常见的抑菌作用,AgNPs还被发现能刺激硫酸盐还原菌Desulfovibriovulgaris的增殖[55]。另外目前评估AgNPs毒性的方法主要通过生长曲线、平板涂布等依赖于细菌生长的评估方法。但是Königs等[56]发现AgNPs处理能够诱导P.aeruginosa进入活的非可培养状态(viable but non-culturable, VBNC)。这些结果显示目前人们对AgNPs微生物毒性的认识还有待进一步深入。
除纯菌外,近来AgNPs对微生物混合菌群的影响也受到日益重视。但是此方面的研究还有待进一步的加强。Liang等[57]发现在活性污泥处理系统中,1 mg·L-1AgNPs对反应器硝化抑制率达到41.4%。对其微生物群落结构的分析表明AgNPs会导致氨氧化细菌、亚硝酸盐氧化菌、硝化螺菌种群数明显减少,硝化菌属基本消失。Zhang等[58]研究发现0.1 mg·L-1AgNPs长期处理对膜生物反应器的效能和细胞活性没有显著影响,而且硝化细菌的群落结构较为稳定。这可能是由于活性污泥能包裹AgNPs并吸附AgNPs释放的Ag+,从而有效地降低其毒性作用。
2.2 复合毒性
实际环境中除了AgNPs外,还存在其他的污染物质。因而,近年来关于AgNPs与其他环境污染物的复合毒性效应受到日益重视。抗生素是一种重要环境污染物质。通过各种途径释放到环境中的抗生素能够与AgNPs协同作用,增强对细菌的抑制作用。四环素和庆大霉素能够改变AgNPs的表面电性,促进AgNPs与菌体结合,并会加速Ag+释放[59-60];氨苄青霉素、氯霉素、卡那霉素与AgNPs的联用会抑制病原菌细胞膜的合成,从而降低病原菌的耐受能力[61]。此外,广泛使用的洗涤剂也能影响AgNPs的抑菌活性。Kvitek等[62]发现阴离子型表面活性剂十二烷基磺酸钠(sodium dodecyl sulfate, SDS)不仅能使AgNPs更稳定地分散,而且还能增加细胞膜的通透性,使细胞对AgNPs更敏感,从而显著提高AgNPs的抗菌性能。另外,Zhao等[63]报道紫外光和AgNPs协同处理能显著增强对E.coli的抑制效果;Wilke等[64]研究发现AgNPs和纳米TiO2混合物在模拟太阳光照条件下可提高光催化活性(AgNPs作为光敏剂促进纳米TiO2的可见光响应)和过氧化氢产量,导致协同毒性。
2.3 毒理机制
AgNPs对微生物的毒性效应已经毋庸置疑。虽然迄今为止对AgNPs的毒理机制未完全清楚,但释放的Ag+以及产生的活性氧自由基(ROS)被普遍认为是最重要的2个因素(图2)。
2.3.1 Ag+释放
众多研究显示Ag+释放是造成AgNPs毒性的直接因素。Ag+不但能与膜蛋白中的硫醇基反应,使得酶失活,继而阻碍跨膜电子运输,还能与DNA相结合,造成DNA损伤并阻碍DNA复制,甚至Ag+还能影响细胞膜结构和通透性[65]。Mishra等[66]报道溶解释放的Ag+决定了AgNPs对B.subtilis的毒性,且Ag+进入胞内并被转化为Ag2O;Katsumiti等[67]比较了不同粒径AgNPs和Ag+的毒性,结果显示离子态的Ag是造成AgNPs毒性的主要因素;Sotiriou等[68]研究表明Ag/SiO2纳米颗粒对E.coli的毒性大小与溶解的Ag+浓度呈正相关,小粒径纳米颗粒释放的Ag+浓度高,抗菌活性高,大粒径纳米颗粒反之。
2.3.2 活性氧自由基产生
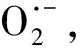
AgNPs不仅可以产生胞外ROS,还能诱导胞内ROS的产生。胞内ROS的累积能诱发蛋白质氧化、脂质过氧化、细胞膜损伤、DNA损伤等生理活动,并最终导致微生物死亡。Guo等[71]通过向反应体系中加入抗氧剂维生素C证明了AgNPs毒性与ROS紧密相关;Joshi等[72]构建了缺乏Ag+流出系统和氧化应激抵抗系统的E.coli突变体,并发现突变体对AgNPs诱导产生的ROS更为敏感。Long等[73]发现在反应体系中添加Ag+络合剂以及ROS清除剂可以消除AgNPs对E.coli的毒性,且添加Ag+络合剂能使胞内ROS含量降低到对照水平。这表明AgNPs释放的Ag+能诱导胞内ROS产生,从而导致AgNPs毒性。
虽然Ag+和ROS是导致AgNPs毒性的关键因素,但是其他因素也对纳米银的毒性机制评估产生影响。例如,不同的受试菌株对AgNPs胁迫的抵御机制可能存在差异。Mishra等[66]研究表明Ag+导致AgNPs对B.subtilis的毒性,而Joshi等[72]认为ROS胁迫导致AgNPs对E.coli突变体的毒性。另外,AgNPs表面包埋剂也可能影响其毒性机制。Zhang和Li[69-70]研究结果表明有无包埋剂或者包埋剂类型会影响AgNPs是否光激发产生ROS及ROS种类,从而影响AgNPs毒理机制。此外,复杂环境因素对AgNPs毒理机制具有重要影响,此方向的研究报道尚有待进一步加强。

图2 AgNPs微生物毒性机制Fig. 2 Toxic mechanism of AgNPs towards microorganism
3 结语(Summary)
纳米银材料的广泛应用已经给人类生产生活带来了诸多便利。但是其日益增强的环境释放也对生态环境,尤其是对单细胞的环境微生物带来潜在危害。在实际复杂环境多因素条件下,AgNPs环境迁移转化过程以及对微生物毒性效应影响的研究尚有待加强:AgNPs在土壤中迁移转化的模拟实验应着重研究复杂环境因素的影响,以反映AgNPs在实际土壤中迁移的真实状况;AgNPs低剂量刺激效应以及诱导进入VBNC状态的研究尚需深入开展;AgNPs和其他典型环境污染物的复合毒性效应研究需要进一步探讨;不同微生物对AgNPs毒性的耐受机制的研究有待进一步加强;复杂环境因素对于AgNPs毒理机制的影响应广泛开展。
致谢:感谢江苏大学环境与安全工程学院肖翔副教授在文章修改中给予的帮助。

