秸秆生物炭活化过硫酸盐氧化降解苯酚
姚淑华,马锡春,李士凤
秸秆生物炭活化过硫酸盐氧化降解苯酚
姚淑华,马锡春,李士凤*
(沈阳化工大学,辽宁省工业排放重金属处理与资源化技术工程研究中心,辽宁 沈阳 110142)
以苯酚为目标污染物,高粱秸秆生物炭(S-BC)作为催化剂研究其活化过硫酸盐(PS)降解苯酚的效果.对影响降解的因素(包括PS浓度、S-BC质量浓度、初始pH值以及自由基清除剂)进行探讨,同时研究了生物炭的重复使用效果.研究结果表明,S-BC/PS体系对苯酚的去除率显著高于单一S-BC和PS体系.在(PS):(phenol)为50:1,S-BC质量浓度为1.5g/L,pH值为11的条件下,15h内苯酚的去除率高达99.7%;自由基清除剂(叔丁醇(TBA),甲醇(MeOH))测定×OH和SO4-×是苯酚降解的主要活性物种;S-BC重复使用4次时对苯酚的去除率仍能达到100%.综上所述,生物炭可作为一种高效催化剂活化过硫酸盐降解苯酚.
秸秆生物炭;降解;活化;过硫酸盐;苯酚
苯酚被广泛用于各种树脂的商业生产,包括用作汽车、家电和建筑材料的酚醛树脂,用于各种应用的环氧树脂、粘合剂以及聚酰胺[1-3].美国环境保护署(USEPA)已将苯酚列为优先污染物[4],同时,世界卫生组织(WHO)建议饮用水中允许的苯酚浓度为0.001mg/L[5].苯酚废水的处理已经成为国内外水污染控制领域的一个研究热点[6-7].目前污水中苯酚的处理方法主要有化学法、物理化学法、生物法等.其中化学法中的化学氧化法是采用加入催化剂或者氧化剂来促进苯酚的降解[8-10],这种技术的优点是可在较短时间内将苯酚降解成CO2、H2O和其它小分子化合物,具有降解速率快、无二次污染等优点[6-11].作为氧化剂的过硫酸铵(PS),因其成本适中和高的氧化还原电位(2.01V)[12-13]可产生活性自由基(SO4-×)来降解苯酚.但由于PS是一种温和的氧化剂,所以,它必须被热[14-15]、紫外光[16-17]、过渡金属离子(Fe2+等)[18]等活化法激活才能生成高活性的SO4-×(2.5~3.1V)[19].在这些活化方法中,热活化法加热过程复杂;紫外光活化法需要大量外界能量;过渡金属离子(Fe2+等)激活法在常温常压下进行,操作简单,但引入的金属离子难以去除.近年来,人们采用活性炭代替金属离子作为催化剂来活化PS[20-21],操作简单,效果显著.本文考虑用廉价易得的秸秆生物炭[22-23]代替活性炭,秸秆是农业生产的附产品,我国是农业大国,每年约有7亿多吨的农作物秸秆产出[24],所以利用秸秆生物炭催化PS氧化降解苯酚是可再生资源高效利用的有效途径之一.
本研究用热解法制备的S-BC进行活化PS氧化降解含酚的模拟废水实验,研究了S-BC/PS对苯酚的降解效果、PS浓度、S-BC浓度、初始pH值以及自由基清除剂对降解过程的影响,以提高其降解性能,达到以废治废的目的.
1 材料与方法
1.1 材料
聚偏氟乙烯(PVDF)微孔膜,平均孔径0.22μm.苯酚AR级,过硫酸铵AR级,盐酸AR级,氢氧化钠AR级,4-氨基安替比林AR级.氮气,纯度为99.5%.实验室用水为去离子水.高粱秸秆采自沈阳周边农村,用去离子水洗涤、干燥后用粉碎机粉碎过80、120目筛备用.
1.2 分析方法
使用722-N可见分光光度计用4-氨基安替比林法测苯酚浓度.用重铬酸钾法测样品的化学需氧量(COD).
1.3 生物炭的制备
将高粱秸秆在氮气氛围下以5℃/min的速率升温至700℃并保温3h,冷却后磨碎过80、120目筛.分别用1mol/L盐酸、无水乙醇浸泡12h,去离子水洗涤数次直至pH值为中性,105℃下干燥,制备得到高粱秸秆生物炭记为S-BC.
1.4 生物炭的性能表征
制备成的生物炭分别用比表面积与孔径分析仪(BET)、扫描电镜(SEM)、X线衍射(XRD)、拉曼光谱(Raman)进行结构表征和分析.
1.5 降解实验
在200mL25mg/L苯酚溶液中加入一定量的S-BC(质量浓度分别为0.5、1.5、3.0g/L)和PS(PS与苯酚的物质的量比分别为3:1、10:1、50:1、100:1、200:1).反应条件为:40℃(投加反应物前将苯酚溶液放置到设定温度为40℃的密闭恒温振荡器中一定时间,保证恒温,在振荡器中快速投加反应物后密封), pH值为6.9,将锥形瓶置于恒温振荡器中以150r/min振荡.分别在5、8、10、12、15h取出其中一个锥形瓶取样25mL,用0.22μm滤膜过滤后测定苯酚的浓度.
1.6 生物炭重复使用实验
将0.3g的S-BC放入到装有200mL25mg/L苯酚溶液的250mL锥形瓶中,搅拌2~3d直至悬浮液中苯酚浓度不再变化为止,将S-BC过滤,在80℃下烘干即得到S-BC-1.S-BC-1活化PS降解苯酚后过滤溶液,用去离子水冲洗生物炭以除去表面的苯酚和杂质,在80℃下烘干即得到使用两次的生物炭S- BC-2,同样条件下使用3次记为S-BC-3.
2 结果与讨论
2.1 秸秆生物炭的表征
生物炭的比表面积和孔径分析结果见表1,结合扫描电镜图1可知,在热解温度700℃下制备的生物炭比表面积为35.24m2/g,孔径集中在20nm以下,说明主要含有大量中孔和微孔,存在少量大孔.从图1可以看出,生物炭的表面光滑,主要呈片状结构,有一定量微米级孔状结构,因此生物炭是良好的吸附剂、活化剂和催化剂载体.本文采用生物炭来活化过硫酸盐降解苯酚,在比较降解苯酚前后的变化后,发现生物炭的表面有明显变化,生物炭经过活化氧化后,其降解产物、SO42-以及苯酚等附着在生物炭表面,从而覆盖了大量的活性吸附位点,使氧化降解反应减慢,大量分子进入微孔中,这与使用后的生物炭对苯酚的降解曲线一致,使用两次的生物炭对苯酚去除由降解变为吸附.

表1 材料的表面结构特征
由图2生物炭活化过硫酸盐降解苯酚前后的Raman测试曲线可以看出1364cm-1、1580cm-1处的峰分别对应石墨的D峰和G峰两个特征吸收峰.D、G峰的峰强比值D/G能反应炭材料的石墨化程度和完整性,生物炭样品D/G≈1.4,说明其表面的微晶较小,表面及边缘位置的不饱和碳原子的数量较多,石墨化程度较低并且是无定型碳结构,证明了S-BC表面的反应活性较强,可以用来活化过硫酸盐.


图2 S-BC拉曼光谱
2.2 S-BC/PS对苯酚降解的影响
吸附会对活化过程的氧化产生影响,所以为了研究S-BC/PS对苯酚降解的影响,对S-BC的吸附、PS的氧化进行了研究.在200mL,25mg/L的苯酚溶液中加入一定量的S-BC(投加量为1.5g/L)和PS(PS/phenol=50/1),同时加入仅有S-BC和PS的溶液作为空白对比.反应条件为:40℃,初始pH值为6.9.

图3 S-BC/PS体系降解苯酚
(PS/phenol=50/1,S-BC投加量1.5g/L)1—PS; 2—S-BC; 3—S-BC/PS.
图3为不同体系(包括单一PS、单一S-BC、S-BC/PS)对苯酚的去除效果.3个体系对苯酚15h的去除率从高到低为S-BC/PS体系(97.4%)、单一S-BC(17.3%)、单一PS(15.4%).单一PS氧化和S-BC吸附对苯酚的去除效果都不好,而S-BC/PS体系能更明显的去除苯酚.这是由于单一过硫酸盐只产生少量SO4-×如式(1),而S-BC/PS体系中S-BC表面含有大量的-COOH,经过活化PS后,增加了生物炭表面的碱性,产生了SO4-×,如反应式(2)、(3),进一步提高了苯酚的降解率.S-BC可以活化PS氧化降解苯酚,这与杨鑫等[25]研究GAC/PS体系相似.
2S
2
O
3
2
-
+2H
2
O
®
3SO
4
2
-
+SO
4
-
×
+O
2
-
×
+4H
+
(1)
BCsurface-OOH+S
2
O
8
2
-
®
SO
4
-
×
+BCsurface-OO
×
+HSO
4
-
(2)
BCsurface-OOH+S
2
O
8
2
-
®
SO
4
-
×
+BCsurface-O
×
+HSO
4
-
(3)
2.3 过硫酸盐浓度的影响

图4 PS浓度对S-BC/PS体系降解苯酚的影响
(S-BC投加量1.5g/L,PS/phenol=3/1~200/1)1—3:1PS; 2—3:1S-BC/PS; 3—10:1PS; 4—10:1S-BC/PS; 5—50:1PS; 6—50:1S-BC/PS; 7—100: 1PS; 8—100:1S-BC/PS; 9—200:1PS; 10—200:1S-BC/PS.
在苯酚浓度为25mg/L,S-BC投加量为1.5g/L,初始pH值为6.9,温度为40℃情况下,探讨了PS浓度对苯酚降解的影响.由图4可见:单一PS对苯酚的氧化作用不明显,随着PS质量浓度的增加,苯酚的氧化作用会有所提升,在PS/phenol物质的量为200/1时达到最大去除率28.5%.在同样的比例下S-BC/PS体系10h就可降解100%的苯酚. PS/phenol物质的量比为200/1与物质的量比为3/1时对苯酚的降解相比,有显著的加速效应,这表明提高PS质量浓度可加速苯酚的降解.然而,当PS质量浓度增大到增大到一定程度会出现饱和,降解效率不会继续增加,这可能是由于过量的PS消耗了SO4-×[27]以及SO4-×之间的反应,如式(4)、(5),所以在接下来的实验中采用PS/phenol物质的量比为50/1进行实验.
S
2
O
8
2
-
+ SO
4
-
×
®
HS
2
O
8
-
×
+ SO
4
2
-
(4)
SO
4
-
×
+ SO
4
-
×
®
S
2
O
8
2
-
×
(5)
2.4 S-BC投加量的影响
在苯酚浓度为25mg/L,PS/phenol=50/1,初始pH值为6.9,温度为40℃情况下,探讨了S-BC投加量对苯酚降解的影响.
图5为在单一S-BC体系中,S-BC投加量为0.5g/L时,苯酚去除率为14.0%,S-BC质量浓度为3.0g/L时,苯酚去除率达到53.2%.在S-BC/PS体系中,S-BC投加量为0.5g/L时,苯酚去除率为48.3%, S-BC投加量为3.0g/L时,苯酚去除率达到99.3%.结果表明,随着S-BC投加量的增加,单一S-BC和S-BC/PS体系中苯酚降解随之加快.这是因为一方面S-BC表面有大量的活性吸附位点,另一方面S-BC投加量的增加,PS分解产生SO4-×的活性部位增多,PS分解速率随之加快,作为氧化物的SO4-×产生速率增加,苯酚的降解加快.虽然在S-BC投加量为3g/L时对苯酚去除率最高,但效果远不如1.5g/L时显著.考虑到S-BC在S-BC/PS体系中的贡献, 1.5g/L是最佳的投加量.

图5 S-BC投加量对S-BC/PS体系降解苯酚的影响
(S-BC质量浓度1.5g/L,PS/phenol=50/1)1—C 0.5g/L; 2— C 0.5g/L+PS; 3— C 1.5g/L; 4— C 1.5g/L+PS; 5— C 3.0g/L; 6— C 3.0g/L+PS
2.5 溶液初始pH值的影响
pH值是降解过程中一个至关重要的影响因素,适当控制溶液中的 pH 能使有机物的去除率增大.因此对不同pH条件下S-BC对苯酚吸附以及S-BC/PS体系对苯酚的降解情况进行了研究.方法为反应前用0.1mol/L和1mol/L的HCl或NaOH溶液调节苯酚溶液的pH值分别为3.0、5.1、6.9、9.1、11.0,控制苯酚浓度25mg/L,S-BC投加量为1.5g/L,PS/phenol=50/1.
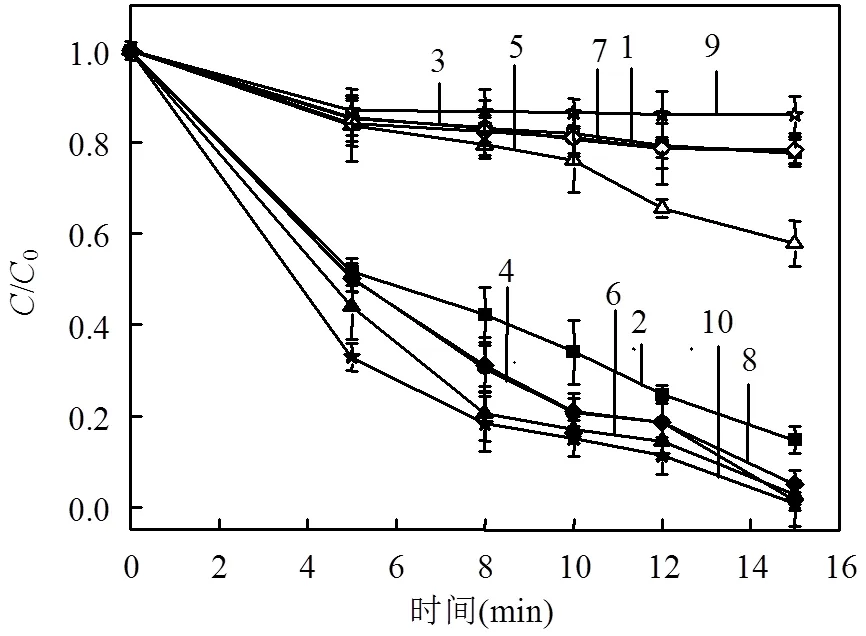
图6 初始pH对S-BC/PS体系降解苯酚的影响
(S-BC投加量1.5g/L,PS/phenol=50/1)1—pH=3.0 (无PS); 2—pH=3.0; 3—pH=5.1 (无PS); 4—pH=5.1; 5—pH=6.9 (无PS); 6—pH=6.9; 7—pH=9.1 (无PS); 8—pH=9.1; 9—pH=11.0 (无PS); 10—pH=11.0
图6为单一S-BC和S-BC/PS体系在初始pH值分别为3.0、5.1、6.9、9.1、11.0时对苯酚降解的影响.可见单一S-BC吸附的最佳pH值是6.9,苯酚去除率为42.2%.苯酚显弱酸性,当pH(溶液)
2S
2
O
8
2
-
+2H
2
O
®
3SO
4
2
-
+SO
4
-
×
+O
2
-
×
+4H
+
(6)
SO
4
-
×
+OH
-
®
SO
4
2
-
+
×
OH (7)
在碱性条件下产生的×OH会氧化苯酚,再加上碱性条件下SO4-×的作用,会进一步提高苯酚的去除率.初始pH值为3.0时的苯酚去除率最低,这可能是由于pH(溶液) 化学需氧量(COD)是最常用的水质分析指标,反应了水中有机物的含量.为了对反应后苯酚的去除情况和COD的去除情况分别进行分析.将反应溶液在40℃下放入恒温振荡器中振荡7.5h、15h,离心过滤,取滤液20mL采用重铬酸钾法做COD的测定.另一组空白对照,在锥形瓶中加入200mL的40℃去离子水,加入上述实验中等量的过硫酸铵,取20mL做COD的测定.实验条件:苯酚浓度25mg/L,S-BC质量浓度1.5g/L,PS/phenol=50/1,溶液初始pH6.9.由表2可知,COD去除率在7.5h为12.5%,15h迅速增加至96.9%,这与苯酚去除率的增加趋势不同,7.5h苯酚去除率为55.5%,15h后苯酚去除率达到97.4%.可见PS在生物炭活化作用下对酚羟基的降解效果显著,但对COD的去除效果要差些,说明在实验反应中S-BC/PS对苯酚的降解并不彻底,酚羟基被降解[30],但有机碳链可能仍然存在,15h后COD去除率与苯酚去除率相符,说明苯酚降解成无毒的CO2、H2O和其它小分子化合物. 表2 S-BC/PS降解苯酚溶液中COD的测定 S-BC可活化PS形成SO4-×(式(2)、(3))[30],水溶液中的SO4-×与水分子相互反应生成×OH,反应如下: SO 4 - × + H 2 O ® SO 4 2 - + × OH + H + (8) 所以在S-BC活化PS体系中, SO4-×和×OH都可能是苯酚降解的原因,为了确定用于苯酚降解的主导自由基,在反应中用醇作探针.控制实验的条件为:在一定量的苯酚溶液中加入甲醇使MeOH/phenol= 1000/1,另一组加入叔丁醇使TBA/phenol=1000/1,控制S-BC质量浓度为1.5g/L,PS/phenol=50/1,溶液初始pH值为6.9,温度为40℃. 图7 自由基清除剂对S-BC/PS体系降解苯酚的影响 S-BC质量浓1.5g/L,PS/phenol=50/1,alcohol/phenol=1000/1 醇的加入可以猝灭自由基,影响苯酚的降解速率,从而识别出主导的自由基.具有和不具有α-氢的醇对自由基物质具有不同的反应性和速率常数.MeOH(含有α-氢)对SO4-×和×OH反应的速率常数相差不多,分别是1.1´107mol/(L×S)和9.7´109mol/(L×S);而TBA与×OH[6´108mol/(L×S)]反应比SO4-×[8.4´105mol/(L×S)]反应的反应速率快得多[32].由图7可见,加入两种自由基猝灭剂后,对苯酚的降解起到抑制作用,表明该体系下SO4-×和×OH共同参与反应.在相同浓度的TBA和MeOH条件下,TBA对苯酚的去除率相对较小,表明×OH起活化PS降解苯酚的主要作用, SO4-×起辅助作用. 图8为S-BC重复使用几次后活化PS对苯酚去除的影响.对S-BC/PS体系来说,S-BC重复使用过程中对苯酚的去除率明显降低.重复使用3次和4次的S-BC在PS/phenol体系中反应15h时对苯酚的去除率分别为34.1%和21.3%,而使用新鲜的S-BC去除率是97.4%,S-BC已略有失效,原位恢复性能不好,这说明S-BC和S-BC-1在S-BC/PS体系中起到活化氧化作用使苯酚快速降解;但随着反应时间的增加,使用1次和2次的S-BC在24h时对苯酚去除率达到100%,使用3次和4次的S-BC在60h对苯酚的去除率也能达到100%,这可能是因为:①经过活化氧化反应后,PS作为一种氧化剂,在与S-BC接触过程中会使S-BC表面性质发生变化[33];②降解的中间产物、溶液中的SO42-以及苯酚等残留在生物炭表面,大量分子进入孔道内,使微孔面积和体积显著减少[25],从而氧化剂与S-BC表面活性位点接触的几率降低,致使S-BC-2和S-BC-3在溶液中只起到了缓慢的吸附作用. 图8 S-BC在S-BC/PS体系中重复使用情况 S-BC质量浓度1.5g/L,PS/phenol=50/1 4.1 以高粱秸秆热解制得的S-BC代替活性炭活化PS,进行苯酚降解实验.其机理是S-BC表面的-OH官能团与PS反应生成活性自由基降解了苯酚. 4.2 在40℃,pH 值11的条件下S-BC/PS体系对苯酚去除率达到99.7%. 4.3 S-BC质量浓度越大、PS浓度越大,苯酚去除率越高,S-BC作为活化剂,重复使用4次后对苯酚的去除速率降低,其原因可能是苯酚降解的中间产物残留在生物炭表面对反应不利和S-BC层状结构上的孔发生明显堵塞.×OH起活化PS降解的主要作用, SO4-×起辅助作用. [1] 刘佳露,卢 伟,张凤君,等.活化过硫酸盐氧化地下水中苯酚的动力学研究 [J]. 中国环境科学, 2015,35(9):2677-2681. [2] Roostaei N, Tezel F H. Removal of phenol from aqueous solutions by adsorption [J]. Journal of Environmental Management, 2004,70(2): 157-164. [3] Mahvi A H, Maleki A, Eslami A. Potential of rice husk and rice husk ash for phenol removal in aqueous systems [J]. American Journal of Applied Sciences, 2004,1(4):321-326. [4] USEPA. EPA technical support document for water quality-based toxics control [R]. Washington: United States Environmental Protection Agency, 1985. [5] IPCS EHC 161, Environmental health criteria for phenol [S]. [6] 时文中,华 杰,朱国才,等.电化学法处理高盐苯酚废水的研究[J]. 化工环保, 2003,23(3):129-133. [7] 杨 洋.吸附-催化氧化技术处理废水中苯酚的研究[D]. 扬州:扬州大学材料工程学院, 2013. [8] 孙 怡,于利亮,黄浩斌,等.高级氧化技术处理难降解有机废水的研发趋势及实用化进展 [J]. 化工学报, 2017,68(5):1743-1754. [9] Feng L, Hullebusch E D V, Rodrigo M A, et al. Removal of residual anti-inflammatory and analgesic pharmaceuticals from aqueous systems by electrochemical advanced oxidation processes [J]. Chemical Engineering Journal, 2013,228(1):944-964. [10] Neyens E, Baeyens J. A review of classic Fenton's peroxidation as an advanced oxidation technique [J]. Journal of Hazardous Materials, 2003,98(1-3):33-50. [11] Klavarioti M, Mantzavinos D, Kassinos D. Removal of residual pharmaceuticals from aqueous systems by advanced oxidation processes [J]. Environment International, 2009,35(2):402-417. [12] Frontistis Z, Hapeshi E, Fatta-Kassinos D, et al. Ultraviolet-activated persulfate oxidation of methyl orange: a comparison between artificial neural networks and factorial design for process modelling[J]. Photochemical & Photobiological Sciences Official Journal of the European Photochemistry Association & the European Society for Photobiology, 2015,14:528-535. [13] Romero A, Santos A, Vicente F, et al. Diuron abatement using activated persulphate: effect of pH, Fe(II) and oxidant dosage [J]. Chemical Engineering Journal, 2010,162(1):257-265. [14] Waldemer R H, Tratnyek P G, Johnson R L, et al. Oxidation of chlorinated ethenes by heat-activated persulfate: Kinetics and products [J]. Environmental Science and Technology, 2007,41(3):1010-1015. [15] Hori H, Murayama M, Inoue N, et al. Efficient mineralization of hydroperfluorocarboxylic acids with persulfate in hot water [J]. Catalysis Today, 2010,151(1/2):131-136. [16] Lau T K, Wei C, Graham N J D. The aqueous degradation of butylated hydroxyanisole by UV /S2O82-: Study of reaction mechanisms via dimerization and mineralization [J]. Environmental Science and Technology, 2007,41(2):613-619. [17] 郭佑罗,关小红,高乃云,等.紫外/过硫酸盐工艺降解水中氯贝酸的研究[J]. 中国环境科学, 2016,36(7):2014-2019. [18] Cao J S, Zhang W X, Brown D G, et al. Oxidation of lindane with Fe(II)-activated sodium persulfate [J]. Environmental Engineering Science, 2008,25(2):221-228. [19] Neta P, Huie R E, Ross A B. Rate constants for reactions of inorganic radicals in aqueous solution [J]. Journal of Physical and Chemical Reference Data, 1988,17(3):1027-1284. [20] Yang S, Yang X, Shao X, et al. Activated carbon catalyzed persulfate oxidation of azo dye acid orange 7at ambient temperature [J]. Journal of Hazardous Materials, 2011,186(1):659-666. [21] 李 娜,李小明,杨 麒,等.微波/活性炭强化过硫酸盐氧化处理垃圾渗滤液研究[J]. 中国环境科学, 2014,34(1):91-96. [22] 武丽君,王朝旭,张 峰,等.玉米秸秆和玉米芯生物炭对水溶液中无机氮的吸附性能[J]. 中国环境科学, 2016,36(1):74-81. [23] 郎印海,刘 伟,王 慧.生物炭对水中五氯酚的吸附性能研究 [J]. 中国环境科学, 2014,34(8):2017-2023. [24] Szyma´nski G S. Catalytic destruction of methyl tertiary butyl ether (MTBE) using oxidized carbon [J]. Catalysis Today, 2008,137:460- 465. [25] 杨 鑫,杨世迎,王雷雷,等.活性炭催化过二硫酸盐降解水中AO7 [J]. 环境科学, 2011,32(7):1960-1966. [26] 张坤坤.过硫酸盐催化氧化含酚废水的研究[D]. 西安:西安科技大学环境工程学院, 2013. [27] Chen J B, Qian Y J, Liu H M. Oxidative degradation of diclofenac by thermally activated persulfate: implication for ISCO [J]. Environmental Science and Pollution Research International, 2016, 23(4):3824-3833. [28] Furman O S, Teel A L, Watts R J. Mechanism of base activation of persulfate [J]. Environmental Science & Technology, 2010,44(16): 6423-6428. [29] Liang C, Wang Z S, Mohanty N. Influences of carbonate and chloride ions on persulfate oxidation of trichloroethylene at 20°C [J]. Science of the Total Environment, 2006,370(2/3):271-277. [30] 苏金钰.活性炭负载TiO2催化臭氧氧化去除水中的酚[D]. 湘潭:湘潭大学环境工程学院, 2005. [31] Yan J C, Han L, Gao W G, et al. Biochar supported nanoscale zerovalent iron composite used as persulfate activator for removing trichloroethylene [J]. Bioresource Technology, 2015,175:269-274. [32] Yan J C, Lei M, Zhu L H, et al. Degradation of sulfamonomethoxine with Fe3O4magnetic nanoparticles as heterogeneous activator of persulfate [J]. Journal of Hazardous Materials, 2011,186:1398-1404. [33] 刘子乐,曾泽泉,杨洁杨.表面改性活性炭活化过硫酸盐降解苯酚[J]. 高等学校化学学报, 2017,38(7):1241-1248. Straw biochar activated persulfate oxidation and degradation of phenol. YAO Shu-Hua, MA Xi-Chun, LI Shi-Feng* (Liaoning Engineering Research Center for Treatment and Recycling of Industrially Discharged Heavy Metals, Shenyang University of Chemical Technology, Shenyang 110142, China)., 2018,38(11):4166~4172 Persulfate (PS) oxidative degradation of phenol in an aqueous solution was studied in the presence of sorghum-straw biochar (S-BC). The effects of critical parameters, including sodium persulfate (PS) concentration, dose of catalyst, and the initial pH, were investigated. The results show that the ratio of phenol degradation in S-BC/PS system is obviously better than those of single S-BC and PS. The maximum removal efficiency of phenol reached 99.7% with PS/phenol molar ratio of 50:1, S-BC dosage of 1.5g/L, initial pH of 11and reaction time of 15h. Radical mechanism was studied and two radical scavengers (methanol (MA), tert-butanol (TBA)) were used to determine the kind of major active species taking part in the degradation of phenol. Finally, the recovery performance of S-BC was studied through the S-BC reuse experiments. In summary, the method of activating PS with S-BC may offer great benefits in remediation of phenol-contaminated water. straw biochar;degradation;activation;persulfate;phenol X131.2 A 1000-6923(2018)11-4166-07 姚淑华(1967-),辽宁阜新人,教授,博士,主要从事环境污染治理方面的研究.发表论文60余篇. 2018-04-21 国家重点研发计划专项项目(2017YFD0800301);国家自然科学基金面上项目(41373127),辽宁省教育厅科研项目(LQ2017012) * 责任作者, 副教授, li.shi.feng@163.com2.6 溶液中COD的测定
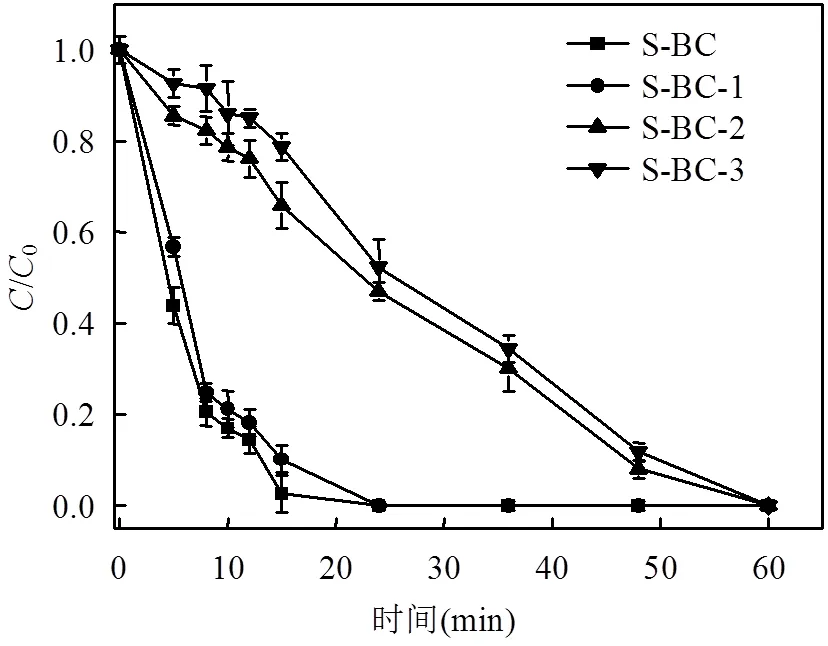
2.7 确定主导的自由基

4 结论

