氯消毒过程中水中色氨酸产生THMs和HAAs的特征研究
陈丹雯,黄 富,朱世翠,余 齐,于建全,李小敏,马晓雁*
氯消毒过程中水中色氨酸产生THMs和HAAs的特征研究
陈丹雯1,2,黄 富1,朱世翠1,余 齐1,于建全1,李小敏3,马晓雁1*
(1.浙江工业大学建筑工程学院市政工程系,浙江 杭州 310014;2.河海大学环境学院,江苏 南京 210098;3.国家城市供水管网水质监测站杭州站,浙江 杭州 310014)
以氨基酸为代表的溶解性含氮有机物在水源水中广泛存在,成为制水工艺消毒副产物的主要前体物之一.选取色氨酸(Trp)为含氮前体物模型,考察了其在消毒工艺中产生受控消毒副产物的途径及影响因素.结果表明,Trp氯化过程经取代,脱羧,水解等一系列反应,可生成卤乙酸(HAAs),三卤甲烷(THMs)等消毒副产物.THMs和HAAs的生成量随加氯量增加;随接触时间的延长逐渐增加.温度的升高,HAAs的生成量先增大后减少;碱性条件有利于THMs和HAAs的生成.氯胺消毒和遮光条件下可明显减少THMs和HAAs的产生.
氯消毒;色氨酸;消毒副产物;三氯甲烷;卤乙酸
消毒是保障饮用水的安全性必不可少的环节,其在灭活微生物和防止水介传染病的传播方面发挥了重要作用.氯应用于饮水消毒已有上百年历史,至今仍是全球范围广泛采用的消毒方式.不仅我国采用氯消毒的水厂数量众多,发达国家对氯消毒剂的利用率也高达90%.然而,氯消毒可产生三氯甲烷等消毒副产物,影响饮用水的安全.有关氯系消毒副产物的鉴定和控制等研究一直是饮用水安全保障领域的热点问题.
天然有机物NOM是水中消毒副产物的主要来源,以含碳NOM为主,其产生消毒副产物的种类、机制和控制等已有充分的阐述.随着分析技术手段的进步,越来越多的消毒副产物被识别,近年来,含氮消毒副产物因其具有高毒性及分布广泛等特点备受关注[1-2].水中可溶含氮有机物是其主要的前体物,氨基酸即是水源水环境中最为常见的一类可溶性含氮有机物,已有研究表明地表河水检出氨基酸浓度0.100~2.74mg/L,富营养化的湖泊最高检出量高达6mg /L左右[3-7].
三氯甲烷是许多有机物氯化反应的最终产物之一[8],也是最常被检测出的并具有较高浓度的副产物[9-10],具有潜在致癌性.卤乙酸是非挥发性化合物,水溶性高,在饮用水检出消毒副产物中浓度占第二位,其中二氯乙酸和三氯乙酸在水中的检出率最高[11].由于THMs和HAAs存在的健康风险[12],各国对其含量有一定的限制,如美国饮用水中总THMs和HAAs的最大允许浓度为0.080mg/L和0.060mg/L[13],我国的三氯甲烷和三氯乙酸控制限量为0.06mg/L和0.1mg/L.近年来,含氮有机前体物诸如氨基酸等产生消毒副产物的相关报道逐渐增多,但其THMs和HAAs生成潜能的研究结果存在不同的论述,王超等[14]认为氨基酸具有较大的三氯甲烷生成潜能,最高可达0.387mol/mol,而Hong等[15]仅检测到几微克每升.此外,高乃云等[16]通过GC/MS扫描和前线轨道理论验证,探讨了酪氨酸氯化生成氯仿的生成路径.而对于其他氨基酸氯化过程中生成THMs、HAAs机理仍需进一步完善[14].故本文以色氨酸为模型前体物,探讨了不同的氯消毒条件下,以HAAs和THMs为主的消毒副产物产生特征,形成途径以及生成势,以期为饮用水安全保障提供相应的基础数据.
1 材料与方法
1.1 实验材料
实验所用试剂均为分析纯或色谱纯,其中色氨酸,正己烷购于北京百灵威科技有限公司, THMs, HAAs标准品(纯度>99%),甲基叔丁基醚,1,2-二溴丙烷,次氯酸钠(5%有效氯)等均购自Aladdin Industrial Corporation,次氯酸钠使用前滴定有效氯.其它试剂抗坏血酸购于广东光华科技股份有限公司,硫代硫酸钠产自杭州萧山化学试剂厂,甲醇购自天津市四友精细化学品有限公司.
1.2 实验仪器
气相色谱质谱联用仪分析(QP2010Plus, Shimadzu,日本)及气相色谱-电子捕获(GC-ECD, Shimadzu,日本)用于消毒副产物的鉴定及定量分析.实验中所用仪器设备包括,纯水机(UPHW1-90T,优普,北京),pH计(SX751,三信,上海),马弗炉(SX2- 12-16T,精科,济南),数显恒温磁力搅拌水浴锅(SHJ- 6A,高德,常州).
1.3 实验方法
1.3.1 氯化反应 将一定量的色氨酸和次氯酸钠溶液投加于100mL容量瓶内,保证Cl2和色氨酸的物质的量比(Cl2/Trp)为10,并投加10mL磷酸缓冲溶液将反应pH值控制为7,反应于恒温水浴磁力搅拌锅内进行,反应30min后加抗坏血酸终止反应.分别测定卤乙酸、三氯甲烷生成量.模拟氯胺消毒时,投加不同剂量的氯化氨.
消毒副产物生成势是指在有效氯投加过量和长时间反应条件下,使水样中的有机物与氯充分接触反应后生成消毒副产物的量.三氯甲烷和卤乙酸生成势的测定方法为:配制初始浓度为10mg/L的色氨酸水样,测定前用稀HCl调节水样 pH 值至7,加入10mL磷酸缓冲溶液;然后加入足量的NaClO溶液(有效氯为60ppm),于25℃条件下避光反应72h;测定余氯后加适量抗坏血酸终止消毒反应,并测定DBPs的浓度.
1.3.2 检测方法 卤乙酸的测定方法是基于美国USEPA552.3法,采用液液萃取联合酸性甲醇酯化法.GC/MS分析条件:进样口温度210℃,不分流进样;升温程序:初始温度35℃ ,保持8min,以8℃/min升温至200℃,保持4min.载气为高纯氦,总流量50mL/min,吹扫流量3mL/min.质谱接口温280℃,EI源,离子源温度230℃,SIM扫描模式.
三氯甲烷采用正己烷为萃取剂进行液液萃取,取上部有机相进样GC-ECD检测.GC检测条件:进样口温度为180℃,不分流进样;升温程序:初始温度35℃,保持5min,以8℃/min升至100℃,保留2min,以20℃/min升至200℃,保留1min.ECD温度250℃.载气为高纯氮,总流量为50mL/min,吹扫流量3mL/min.
2 结果与讨论
2.1 色氨酸消毒副产物生成势
色氨酸由于其侧链的吲哚杂环结构具有一定程度的不饱和性和不稳定性,较易生成卤乙酸和三卤甲烷,初始浓度200mg/L的色氨酸配水体系氯消毒试验共检测出三氯甲烷、一溴二氯甲烷和二溴一氯甲烷三种THMs,二氯乙酸和三氯乙酸两种HAAs,生成势见表1.纯水体系中三氯甲烷的生成势为10.5mmol/mol,二氯乙酸和三氯乙酸生成势为47.9,74.9mmol/mol,卤乙酸的生成势高于三氯甲烷.在自来水和原水体系中,除了大量检出三氯甲烷、二氯乙酸和三氯乙酸外,溴代消毒副产物也有生成.一溴二氯甲烷生成势均为0.18mmol/mol,二溴一氯甲烷生成势为0.29mmol/mol和0.30mmol/mol.可见所检测原水体系中存在溴化物,导致溴代消毒副产物的产生,而纯水配水体系没有溴和碘等化合物存在,故没有检出高毒的溴代和碘代消毒副产物[17].该生成势表明色氨酸是三氯甲烷和卤乙酸的主要前驱物,毒性偏高的卤乙酸产量更高.
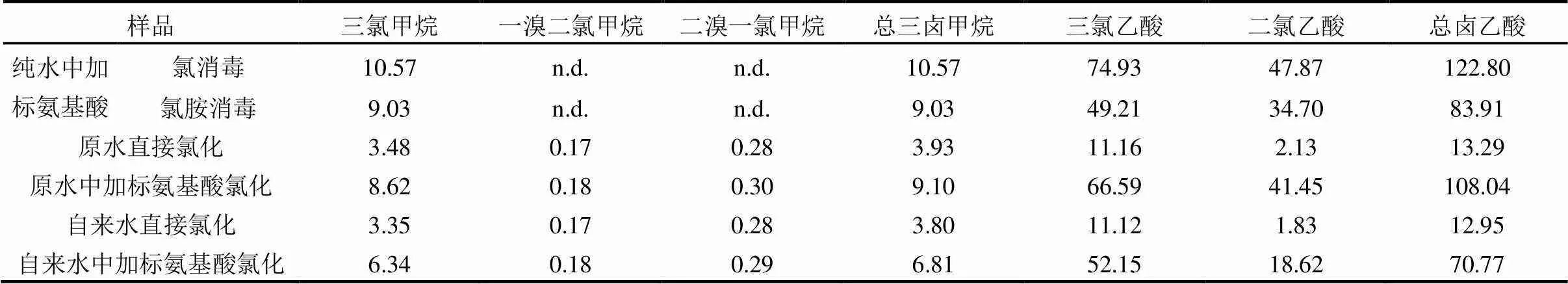
表1 色氨酸氯化消毒副产物生成势(mmol/mol)
注:n.d表示未检出;氨基酸加标量均为10mg/L;生成势的单位mmol/mol,分母以有效氯计算.

表2 原水水质
原水和自来水加标10mg/L浓度的色氨酸,总三氯甲烷生成势分别为9.10mmol/mol和6.81mmol/ mol,三氯乙酸生成势为66.6mmol/mol和52.1mmol/ mol,二氯乙酸生成势为41.4mmol/mol和18.6mmol/ mol.其值均低于纯水反应体系,可能是原水和自来水中存在一定浓度的氨氮,与次氯酸钠反应行成氯胺,降低了有效氯浓度,因此消毒副产物生成势低于纯水体系.
2.2 色氨酸衍生THMs和HAAs的路径解析及产率分析
色氨酸在所有氨基酸中的耗氯量是最高的[15],推测色氨酸中吲哚杂环是主要的耗氯结构.结合参考文献并根据GC-MS的消毒副产物鉴定结果,对色氨酸氯化生成三氯甲烷和卤乙酸的途径进行解析.
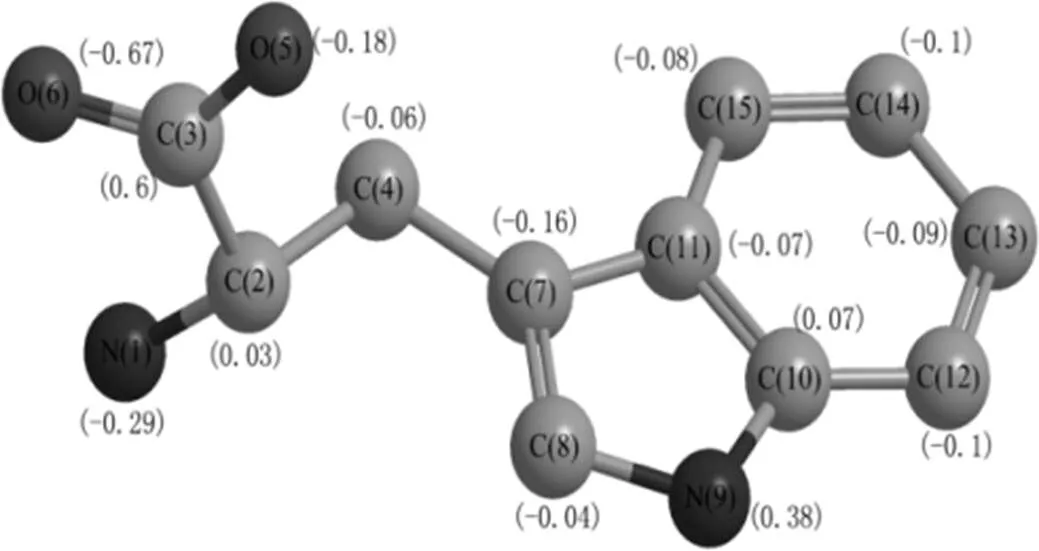
图1 色氨酸原子电位
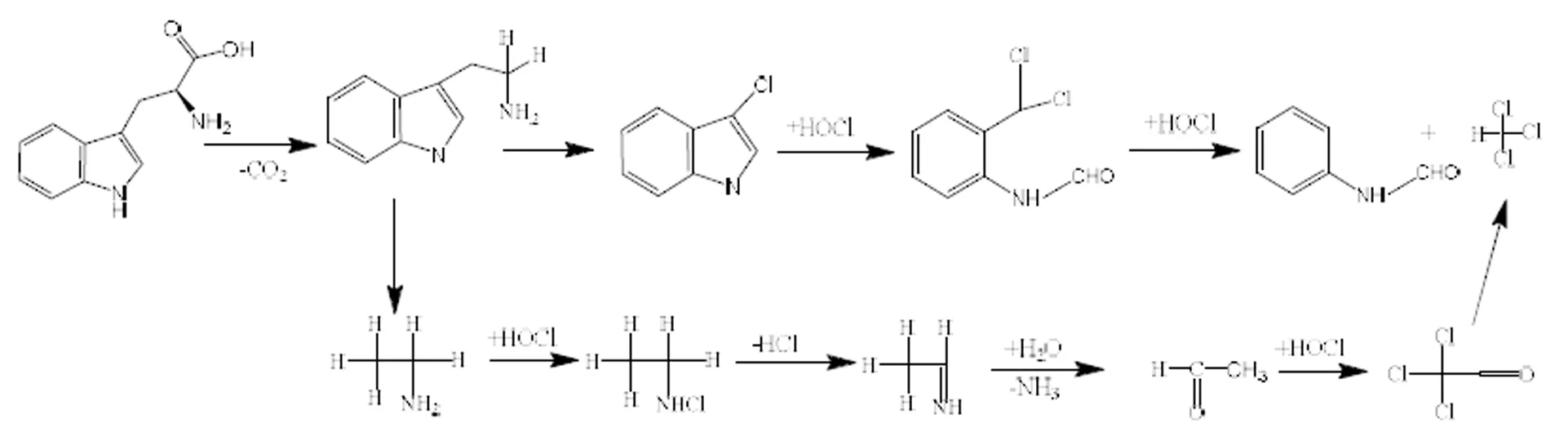
图2 色氨酸氯化生成THMs可能反应途径[20-21]
图1为色氨酸的原子电位图[18].由图1可知C2-C3之间的电位差较大,容易断裂,推测色氨酸在次氯酸钠作用下首先脱去一分子CO2生成色胺,之后C4和C7之间的键断开,生成乙胺和氯代吲哚.乙胺中氮原子在受到亲电试剂、卤化试剂等的进攻后,会发生消去反应,生成亚胺[19].本文推测乙胺上的氨基被氯取代生成N-氯代胺,消去氯化氢后形成C=N双键,生成亚胺,亚胺通过脱去一分子NH3生成乙醛,进一步被氯取代成卤代醛,其在溶液中不稳定,易分解成三卤甲烷.氯代吲哚中的五元杂环性质较活泼,容易发生亲电取代反应和开环反应[15].经过不断取代和开环,生成含有三氯甲基的基团,三氯甲基具有强烈的吸电子诱导效应,因此含有三氯甲基的C-C键断开生成三氯甲烷和N-苯基甲酰胺,色氨酸氯化生成THMs的途径[20]解析见图2.
色氨酸氯化反应生成HAAs,反应途径见图3.色氨酸在氯化和脱羟基作用后,形成不饱和键, HOCl与氰基类化合物发生加成反应,生成的含氮氯酰胺不稳定,迅速在水中水解,生成最终产物HAAs[15].
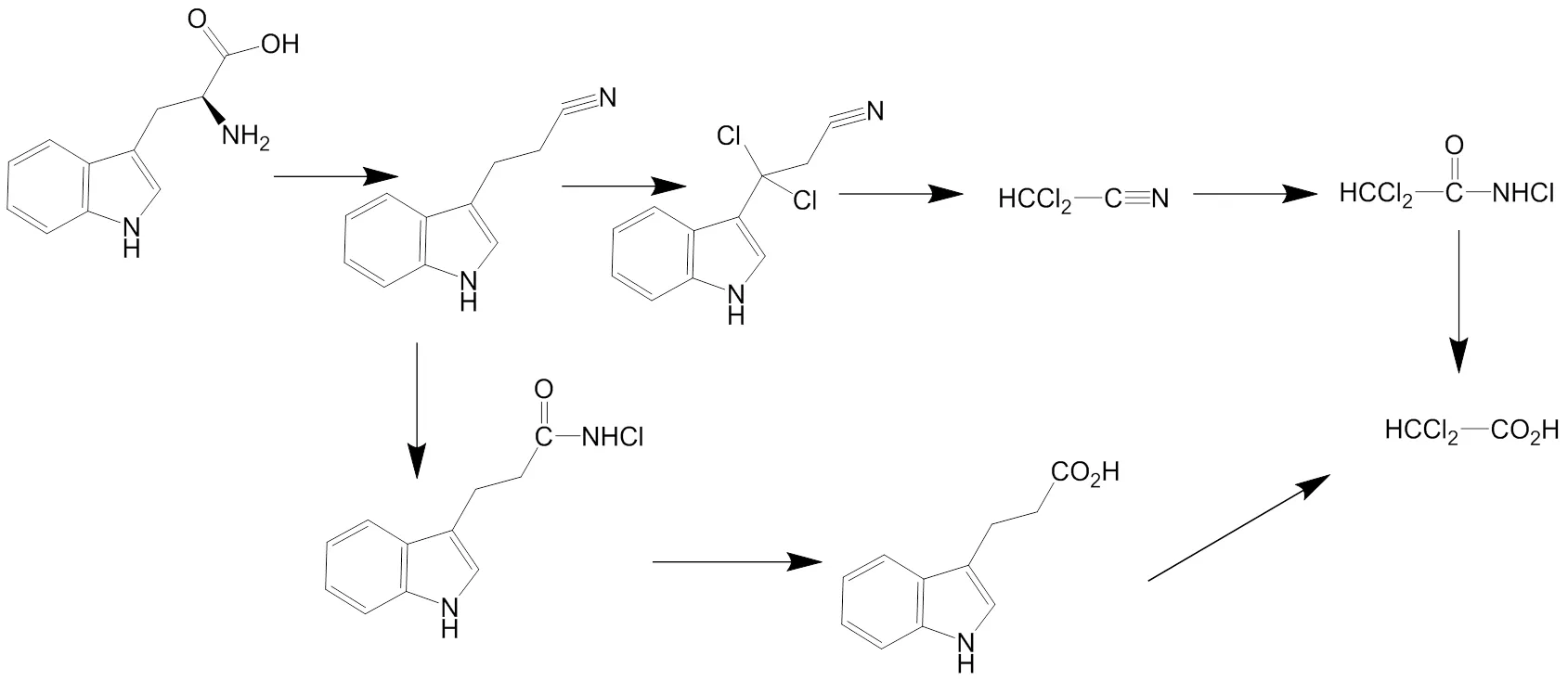
图3 色氨酸氯化生成HAAs反应途径[20,22-23]
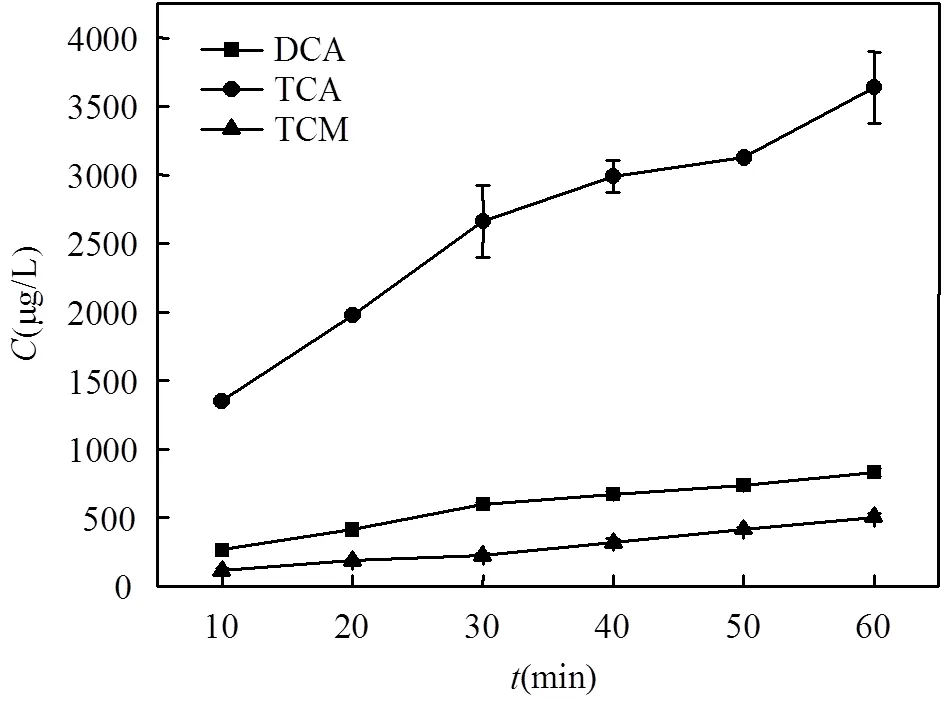
图4 色氨酸氯消毒过程中产生THMs和HAAs变化趋势
如图4所示,随着消毒时间延长,三氯甲烷的产生量缓慢增加,30min时,其生成量为225.9μg/L.二氯乙酸产量随时间的增长趋势与三氯甲烷类似,但产生量较三氯甲烷高,30min产量为602.2μg/L.与前两种消毒副产物相比,三氯乙酸具有较高的生成速率和生成量,反应30min产量为2660.6μg/L.三氯甲烷的生成量低于卤乙酸,二氯乙酸的生成量为其3倍左右,三氯乙酸的生成量约为其10倍,进一步印证色氨酸消毒过程中,三氯甲烷的生成势低于卤乙酸.
2.3 色氨酸氯化衍生THMs和HAAs的影响因素分析
2.3.1 加氯量 加氯量对色氨酸产生THMs和HAAs的影响见图5.三氯甲烷,二氯乙酸和三氯乙酸的生成量都随着氯氮比的增加而不断增加,当氯与色氨酸物质的量比从10:1上升至50:1时,三氯甲烷的生成量由225.9μg/L升高至687.5μg/L,增加了3倍左右.二氯乙酸和三氯乙酸的生成量分别由602.2和2660.6μg/L升至 1280.5,4470.5μg/L,产量增加了近2倍.
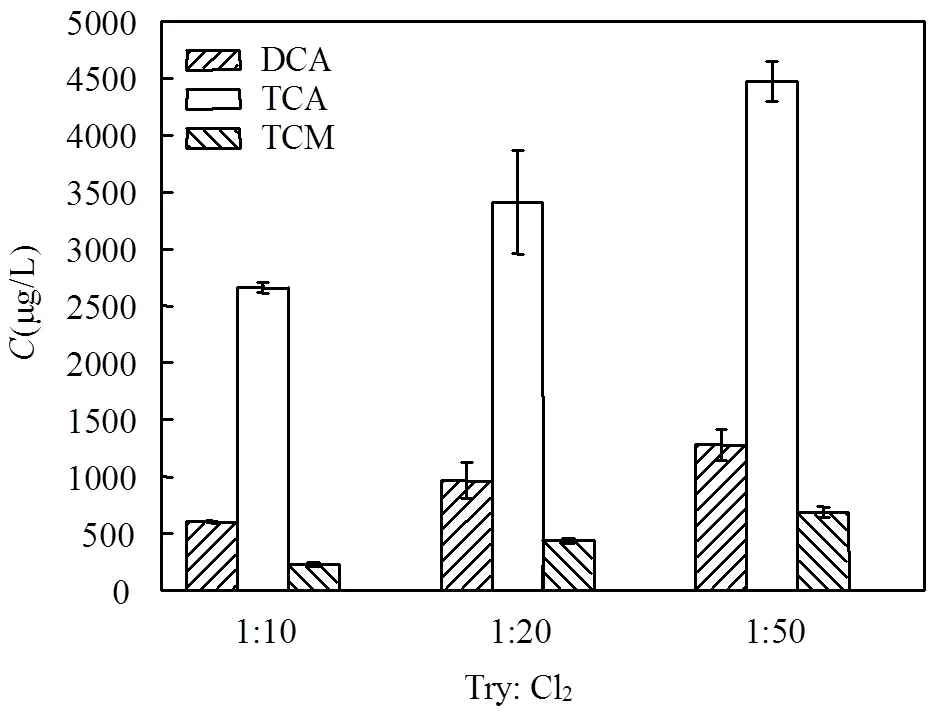
图5 色氨酸氯化30min时不同氯氮比对消毒副产物的影响
氯化消毒时,氯投加量存在极限值,在这个极限值的范围内,由于氯不足,随着投氯量的增加,消毒副产物量也增加.因为色氨酸含氯的一端在次氯酸作用下不断进行氯代生成三氯甲基,含氯量越多,氯代生成三氯甲基的量也就越多,连接三氯甲基的C-C键断开即可生成THMs,同理,有效氯浓度的增大,使得更多的氯参与到反应当中,加强了氯的氧化和取代作用,促进HAAs的产量增加,因而加氯量的增加对于THMs和HAAs的生成有十分明显的促进作用.
2.3.2 温度 图6为色氨酸氯化衍生三种主要THMs和HAAs受温度影响情况.可见二氯乙酸和三氯乙酸的生成量随着温度的增加呈现先增加后减少的趋势,20℃时产生量最大,分别为602.3和2660.6μg/L,是30℃时产量的3.3倍和3.5倍左右.三氯甲烷的生成量随温度升高呈现了逐渐增长的趋势,10℃与20℃时相差不大,为250μg/L左右,30℃时的生成量最大,为417.9μg/L,约为前者2倍.由此可见,选择合适的温度可实现不同类型THMs或HAAs的生成抑制.
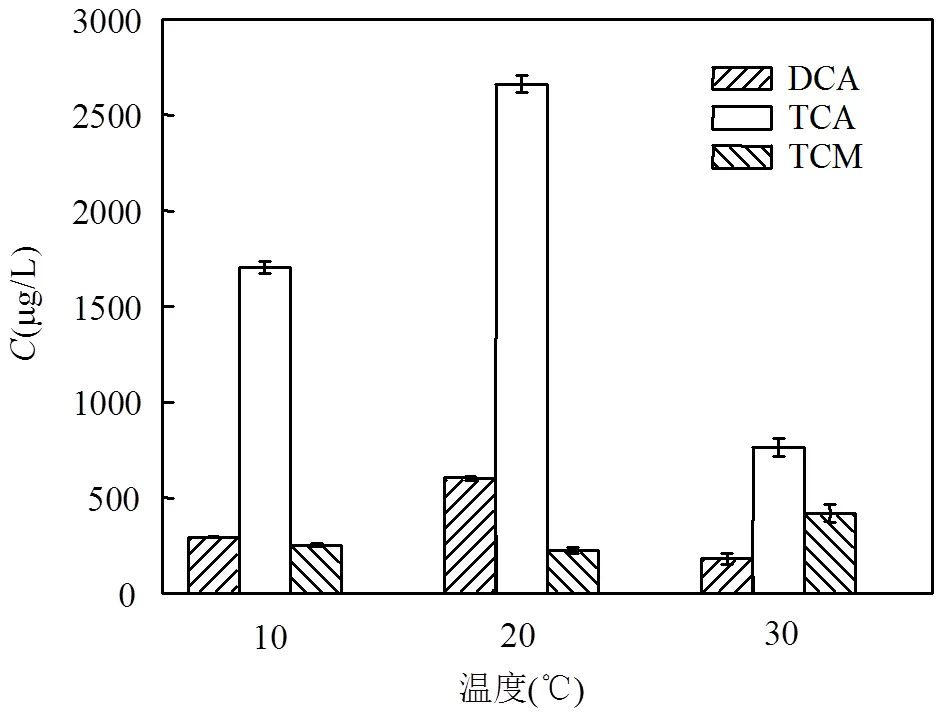
图6 30min时不同温度对色氨酸氯化衍生受控消毒副产物的影响
色氨酸氯化过程为吸热反应,温度升高会增加反应物之间的反应动能,因而会加快反应物的生成,增加产物的生成量,所以温度升高,HAAs的生成量增加.但温度升高,次氯酸钠的挥发和分解较快,减少了参与反应的有效氯,对HAAs的生成产生一定负面影响.此外HAAs存在水解反应[24],为吸热反应, 温度较高时水解反应正向进行,导致了HAAs部分水解,降低了HAAs的生成量.THMs不存在水解的问题[25],理论上在一定温度条件下,会随着温度的升高而加快反应.尽管三氯甲烷极易挥发,但操作时间较短,且反应在密闭容器内进行,可忽略其挥发的量.而相对于次氯酸钠的减少量,三氯甲烷随温度升高而增加的量可能更高.关于温度对不同产物的影响差异,还有待进一步研究.
2.3.3 pH值 图7为反应pH值对色氨酸氯化衍生三氯甲烷,二氯乙酸和三氯乙酸的影响.由图可见,pH值对三种消毒副产物生成量的影响很大,均随着pH值的升高而增加,当pH值从6升高至8时,三氯甲烷、二氯乙酸和三氯乙酸的生成量分别由86.8μg/L升至 390.3μg/L,30.1μg/L至 4006.0μg/L, 830.6μg/L至9456.6μg/L.三氯甲烷增加了4.5倍左右,二氯乙酸的产生量增加了近133倍,三氯乙酸的产生量增加了11.4倍.
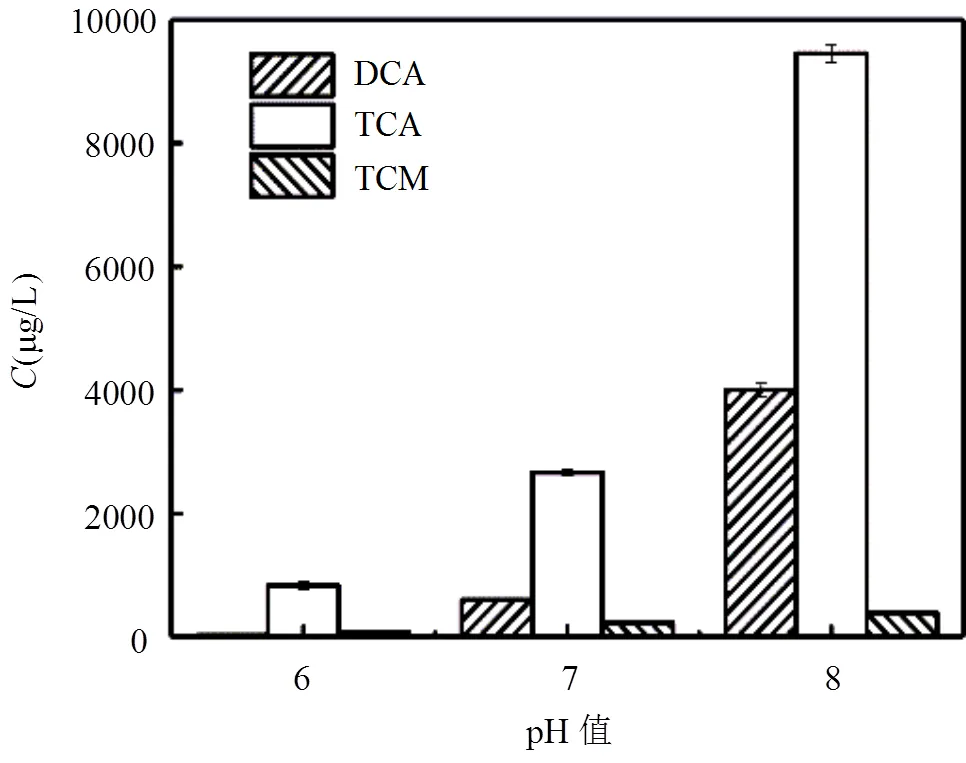
图7 30min时不同pH值对色氨酸氯化衍生受控消毒副产物的影响
由于酸性条件对卤乙酸的生成具有抑制作用,故pH值增大能促进HAAs的生成,但在碱性较大时会促进卤乙酸的水解[26],故在pH值很大和很小的条件下,HAAs生成量都会降低.本文选择了制水过程中pH值的常见变化范围进行研究,更具有实际应用意义,且与Hu等[27]以及Hua等[28]的研究结果相一致.酸性条件下氯主要以HClO形式存在,对色氨酸氧化作用强于取代作用;碱性条件下溶液中ClO–为主要存在形式,ClO −的氧化能力不是很强,氯化过程中取代作用强于氧化作用[29],因此pH值升高三氯甲烷产量略有提高.且高pH值能够提高三氯甲烷和卤乙酸前体物和消毒剂的反应活性,发生开环等反应,促进中间产物分解[26].因此,一定范围内pH值的增加对于THMs和HAAs的生成有十分明显的促进作用.
2.3.4 氨氮 原水中存在较高含量氨氮时,氯会与氨氮反应生成氯胺,氯胺氧化能力较弱,灭菌能力不及自由氯,它在短时间内的消毒效果不如次氯酸钠,但是其自身衰减缓慢,可以充分保证管网中的持续消毒能力[30],图8为氨氮存在下,色氨酸氯化衍生常规消毒副产物的情况.
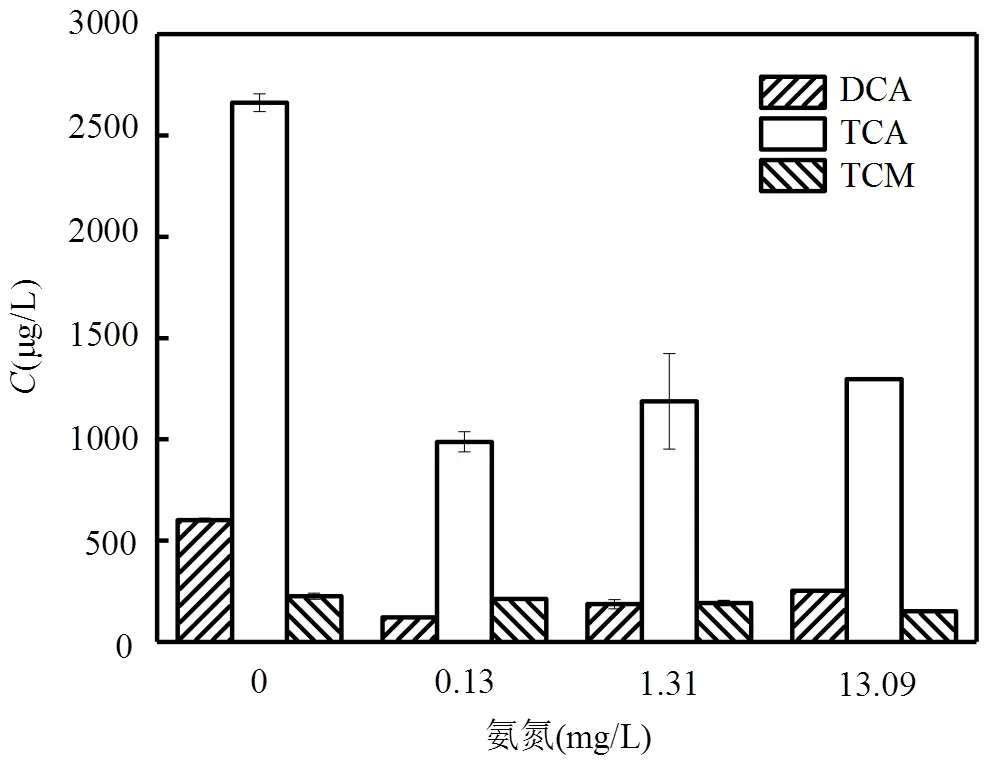
图8 氨氮对色氨酸氯化衍生受控消毒副产物的影响
由图8可知模拟氯胺消毒时,卤乙酸类消毒副产物仍为主要产物[31].二氯乙酸和三氯乙酸的生成量明显减少.0.13mg/L的氨氮存在条件下,二氯乙酸的生成量122.1μg/L,为氯消毒时的五分之一,三氯乙酸的生成量为987.6μg/L,为氯消毒时产量的三分之一.三氯甲烷的生成量也有所减少,为213.07μg/L.在氯胺消毒的过程中,二氯乙酸和三氯乙酸的生成量都随着氨氮含量的增加略有增加,三氯甲烷的量没有显著变化.由此可见,氯胺消毒可有效减少HAAs的生成[32],但氯胺量越大,HAAs的产生量也会有所增加.因为氯胺浓度的增加,有效氯浓度增大,使得更多的氯参与到反应当中,加强了氯的氧化和取代作用,促进HAAs的产量增加.三氯甲烷的变化与氯胺特性有关,副产物的生成主要是次氯酸与水中的前体物反应的结果,而氨氮投加量的增加,使次氯酸钠优先与其反应,生成氯胺,氯胺的稳定性强,其降解产生次氯酸的速度有限,因此随着氨氮量的增加,三氯甲烷的浓度也没有显著变化[30].
2.3.5 光照氯取代反应受到光照的影响,由图9可知,遮光可明显降低消毒副产物的生成,二氯乙酸从602.2μg/L减少至255.5μg/L;三氯乙酸从2660.6μg/L减少至1799.5μg/L.光照条件存在着光化学降解,对反应有一定的催化作用,可使化合物的结构发生了某种变化,如断键,取代等,形成一些新的化合物[33],会增加消毒副产物的形成.
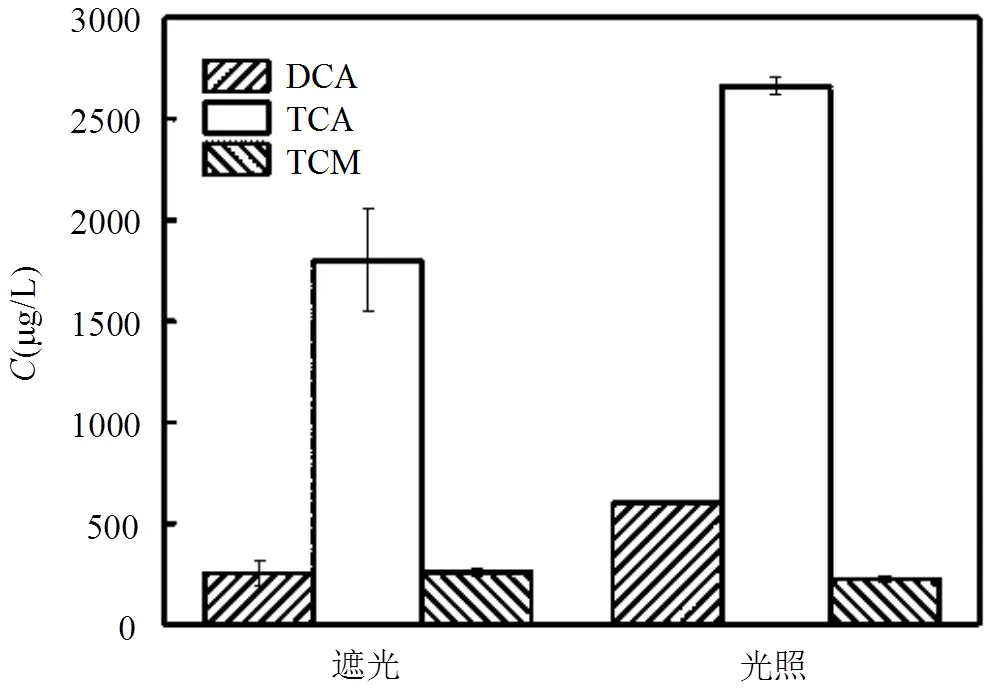
图9 光照对色氨酸氯化衍生受控消毒副产物生成量的影响
3 结论
3.1 色氨酸在氯化过程中随着反应时间,有效氯的增加和pH的增加(pH6-8), HAAs和THMs的生成量也相应增加.控制消毒时间,适当的氯氮比和合适的pH可有效控制HAAs和THMs的生成;
3.2 低温可减少三氯甲烷的生成,高温会促进卤乙酸的水解,因此合适的反应温度下,可有效减少HAAs和THMs的生成量;
3.3 氯胺消毒和遮光条件下可明显减少THMs和HAAs的产生量,大约减少50%.
色氨酸作为含氮前体物会生成毒性更高的含氮消毒副产物,对于含氮消毒副产物的毒性,生成势及其生成机理仍是目前领域内的热点之一,有待进一步研究讨论.
[1] Lyon B A, Milsk R Y, DeAngelo A B, et al. Integrated chemical and toxicological investigation of UV-chlorine/chloramine drinking water treatment [J]. Environmental Science and Technology, 2014,48(12): 6743-6753.
[2] 李林林,刘佳蒙,宋弼尧,等.饮用水中典型微生物消毒过程中消毒副产物的生成规律 [J]. 中国环境科学, 2016,36(12):3631-3638.
[3] Chen Z, Valentine R L. The influence of the pre-oxidation of natural organic matter on the formation of N-nitrosodimethylamine (NDMA) [J]. Environmental Science and Technology, 2008,42(14):5062-5067.
[4] 姚 昕,朱广伟,秦伯强.太湖北部水体溶解性氨基酸分布特征及其环境意义[J]. 中国环境科学, 2010,30(10):1402-1407.
[5] Chow A T, Lee S T. Litter contributions to dissolved organic matter and disinfection byproduct precursors in California Oak woodland watersheds [J]. Journal of Environmental Quality, 2009,38(6):2334-2343.
[6] Mengting Yang, Xiangru Zhang. Current trends in the analysis and identification of emerging disinfection byproducts [J]. Trends in Environmental Analytical Chemistry, 2016,10:24–34.
[7] 宋亚丽,邓 靖,冯 娇,等.色谱-质谱联用法识别饮用水中新型含氮消毒副产物氯代亚胺[J]. 质谱学报, 2016,37(2):156-162.
[8] Chu Wenhai, Li Dongmei, Gao Naiyun, et al. Comparison of free amino acids and short oligopeptides for the formation of trihalomethanes and haloacetonitriles during chlorination: Effect of peptide bond and pre-oxidation [J]. Chemical Engineering Journal, 2015,281(1):623-631.
[9] Zeng T., W. A. MitchImpact of nitrification on the formation of N- nitrosamines and halogenated disinfection byproducts within distribution system storage facilities [J]. Environmental Science and Technology, 2016,50(6):2964-2973.
[10] Li Changjun, Gao Naiyun , Chu Wenhai, et al.Comparison of THMs and HANs formation potential from the chlorination of free and combined histidine and glycine [J]. Chemical Engineering Journal, 2017,307:487–495.
[11] U.S. EPA method 552.3. Determination of haloacetic acids anddalapon in drinking water by liquid-liquid microextraction, derivatization and gas chromatography with electron capture detection [S].
[12] Zhang Ying , Zhang Ning, Zhao Peng , et al. Characteristics of molecular weight distribution of dissolved organic matter in bromide-containing water and disinfection by-product formation properties during treatment processes [J]. Science Direct, 2017,3:1-11.
[13] USEPA, Economic analysis for the final stage 2disinfectants and disinfection byproducts rule [M]. Washington, DC, BiblioGov 2013:241.
[14] 王 超,胡洪营,王丽莎.典型含氮有机物的氯消毒副产物生成潜能研究[J]. 中国给水排水, 2006,22(15):9-12.
[15] Hong H C, Wong M H, Liang Y. Amino acids as precursors of trihalomethane and haloacetic acid formation during chlorination [J]. Archives of Environmental Contamination and Toxicology. 2009,56(4): 638-645.
[16] 楚文海,高乃云,赵世嘏,等.在饮水中典型溶解性有机氮酪氨酸氯化生成氯仿的机理分析[J]. 化学学报, 2009,(21):2505-2510.
[17] Jeong C H, Postigo C, Richardson S D, et al. Occurrence and comparative toxicity of haloacetaldehyde disinfection byproducts in drinking water [J]. Environmental Science and Technology, 2015, 49(23):13749-13759.
[18] 陈新波.水体中氨基酸氯化生成常规及碘代三卤甲烷的研究[D]. 杭州:浙江大学, 2017.
[19] Fields S C, Parker M H, Erickson W R. ChemiInform abstract: A simple route to unsymmetrically substituted 1,2,4,5-tetrazines [J]. ChemInform, 1995,59(35):8284-8287.
[20] 李 安.氨基酸的氯化消毒副产物生成势及途径[D]. 哈尔滨, 哈尔滨工业大学, 2011.
[21] Blatchley E R, Margetas D, Duggirala R. Copper catalysis in chloroform formation during water chlorination [J]. Water Research, 2003,37(18):4385-4394.
[22] 徐 倩,徐 斌,高乃云,等.水中典型含氮有机物氯化生成消毒副产物的潜能研究[J]. 环境科学, 2011,32(7):1967-1973.
[23] Yang Xin, Shen Qianqian, Guo Wanhong, et al. Precursors and nitrogen origins of trichloronitromethane and dichloroacetonitrile during chlorination/chloramination [J]. Chemosphere, 2012,88:25-32.
[24] Levesque S, Rodriguez M J, Serodes J, et al. ProulxEffects of indoor drinking water handling on trihalomethanes and haloacetic acids Water Research, 2006,40:2921-2930.
[25] Hong Huachang, Xiong Yujing, Ruan Mengyong, et al. Factors affecting THMs, HAAs and HNMs formation of Jin Lan Reservoir water exposed to chlorine and monochloramine [J]. Science of The Total Environment, 2013,444:196-204.
[26] Chu Wen Hai, Gao Nai Yun, Deng Yang, et al. Formation of chloroform during chlorination of alanine in drinking water [J]. Chemosphere, 2009,77:1346–1351.
[27] Hu J, Song H, Karanfil T. Comparative analysis of halonitromethane and trihalomethane formation and speciation in drinking water: the effects of disinfectants, pH, bromide, and nitrite [J]. Environmental Science and Technology, 2010,44(2):794-799.
[28] Hua G, Reckhow D A. Evaluation of bromine substitution factors of DBPs during chlorination and chloramination [J]. Water Research, 2012,46(13):4208-4216.
[29] Chen Z, Yang C Y, Lu J. Factors on the formation of disinfection by-products MX, DCA and TCA by chlorination of fulvic acid fromlake sediments [J]. Chemosphere, 2001,45:379-385.
[30] 张民盛,徐 斌,张天阳,等.南水北调丹江口水库水氯(胺)化消毒副产物产生特性与消毒工艺对比[J]. 环境科学, 2015,36(9):3278- 3284.
[31] Aleksandra Szczuka, Kimberly M, Cassandra Harvey, et al. Regulated and unregulated halogenated disinfection byproduct formation from chlorination of saline groundwater [J]. Water Research, 2017,122:633-644.
[32] Tian C., Liu R., Liu H., et al. Disinfection by-products formation and precursors transformation during chlorination and chloramination of highly-polluted source water: significance of ammonia [J]. Water Research, 2013,47:5901–5910.
[33] Wu F, Mills R, Evans R, et al. Kinetics of metal-fulvic acid complexation using a stopped-flow technique and three-dimensional excitation emission fluorescence spectrophotometer [J]. Analytical Chemistry, 2004,76(1):110-113.
Generation characteristics of THMs and HAAs during tryptophan chlorination in aqueous system.
CHEN Dan-wen1, HUANG Fu1, ZHU Shi-cui1, YU Qi1, YU Jian-quan1, LI Xiao-min2, MA Xiao-yan1*
(1.Municipal Engineering of Architecture Engineering College, Zhejiang University of Technology, Hangzhou 310014, China;2.College of Environment, Hohai University, Nanjing 210098, China;3.Hangzhou Station, National Water Supply Network Water Quality Monitoring Station, Hangzhou 310014, China)., 2018,38(11):4061~4067
The occurrence of dissolved nitrogenous organic compounds represented by amino acids (AAs) is ubiquitous in aqueous system, especially in water source. AAs were reported to be the precursors of disinfection by-products during water production processes. In this paper, tryptophan (Try) was selected as a model nitrogenous precursor to investigate the generating pathway and influencing factors of the regulated disinfection by-products trichloromethanes (THMs) and haloacetic acids (HAAs) during chlorination process. The results showed that Trp can generate HAAs and THMs through a series reactions including substitution, decarboxylation and hydrolysis. The formation of THMs and HAAs increased gradually as chlorination time and chlorine dosage increased; With the increase of temperature, the amount of HAAs increased first and then decreased; Alkaline promoted the production of THMs and HAAs; Chloramine and shading condition remarkably inhabited the production of general disinfectionby-products.
chlorination;tryptophan;disinfection by-products;haloacetic acid;trichloromethane
X52,TU991.2
A
1000-6923(2018)11-4061-07
陈丹雯(1994-),女,浙江嘉兴人,硕士研究生,研究方向零价铁对水中污染物的去除.
2018-04-22
国家自然科学基金项目(51678527,51878582);浙江省自然科学基金(LY16E080007)
* 责任作者, 教授, mayaner620@163.com

