生物质固体废物厌氧发酵过程中HS对产CH4作用研究进展
杨天学,李英军,赵 颖,张列宇,黄彩红,李东阳,余 红,李 琦,席北斗*
生物质固体废物厌氧发酵过程中HS对产CH4作用研究进展
杨天学1,李英军2,赵 颖1,张列宇1,黄彩红1,李东阳1,余 红1,李 琦1,席北斗1*
(1.中国环境科学研究院,北京 100012;2.北京农业职业学院,北京 100012)
针对生物质固体废物量大面广,具有污染和资源利用双重特性,厌氧发酵能源化可促进其污染控制,且过程中部分有机成分在微生物作用下转化成腐殖质(HS).通过分析厌氧发酵过程中HS转化规律、HS结构特征与氧化还原性能、腐殖质还原菌与产甲烷菌活性、产CH4效率之间的响应关系和作用机制研究进展,总结凝练出生物质厌氧发酵系统内HS对CH4的调控原理,为减少厌氧发酵系统内HS对产CH4途径的抑制作用,提高发酵效率的技术研究提供理论支撑.
腐殖质;生物质;厌氧发酵;CH4;抑制作用
生物质固体废物主要包括城市生物质废物(家庭厨余垃圾、餐厨垃圾、城市粪便以及城镇污泥等)、农作物废物(玉米秸、麦秸和稻秸等)、禽畜粪便.最新统计数据显示,我国仅农作物废物年均产量为 6.88×108t,资源能源总量为8.89×1015kJ,相当于3.04× 108t标准煤[1].生物质固体废物具有污染和资源再生利用双重特性,大量生物质随意堆放或露天焚烧,不仅造成资源浪费,也对环境造成影响,但通过强化能源化和资源化利用,可促进其污染控制.厌氧发酵产沼获取生物能源是促进生物质固体废物由污染特性向资源能源化转变的重要途径之一[1],该方法使生物质固体废物在受控条件下进行生物发酵,产生沼气能源和有机肥料[4],发酵过程中不需要供应氧气和能源[5].
腐殖质(HS)是动植物残体通过复杂的生物、化学作用形成的,广泛存在于厌氧环境中,目前已经在河湖底泥、海洋沉积物、市政污泥、生活垃圾填埋场等厌氧环境中发现了HS[6].
在开展人工控制厌氧产沼实验中也检测到了HS,李怀[7]在利用厌氧序批式反应器处理污泥时,通过对胞外聚合物成分分析发现,HS为胞外聚合物的主要成分之一,含量处于50~70mg/L.在高含固生物质干式厌氧发酵系统内也检测到HS,本研究团队通过三维荧光光谱检测发现,秸秆干式厌氧发酵系统内存在HS,且其结构逐渐向复杂化转变[8];祝其丽等[9]通过红外光谱仪对牛粪干式厌氧发酵基质进行特征分析发现,厌氧发酵90d后HS含量达到17%左右.
本文首先简要介绍了HS形成机理与结构特征,然后详细综述了近年来关于HS氧化还原特性,以及在厌氧条件下HS对产CH4效率的抑制作用、腐殖质还原微生物等领域的研究进展及存在的问题,并指出未来厌氧发酵体系内HS对产甲烷途径影响的重点研究方向.
1 HS形成机理及结构特征
HS形成是一个非常复杂的过程,目前关于其形成方式主要有植物转化、化学聚合、细胞自溶和微生物合成4种假说[10],其中植物转化假说从相对宏观的角度,分析了HS的来源,提出HS由植物残体中不为微生物分解的组分转化而来;化学聚合假说则从化学合成的角度,提出HS是复杂有机物经微生物作用后部分矿化,再经氧化和缩合等作用形成单体HS,最终形成高分子HS;细胞自溶假说则从细胞学的层面,认为HS由微生物自溶后的产物经过缩合和聚合后形成;微生物合成假说提出微生物在体内合成HS,死亡后将HS自溶析出.虽然目前仍无法确定哪种猜测最好,但都具有一定的科学性,只是分析的角度与层面不同,也可能是4种过程同时进行而形成HS.

图1 HS结构示意
通过对HS组成研究发现,HS元素组成主要为C、H、O、N和S,相对分子量从几千至几十万不等,C/H在90~15,含碳(45%~70%)、氢(2%~6%)、氧(30%~50%)和氮(1%~6%)[11].HS的内在结构一直为研究热点和难点,早期研究构建的HS分子模型主要有Flaig(1960)的HS模型、Stevenson(1982)的HS模型以及Schnitzer和Khan(1972)的FA模型[12],但由于HS的复杂性和非均匀性,对其结构的认识尚未形成统一意见,仍需不断深化.随着现代仪器分析手段的快速提高,通过大量质谱分析、热裂解、傅里叶红外光谱分析、氧化还原、扫描电镜等其他化学分析手段,逐渐建立了HS大分子的结构模型(图1)[13],该模型认为HS含有大量羧基、羟基、羰基、胺基等功能组分,其中以羧基和酚羟基最重要,许多络合物常由这两种功能基配合进行;HS不仅含有大量的苯环、稠苯环和多种杂环,各环之间通过桥键作用相连,且在各种环和支链上还有羧基、醇基、酚羟基、酮基、甲氧基、胺基等官能团[14],这些基团使HS具有酸性以及较强的离子交换、吸附和络合等能力[15].
2 HS氧化还原能力及机理
HS分子为高分子化合物,由于其具有还原能力,近年来受到众多学者的关注.研究发现,醌、酚等官能团是HS具有还原性的重要原因[16-17],尤其是醌基团在电子传递中起到了重要作用[18-19],还原态醌基是HS还原能力的主要来源[20-21],在甘油醛降解过程中, HS醌基作为电子受体,加速了甘油醛-3P→d-甘油酸1,3-二磷酸酯和丙酮酸酯→乙酰辅酶A的生物氧化反应进程[22].机理研究发现,HS氧化还原过程是还原态HS将电子转移给目标物使之还原,还原态的HS重新转化为氧化态(图2).基于这一机制,众多研究人员开展了HS还原重金属和有机物的研究,结果表明,HS先与Fe3+/Fe2+形成配合物,使Fe3+/Fe2+氧化还原电位降低,加速了其还原速率,从而直接将Fe3+还原为Fe2+[23],随后HS与Fe2+紧密结合形成HS-Fe2+配合物[24],对更多无机和有机污染物具有还原作用,如在HS和溴酸盐体系中添加Fe3+可以形成HS-Fe3+,促进对溴酸盐的还原作用.另外,HS也能作为还原剂将高毒性的Cr6+还原成低毒性的Cr3+[25].另有研究结果表明,HS不仅在好氧状态下具有还原特性,在厌氧条件下还原性能更佳[26],基于这一发现,Sundman等[27]研究发现HS可以提高Fe3+还原效率,且厌氧环境中HSox/HSred周转加速[28].
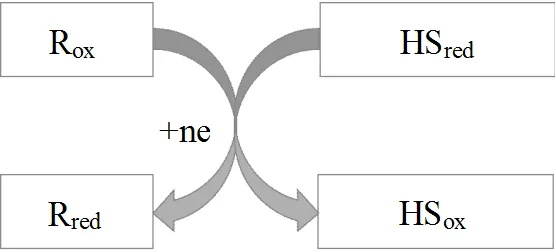
图2 HS还原氧化物电子传递原理
通过对HS氧化还原过程机理研究表明,在发挥氧化还原作用时,通过电子穿梭作用, HSox先接受由电子供体传递来的电子被还原为HSred,随后通过传递作用,HSred将电子传递给电子受体,自身又被氧化成HSox,从而构成完整的氧化还原循环(图3)[29-30].Roden等[30]研究发现在添加有Fe3+和含HS的沉积物系统内,电子供体将电子转移给沉积物的固相HS,固相HS通过将电子从细菌穿梭到氧化物表面,从而加速了Fe3+还原;党岩等[31]研究发现垃圾渗滤液中富里酸作为电子穿梭体,加速Fe3+还原菌向FeO(OH)传递电子的效率,随后由于富里酸中氧化态醌结构与还原态对苯二酚发生可逆电子传递循环转化,实现了富里酸的还原.
HS电子穿梭能力受体系内氧化还原电位的影响,杨浈等[32]发现厌氧体系内氧化还原电位为-0.4meq/L时,HS将自身电子传递给Fe3+,发挥还原作用将Fe3+还原,随后当体系内氧化还原电位上升为1.0meq/L时,HS又发挥氧化作用,从Fe2+中得到电子,并将其氧化,体现HS双向的氧化性和还原性; Miller等研究发现当厌氧发酵体系内氧化还原电位由16.5mV下降到-161.6mV后,HS也由先供给电子到再失去电子转变[33].

图3 HS氧化还原循环示意
3 HS对产甲烷的影响
3.1 HS对产甲烷效率的影响
有学者报道,在淹水土壤、水体沉积物等厌氧环境中,当HS存在时,产CH4过程受到抑制[34].为了证实这一发现,近年来,部分学者开展了HS抑制产CH4的模拟实验[35],结果发现HS的添加会降低CH4产率,添加70mg/L的HS厌氧发酵12h后,产CH4速率降低了42%[36];Minderlein等[37]在开展厌氧条件下泥炭释放CH4实验中,发现水溶性有机物(DOM)对产甲烷具有抑制作用,当DOM浓度为201mg/L时,DOM能使甲烷产量降低65%~75%以上.
进一步研究发现,HS来源和含量均影响其对产CH4抑制作用的大小.Keller等发现湿地中HS对产CH4具有强烈抑制作用,且不同湿地来源HS对CH4的抑制作用不相同[38-39];在HS含量对产CH4抑制作用影响方面,Ho等在开展嗜热厌氧菌厌氧消化养猪场废水实验中,当HS浓度为1g/L和5g/L时,HS对产CH4基本没影响,但当HS浓度达到10g/L时,抑制作用明显,CH4产量降低了80%以上[40];任冰倩在开展HS抑制厌氧产沼实验中发现,当系统内HS浓度低于250mg/gVSS时,随着HS浓度升高,CH4减少量增大,当HS浓度增大到350mg/g VSS时,抑制作用最为明显,CH4产量降低了11%[41].
3.2 腐殖质呼吸及其还原菌
腐殖质呼吸(Humus respiration)是近年来发现的微生物厌氧呼吸新模式,即具有HS还原能力的腐殖质还原菌通过氧化电子供体,偶联HS还原的过程(图4)[42].研究发现,腐殖质呼吸过程是通过腐殖质还原菌的作用来实现的,Szilagyi等[43]早在1971年已发现微生物可以提高HS将Fe3+还原为 Fe2+的效果,微生物存在时,HS对U(Ⅵ)的还原能力也有所提高.
为了探明厌氧环境能够提高HS还原能力的机理,部分学者开展了研究,结果发现土壤、底泥等厌氧环境中的HS还原菌是主要作用的微生物[44],且底泥沉积环境与地下厌氧环境中普遍存在的腐殖质还原混合菌可以对HS进行还原.Scott等[45]的进一步研究发现,不同来源的HS都有从HS还原微生物处得到电子的能力,还原微生物还原HS时以HS中的醌作为电子受体,产生半醌自由基.另有研究报道认为,还原态的HS可以在厌氧条件下经腐殖质还原菌将电子传递给NO3-、Fe3+等其他电子受体,从而提高HS的还原性能[46].
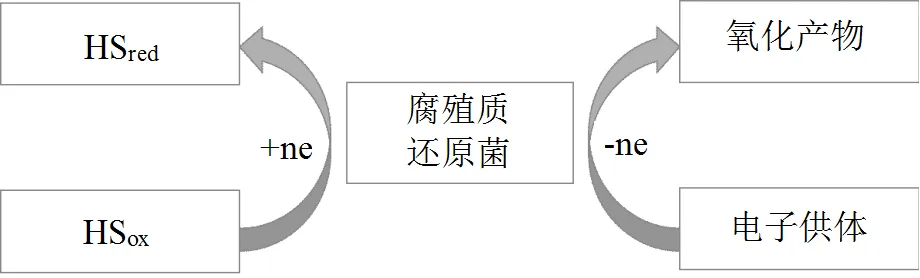
图4 腐殖质还原菌还原腐殖质示意
3.3 HS还原菌对产CH4的抑制作用
厌氧消化过程一般分为水解、酸化、产氢产乙酸和产CH4四个阶段,乙酸是产CH4的直接前体,其累积与消耗对CH4产生具有至关重要的作用(图5)[47].有研究表明,腐殖质呼吸与产CH4作用存在着生物代谢竞争作用,且腐殖质还原菌相对于产甲烷菌更具底物竞争优势,HSox/HSred作为电子穿梭体偶联其他呼吸过程(如O2呼吸、NO3-呼吸),使产CH4直接前体大量消耗,从而抑制CH4生成[48].其反应过程是HS氧化还原乙酸等小分子化合物作为电子供体,使HSox被还原为HSred[49-50].其中腐殖质还原菌活性与HS的还原能力有关,进而影响到CH4产生效率,而HS的还原能力与其自身结构有很大关系,不同来源的HS对产CH4过程的抑制效果是不一致的[51]. Khadem等[52]在开展HS对产甲烷菌活性的实验中,发现当HS浓度为1kg/m3,所有的氢营养型甲烷菌体系中甲烷产量均降低了75%以上,而乙酸分解型产甲烷菌体系中产甲烷则被完全抑制.Ye等[53]在研究HS类似物蒽醌-2,6-二磺酸盐(AQDS)对厌氧消化的影响实验中,发现AQDS对发酵具有抑制作用,使乙酸,二氧化碳,氢,CH4分别减少 98%,49%,90%和86%以上.
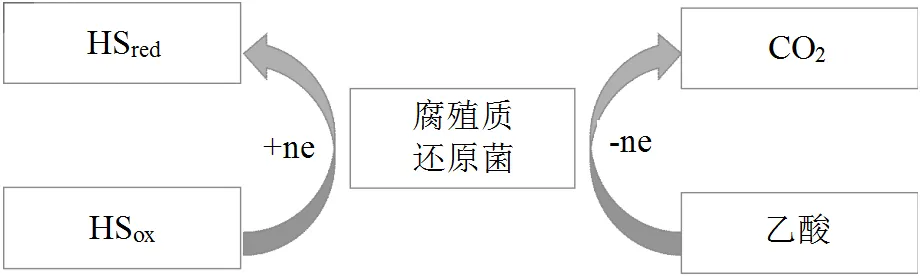
图5 腐殖质呼吸过程利用乙酸作为电子供体

图6 微生物耦合还原腐殖质和产甲烷示意
部分对腐殖质还原菌的研究结果表明,绝大多数的腐殖质还原菌属于中的Fe(Ⅲ)还原菌,能耦合氧化乙酸盐呼吸生长(图6).早在20世纪就有研究发现,产甲烷菌也具有还原HS的能力,如产CH4古细菌()能还原HS,但不能耦合生长[54];如Benze等[55]发现在厌氧条件下不仅能产CH4,还能氧化还原HS[55].许多能利用氢气的产甲烷古菌,具有还原HS的能力,Lovley等[54]发现,产CH4古细菌和在厌氧条件下不仅能产CH4,在氢气作为电子供体的情况下能氧化还原HS.我国也有研究人员在研究水稻土厌氧环境,发现在水稻土厌氧环境中不仅能促进CH4积累,还能氧化还原HS类模拟物AQDS,且能耦合呼吸生长[56].
4 展望
基于HS在厌氧条件下能够发挥还原性能,自身被氧化后可通过腐殖质还原菌的呼吸作用实现还原,但过程中需要消耗产CH4的重要前体物乙酸作为电子供体,同时部分微生物兼有还原HS和产CH4的双重功能等研究进展,可以以腐殖质还原菌为“纽带”,将“腐殖质呼吸”与“产甲烷过程”联系起来,开展“腐殖质呼吸与产CH4过程耦合机制”研究(图7).同时针对干式厌氧发酵产生的HS浓度高于湿式厌氧发酵,但有关生物质干式厌氧发酵过程中HS对产CH4的影响尚未见报,重点开展干发酵过程中HS转化规律、HS结构特征与氧化还原性能、腐殖质还原菌与产甲烷菌活性、产CH4效率之间的响应关系和作用机制等研究,阐明生物质干式厌氧发酵系统内HS抑制产CH4的调控原理,为减少厌氧发酵系统内HS对产CH4途径的抑制作用,提高发酵效率的技术研究提供理论支撑.
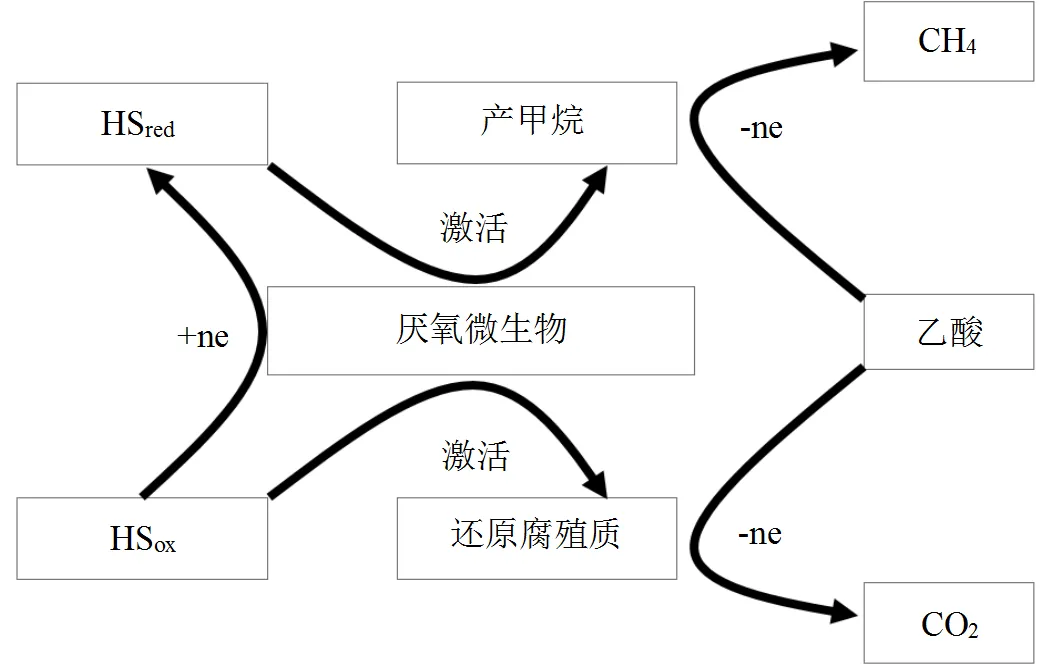
图7 腐殖质呼吸与产甲烷过程的耦合机制
5 结论
5.1 HS由于含有酚羟基、羧基、醇羟基、烯醇基、磺酸基、取代氨基、醌基、羰基、甲氧基等多种基团,使其不仅具有较强的配合和吸附能力,同时具有还原性,可通过氧化还原过程促进污染物降解,过程中HS通过电子穿梭作用,首先接受由电子供体传递来的电子,使HSox还原为HSred,随后通过传递作用,HSred将电子传递给电子受体,自身又由被氧化成HSox,从而构成完整的HS循环.
5.2 HS不仅在好氧状态下具有还原特性,在厌氧条件下还原性能更佳,而生物质厌氧发酵过程中,相关成分在微生物作用下转化成HS,随后通过腐殖质呼吸作用,发挥其氧化还原作用.
5.3 腐殖质呼吸与产CH4作用存在着生物代谢竞争作用,且腐殖质还原菌相对于产甲烷菌更具底物竞争优势,有些产甲烷菌也具有还原HS的能力,当HS存在时,腐殖质通过呼吸作用,使产CH4直接前体大量消耗,从而抑制CH4生成,其反应过程是HS氧化还原乙酸等小分子化合物作为电子供体,使HSox被还原为HSred.
[1] 曹志宏,黄艳丽,郝晋珉.中国作物秸秆资源利用潜力的多适宜性综合评价[J]. 环境科学研究, 2018,31(1):179-186.
[2] Azeem K, Muhammad A, Muzammil A, et al. The anaerobic digestion of solid organic waste [J]. Waste Management, 2011,31:1737-1744.
[3] Yang T X, Li Y J, Gao J X, et al. Performance of dry anaerobic technology in the co-digestion of rural organic solid wastes in China [J]. Energy, 2015,93:2497-2502.
[4] Jingura R M, Matengaifa R. Optimization of biogas production by anaerobic digestion for sustainable energy development in Zimbabwe [J]. Renewable & Sustainable Energy Reviews, 2009,13(5):1116- 1120.
[5] Chanakya H N, Ramachandra T, Guruprasad V, et al. Micro-treatment options for components of organic fraction of MSW in residential areas [J]. Environmental Montoring and Assessment, 2007,135(1-3): 129-139.
[6] Mayumi H, Katsumi S, Motoyuki M. Reduction process of Cr (VI) by Fe(II) and humic acid analyzed using high time resolution XAFS analysis [J]. Journal of Hazardous Materials, 2015,285:140-147.
[7] 李 怀. ASBR处理水热改性污泥的微生物学特性研究 [D]. 西安:长安大学, 2008.
[8] 杨天学.玉米秸秆干式厌氧发酵转化机理及微生物演替规律研究[D]. 武汉:武汉大学, 2014.
[9] 祝其丽,潘 科,汤晓玉,等.牛粪批次干发酵过程中腐植酸的变化趋势初探 [J]. 中国沼气, 2014,32(5):7-11+16.
[10] 宋海燕,尹友谊,宋建中.不同来源腐殖酸的化学组成与结构研究 [J]. 华南师范大学学报:自然科学版, 2009,(1):61-66.
[11] Gu B, Chen J. Enhanced microbial reduction of Cr(VI) and U(VI) by different natural organic matter fractions [J]. Geochimica Et Cosmochimica Acta, 2003,67(19):3575-3582.
[12] 彭国栋.腐殖酸对土壤汞形态分配及生物有效性的调控作用及机理研究 [D]. 重庆:西南大学, 2012.
[13] Bolton K A, Sjöberg S, Evans L J. Proton Binding and Cadmium Complexation Constants for a Soil Humic Acid Using a Quasi-particle Model [J]. Soil Science Society of America Journal, 1996,60(4): 1064-1072.
[14] 蔡茜茜,袁 勇,胡 佩,等.腐殖质电化学特性及其介导的胞外电子传递研究进展 [J]. 应用与环境生物学报, 2015,21(6):996-1002.
[15] 金鹏康.腐殖酸混凝的化学成因、形态学特征及动力学研究[D]. 西安:西安建筑科技大学, 2003.
[16] Cervantes F J , Claudia M. Martínez, Gonzalezestrella J , et al. Kinetics during the redox biotransformation of pollutants mediated by immobilized and soluble humic acids [J]. Applied Microbiology & Biotechnology, 2013,97(6):2671-2679.
[17] Yuan Y, Xi B, He X, et al. Compost-derived humic acids as regulators for reductive degradation of nitrobenzene [J]. Journal of Hazardous Materials, 2017,339:378-384.
[18] Hernández-Montoya V, Alvarez L H, Montes-Morán M A, et al. Reduction of quinone and non-quinone redox functional groups in different humic acid samples by Geobacter sulfurreducens [J]. Geoderma, 2012,183-184:25-31.
[19] Kim K M, Lee Y, Park J H, et al. Supercapacitive Properties of Composite Electrode Consisting of Activated Carbon and Di (1-aminopyrene) quinone [J]. Etri Journal, 2016,38(2):252-259
[20] Jiang T, Skyllberg U, Wei S, et al. Modeling of the structure-specific kinetics of abiotic, dark reduction of Hg(II) complexed by O/N and S functional groups in humic acids while accounting for time-dependent structural rearrangement [J]. Geochimica Et Cosmochimica Acta, 2015, 154:151-167.
[21] Wang F, Shih K, Leckie J O. Effect of humic acid on the sorption of perfluorooctane sulfonate (PFOS) and perfluorobutane sulfonate (PFBS) on boehmite [J]. Chemosphere, 2015,118:213-218.
[22] Liu K, Chen Y, Xiao N, et al. Effect of humic acids with different characteristics on fermentative short-chain fatty acids production from waste activated sludge [J]. Environmental Science & Technology, 2015,49(8):4929.
[23] Claudio C, Giuseppe P, Vincenzo M S, et al. Stability of coprecipitated natural humic acid and ferrous iron under oxidative conditions [J]. Geochemical Exploration, 2015,151(4):50-56.
[24] Ortega-Gómez E, Martín M M B, Carratalà A, et al. Principal parameters affecting virus inactivation by the solar photo-Fenton process at neutral pH and μM concentrations of H2O2and Fe2+/3+[J]. Applied Catalysis B: Environmental, 2015,174:395-402.
[25] Romo-Rodríguez P, Acevedo-Aguilar F J, Lopez-Torres A, et al. Cr (VI) reduction by gluconolactone and hydrogen peroxide, the reaction products of fungal glucose oxidase: Cooperative interaction with organic acids in the biotransformation of Cr (VI) [J]. Chemosphere, 2015,134:563-570.
[26] Castro L, Garcia-Balboa C, Felisa G, et al. Effectiveness of anaerobic iron bio-reduction of jarosite and the;influence of humic substances [J]. Hydrometallurgy, 2013,131(1):29-33.
[27] Sundman A, Byrne J M, Bauer I, et al. Interactions between magnetite and humic substances: redox reactions and dissolution processes [J]. Geochemical Transactions, 2017,18(1):6.
[28] Zhen G, Lu X, Wang B, et al. Synergetic pretreatment of waste activated sludge by Fe(II)-activated persulfate oxidation under mild temperature for enhanced dewaterability [J]. Bioresource Technology, 2012,124(9):29-36.
[29] Schmeide K, Sachs S, Bernhard G. Np(V) reduction by humic acid: contribution of reduced sulfur functionalities to the redox behavior of humic acid [J]. Science of the Total Environment, 2012,419(3):116- 123.
[30] Roden E E, Kappler A, Bauer I, et al. Extracellular electron transfer through microbial reduction of solid-phase humic substances [J]. Nature Geoscience, 2010,3(6):417-421.
[31] 党 岩.垃圾焚烧厂渗沥液中富里酸对厌氧生物处理的影响及其降解和转化研究 [D]. 北京:北京林业大学, 2016.
[32] 杨 浈.腐殖酸大小分子氧化还原能力及其氧化还原官能团的分布研究 [D]. 北京:北京林业大学, 2016.
[33] Miller K E, Lai C T, Friedman E S, et al. Methane suppression by iron and humic acids in soils of the Arctic Coastal Plain [J]. Soil Biology & Biochemistry, 2015,83:176-183.
[34] Kulikowska D. Kinetic of organic matter degradation and humification progress during sewage sludge composting in two-stage system [J]. Journal of Biotechnology, 2010,150(1):283.
[35] Yap S D, Astals S, Lu Y, et al.Humic acid inhibition of hydrolysis and methanogenesis with different anaerobic inocula [J]. Waste Management, 2018,80:130–136.
[36] Blodau C, Deppe M. Humic acid addition lowers methane release in peats of the Mer Bleue bog, Canada [J]. Soil Biology & Biochemistry, 2012,52(3):96-98.
[37] Minderlein S, Blodau C. Humic-rich peat extracts inhibit sulfate reduction, methanogenesis, and anaerobic respiration but not acetogenesis in peat soils of a temperate bog [J]. Soil Biology & Biochemistry, 2010,42(12):2078-2086.
[38] Keller J K, Weisenhorn P B, Megonigal J P. Humic acids as electron acceptors in wetland decomposition [J]. Soil Biology & Biochemistry, 2009,41(7):1518-1522.
[39] Tan W, Jia Y, Huang C, et al. Increased suppression of methane production by humic substances in response to warming in anoxic environments [J]. Journal of Environmental Management, 2018, 206:602-606.
[40] Ho L, Ho G. Mitigating ammonia inhibition of thermophilic anaerobic treatment of digested piggery wastewater: use of pH reduction, zeolite, biomass and humic acid [J]. Water Research, 2012,46(14):4339-4350.
[41] 任冰倩.腐殖酸抑制厌氧消化过程实验研究 [D]. 北京:北京建筑大学, 2015.
[42] Bastida F, Jindo K, Moreno J L, et al. Effects of organic amendments on soil carbon fractions, enzyme activity and humus–enzyme complexes under semi-arid conditions [J]. European Journal of Soil Biology, 2012,53(6):94-102.
[43] Szilagyi. Reduction of Fe3+ion by humic acid preparations [J]. Soil Science, 1971,111(4):233-235.
[44] Ma C, Zhou S G, Lu Q, et al. Decolorization of Orange I under alkaline and anaerobic conditions by a newly isolated humus-reducing bacterium, Planococcus sp. MC01 [J]. International Biodeterioration & Biodegradation, 2013,83(9):17-24.
[45] Scott D T, Diane M. McKnight, E L. Blunt-Harris, et al. Quinone Moieties Act as Electron Acceptors in the Reduction of Humic Substances by Humics-Reducing Microorganisms [J]. Environmental Science & Technology, 1998, 32(19):372.
[46] 马 晨,杨贵芹, 陆 琴,等.Fontibactersp.SgZ-2厌氧腐殖质/Fe(Ⅲ)还原特性及电子传递机制研究 [J]. 环境科学, 2014,(9):3522-3529.
[47] Mills R T E, Dewhirst N, Sowerby A, et al. Interactive effects of depth and temperature on CH4and N2O flux in a shallow podzol [J]. Soil Biology & Biochemistry, 2013,62(5):1-4.
[48] Lou X F, Nair J, Nair J. The impact of landfilling and composting on greenhouse gas emissions-a review [J]. Bioresource Technology, 2009,99(16):3792-3798.
[49] Van Trump J I, Wrighton K C, Thrash J C, et al. Humic acid-oxidizing, nitrate-reducing bacteria in agricultural soils [J]. Mbio., 2011,2(4): e00044.
[50] 姜 杰,杨 浈,任 谦,等.土壤腐殖质氧化还原电位及其相应电子转移能力分布 [J]. 环境化学, 2015,(2):219-224.
[51] 李 季. 腐殖酸抑制及解抑制厌氧消化机理深探 [D]. 北京:北京建筑大学, 2018.
[52] Khadem A F, Azman S, Plugge C M, et al. Effect of humic acids on the activity of pure and mixed methanogenic cultures [J]. Biomass and Bioenergy, 2017,99:21-30.
[53] Ye R, Keller J K, Jin Q, et al. Peatland types influence the inhibitory effects of a humic substance analog on methane production [J]. Geoderma, 2016,265:131-140.
[54] Lovley D R, Kashefi K, Vargas M, et al. Reduction of humic substances and Fe(Ⅲ) by hyperthermophilic microoganisms [J]. Chemical Geology, 2000,169:289-298.
[55] Benz M, Schink B, Brune A. Humic acid reduction by Propionibacterium freudenreichii and other fermenting bacteria [J]. Applied and Environmental Microbiology, 1998,64(11):4507-4512.
[56] Xu J, Zhuang L, Yang G, et al. Extracellular quinones affecting methane production and methanogenic community in paddy soil [J]. Microbial Ecology, 2013,66(4):950-960.
Mechanism of methane production pathway influenced by humus during the anaerobic digestion.
YANG Tian-xue1, LI Ying-jun2, ZHAO Ying1, ZHANG Lie-yu1, HUANG Cai-hong1, LI Dong-yang1, YU Hong1, LI Qi1, XI Bei-dou1*
(1.Chinese Research Academy of Environmental Sciences, Beijing 100012, China;2.Beijing Vocational Agriculture, Beijing 100012, China)., 2018,38(11):4180~4186
Biomass solid waste quantity was large and widely available, with dual characters of pollution and resource. Anaerobic fermentation could promote its pollution control and some part of components involved were converted into humus (HS) under the action of microorganisms. By analyzing the relationship between HS conversion, HS structural characteristics and redox performance, humic reducing bacteria and methanogen activity, and CH4production efficiency in anaerobic fermentation, the regulation principle of HS to CH4in biomass dry anaerobic fermentation system was illustrated, which provided theoretical support for reducing the inhibition of HS on the CH4production pathway and improving fermentation efficiency in anaerobic fermentation system.
humus;biomass waste;anaerobic digestion;methane;inhibition
X705
A
1000-6923(2018)11-4180-07
杨天学(1983-),男,安徽铜陵人,副研究员,博士,主要从事固体废物处理处置与资源化研究.发表论文30余篇.
2018-06-30
公益性行业科研专项(201509040);国家自然科学基金项目(51608499)
* 责任作者, 研究员, xibeidou@yeah.net

