酶法与非酶法磷酸化改性食品蛋白质的研究进展
,,,,
(1.武汉市农业科学院水产研究所,湖北武汉 430207; 2.武汉市农业科学院农产品加工研究中心,湖北武汉 430207; 3.华中农业大学食品科学技术学院,湖北武汉 430070)
利用生物、化学手段从分子水平上改变蛋白分子的氨基酸侧链基团结构,或特异性的剪切蛋白分子主链,从而改善食品蛋白质的理化及功能性质,扩展蛋白质在食品体系中的应用,是近年来食品科学领域的研究热点之一。蛋白质的磷酸化反应是调节蛋白结构和功能、参与和调控生化反应的重要修饰过程。在食品工业中,利用生物或化学手段磷酸化,从而达到改善蛋白质的功能性质、提高蛋白质的溶解性以及加工过程中抗变性的能力,获得专项功能性性较好或具有多种优良特性的蛋白衍生物,已受到广泛的研究关注。根据磷酸化途径的不同,蛋白质的磷酸化反应主要可以分为酶法磷酸化和非酶化学法磷酸化。酶法磷酸化是指通过蛋白激酶的催化,将ATP或GTP上的磷酸基团转移到底物蛋白的丝氨酸、苏氨酸和酪氨酸等残基侧链上的过程[1]。具有反应条件温和、磷酸化位点专一等特点。相对于酶法磷酸化,非酶法磷酸化因其成本低廉、效果显著且具有多种可选的化学磷酸化试剂而有着更广泛的研究应用。不同的磷酸化试剂具有不同的反应途径及作用位点,并在蛋白分子中引入不同性质的磷酸键,从而引起食品蛋白质结构与功能性质不同程度的改变。
本文通过对酶法及非酶法磷酸化的反应机制、反应特点的对比介绍,分别从磷酸化对蛋白结构与功能特性影响的角度,详细阐述了不同蛋白激酶及磷酸化反应试剂对食品蛋白质的改性效果。并通过对不同食品蛋白质的修饰水平及磷酸化位点的介绍,分析了蛋白激酶和磷酸化试剂与食品蛋白质的相互作用机制。旨在为针对性的选择磷酸化反应方式与试剂改善蛋白功能特性、扩展磷酸化改性在食品蛋白质中的应用提供理论参考。
1 蛋白质的酶法磷酸化改性
从食品的安全性上考虑,酶法磷酸化改性是食品蛋白磷酸化改性的重要途径。酶法磷酸化反应条件温和,反应位点专一,易于定向控制并产生均一的产物,且蛋白营养价值损失少。酶法磷酸化一般采用蛋白激酶来催化,并通过对蛋白质一级结构的识别进行特定位点的磷酸化。
1.1 蛋白激酶的磷酸化反应机制
大多蛋白激酶进行磷转移的催化活性状态所呈现的关键结构特征非常相似[2-3]。蛋白激酶发生磷酸化的活性片段是一个主要的调控元件,可以作为蛋白激酶催化活性的开关。该活性开关属于丝氨酸(Ser)/苏氨酸(Thr)或酪氨酸(Tyr)激酶家族的不同类型。蛋白激酶通过氨基酸残基与活性位点接触并形成网络,从而调节磷酸化作用,保持激酶的最高活性状态。稳定催化位点的关键残基是不变的,且不同亚群的激酶具有相似的调节机制[4]。
图1为蛋白激酶晶体的典型的双叶形结构,为Ser/Thr或Tyr激酶的催化作用核心。激酶的N末端反平行β-折叠结构由五条β链和单个α-螺旋(称为αC-螺旋)构成,C末端主要由α-螺旋组成[5]。蛋白激酶的C-末端有长度为20~30个氨基酸残基,既是酶与底物结合位点一部分,也是激活磷转移的序列。蛋白激酶的C-末端还含有催化环,其中天冬氨酸(D166)可以作为催化基础,促进质子从底物磷酸化位点的羟基侧链脱去。核苷酸(ATP)和底物的结合位点位于C末端和N末端之间的凹处,ATP是通过其本身的磷酸基团与蛋白激酶的C-端和N-端的保守残基相互作用来转移磷元素的[6-7]。在各种激酶的催化作用下,通过ATP对具有可磷酸化位点的蛋白质进行定向选择的磷酸化改性,反应机制如图2所示。
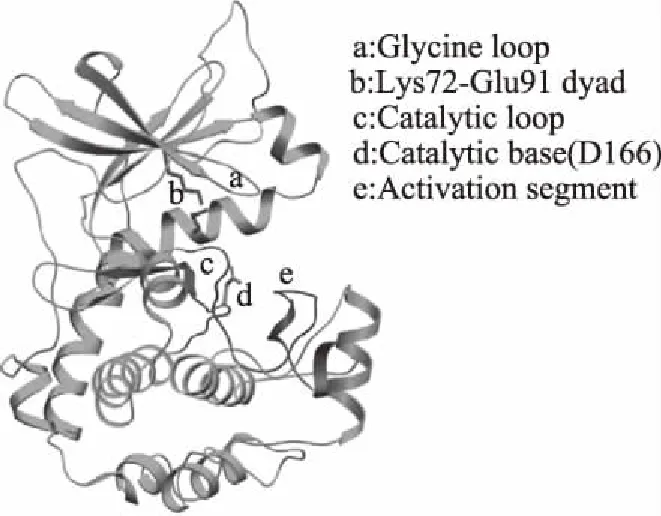
图1 Ser/Thr或Tyr激酶的催化作用核心结构及关键功能区域[2]Fig.1 The 3D fold of catalytic core of Ser/Thr or Tyr kinase with their key functional elements[2]
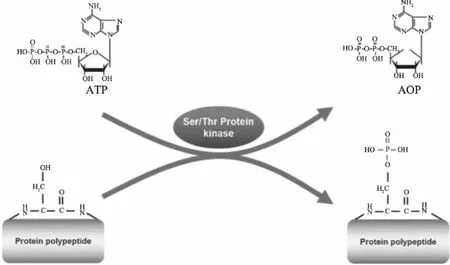
图2 酶法磷酸化丝氨酸示意图(Science Slides)Fig.2 Serine phosphorylation of proteins by phosphokinase(Science Slides)
1.2 CAMP依赖蛋白激酶(CAMPdPK)的磷酸化反应
CAMP依赖蛋白激酶(CAMP-dependent protein kinase,CAMPdPK)是一种依赖于环磷酸腺苷激活的蛋白质激酶,能特异性的磷酸化氨基末端的丝氨酸残基(Ser)。氨基末端侧链含Ser的序列必须同时含有碱性氨基酸残基,例如精氨酸(Arg)和赖氨酸(Lys)残基。CAMPdPK作用的磷酸化位点的序列类型为-Lys-Arg-X-X-Ser-和-Arg-Arg-X-Ser-,其中X可以是任何氨基酸残基[8]。
通过CAMPdPK对大豆蛋白进行酶法改性,大豆蛋白11S酸性亚型的磷酸化程度可以达到2 mol Pi/mol蛋白质,且磷酸化仅发生于丝氨酸残基。磷酸化后大豆蛋白11S亚型的结构仅发生了轻微的改变,无规则结构增加、芳香氨基酸残基更加暴露于溶液中,然而大豆蛋白11S亚型的分子量没有发生改变,表明酶法磷酸化未引起蛋白分子的交联[9]。Ross[10]研究了CAMPdPK磷酸化大豆贮藏蛋白的最适条件,发现短暂的热处理可以促使大豆蛋白亚基解离、结构伸展,从而增加大豆蛋白的溶解度,提高磷酸化程度。当ATP与二硫苏糖醇的添加量分别为40 pmol/L和1.28 mmol/L、底物的大豆贮藏蛋白浓度为0.1%,磷酸化反应3 h时磷酸化程度最大,且磷酸化程度随着实验范围内CAMPdPK 浓度的增加不断增加。Campbell等[11]发现CAMPdPK磷酸化大豆分离蛋白的溶解性和乳化活性提高,乳液稳定性和起泡性也随磷酸化显著改善,但泡沫稳定性较差;进一步采用闪烁计数和放射自显影技术表征磷酸化过程,发现32Pi最初与大豆球蛋白的酸性多肽发生反应,随后作用于碱性多肽,极少数的32Pi与β-伴大豆球蛋白的β和α/α′亚型发生反应。Aluko等[12]研究了CAMPd PK磷酸化的豇豆球蛋白在pH3~8范围内的功能特性,由于亲水性的磷酸基团增加了蛋白与水相的相互作用,磷酸化后豇豆球蛋白在pH4~6范围内溶解度显著增加,并在pH4和5时显示出更好的起泡性和泡沫稳定性。这可能由于带负电荷的磷酸基团增加了蛋白分子间的静电斥力,导致蛋白结构伸展,从而在空气/水界面更好的发生定位和重排。且静电相互作用在接近蛋白pI时最大化,此时磷酸基团对静电力影响最显著。然而,增加的静电斥力同时也导致磷酸化豇豆球蛋白在油/水界面的蛋白吸附率下降,界面膜强度减小,造成豇豆球蛋白的乳化活性下降。但当乳液体系形成后,蛋白乳液间静电斥力的增加又有利于提高乳液体系的稳定性。
最新的研究还发现磷酸化在调控蛋白自组装纤维化进程中的作用。通过CAMPdPK磷酸化含有α螺旋、β折叠结构和CAMPdPK识别序列的模型肽,发现磷酸化在肽链从无规则卷曲-富含β折叠结构的寡聚体-原纤维-淀粉样纤维的构象转变过程中,诱导肽链的β-折叠结构伸展,从而抑制不溶性淀粉样纤维的形成,促进低聚体和原纤维的形成。显示了酶法磷酸化和去磷酸化在触发或抑制纤维蛋白形成上的调控作用[13]。
1.3 酪蛋白激酶Ⅱ(CK-Ⅱ)的磷酸化反应
酪蛋白激酶Ⅱ(CAMP-independent type Ⅱ casein kinase)是一种从酵母(YarroeisLipolytia)中提取和纯化的不依赖钙和CAMP调节的多功能蛋白质激酶,它能专一识别底物Ser/Thr-X-X-Asp/Glu序列中可磷酸化的Ser和Thr,还能与Tyr发生磷酸化反应[14]。
采用CK-Ⅱ对酪蛋白及大豆球蛋白(7S)磷酸化改性,二者的溶解度在磷酸化后均提高,且磷酸化的酪蛋白和大豆球蛋白(7S)的氨基酸的指纹图谱表明CK-Ⅱ作用的靶氨基酸是丝氨酸、苏氨酸和酪氨酸[15]。对大豆中两种贮藏蛋白通过CK-Ⅱ磷酸化,发现磷酸化特异性的发生在大豆球蛋白7S亚型的α和α′亚基及11S亚型的酸性亚基[16]。为了进一步的确定CK-Ⅱ的磷酸化位点,Fouques等[17]用胰蛋白酶消化磷酸化β-伴大豆球蛋白的α亚基,对所得肽进行RP-HPLC偶联LC-ESMS的分析,鉴定到两个磷酸化的肽段分别对应氨基酸残基70~89和116~127,其中Ser75和Ser117发生磷酸化。
然而对于某些天然状态下的蛋白如溶菌酶、牛血清蛋白和肌酸激酶而言,通常不能直接进行酶法磷酸化。为了满足作为底物蛋白的序列要求、更易与蛋白激酶发生反应,还需要通过热处理使埋藏在蛋白分子内部的丝氨酸或苏氨酸残基暴露[18],从而限制了酶法磷酸化的进一步研究与应用。
2 蛋白质的非酶法磷酸化改性
非酶的化学法磷酸化由于其使用试剂廉价、反应简单和效果显著等特点,在食品工业上有较大的应用价值。化学磷酸化的实质为磷酸化试剂提供无机磷,蛋白质分子中的酪氨酸、丝氨酸、苏氨酸的羟基提供氧原子,或者是精氨酸、赖氨酸、组氨酸的氨基提供氮原子(Lys的ε-氨基、His咪唑环1,3位N和Arg的胍基末端N),两者形成-C-O-Pi或-C-N-Pi 的酯化反应[19]。但是,不同的磷酸化试剂与蛋白质发生反应的部位和途径都有所不同,常见的磷酸化试剂有:三氯氧磷、焦磷酸钠和三聚磷酸钠等。
2.1 三氯氧磷(POCl3)参与的磷酸化
三氯氧磷(POCl3)是一种高反应活性的试剂,被广泛用于蛋白质磷酸化改性中。POCl3在溶液或固相体系中都可使蛋白质磷酸化,其与蛋白质共价结合的磷含量量最高可以达到3.9%。
2.1.1 POCl3磷酸化的反应机制及磷酸键性质 POCl3可以形成两个高活性的中间体(反应式(1)和(2))进而与蛋白质的功能基团丝氨酸和苏氨酸(反应式(3))形成磷酸酯键,或与赖氨酸和组氨酸(反应式(4))发生反应生成磷酸酰胺[20]。此外,天冬氨酸和谷氨酸残基也能够与POCl3形成磷酸酸酐。且POCl3与蛋白反应的主要形式为二磷酸酯键和三磷酸酯键[21]。
通过磷酸化蛋白对pH的稳定性、磷酸化蛋白赖氨酸基团活性的变化,以及结合31P核磁共振(NMR)光谱等分析手段研究不同蛋白磷酸键的性质。结果表明,POCl3的磷酸化位点主要发生在赖氨酸残基上,少数发生在苏氨酸或丝氨酸的羟基基团上,如表1所示。蛋白磷酸键的性质主要受到反应pH的影响,如磷酸化酪蛋白的磷酸键在pH2.0~8.5的范围内稳定;且Schwenke[22]研究发现大豆蛋白12S亚型的磷酸基团在pH8.0时最稳定,此时蛋白的氨基和羟基基团都参与磷酸化;而当反应pH提高到10~11时,磷酸化反应主要发生在羟基上。

表1 POCl3磷酸化的蛋白磷含量及磷酸键性质Table 1 The phosphorus content and phosphate linkage of protein phosphorylated by POCl3

式(1)
Intermediate 1
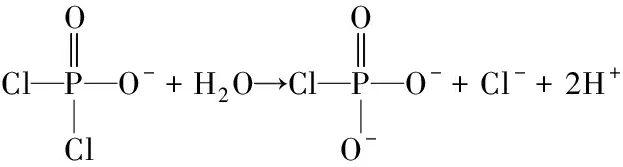
式(2)
Intermediate 2
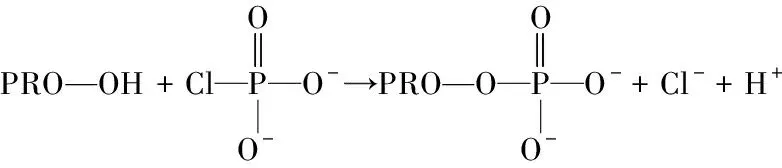
式(3)
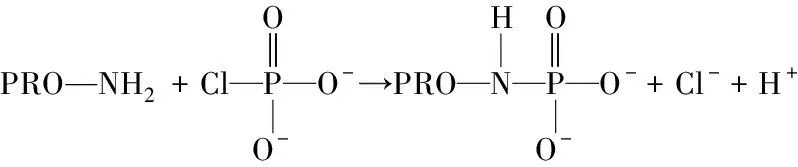
式(4)
2.1.2 POCl3磷酸化对蛋白质功能性质的影响 已有研究表明,POCl3磷酸化不会影响蛋白的体外消化性(胰蛋白酶,胃蛋白酶和氨基肽酶体系)。Huang等[23]采用POCl3对酵母蛋白磷酸化改性,结果显示,磷酸化提高了酵母蛋白的溶解性、持水性、乳化活性和起泡性,磷酸化后酵母蛋白溶液的黏度增加。Hirotsuka等[24]的研究也表明POCl3磷酸化可以有效改善大豆蛋白的溶解性、持水性、乳化活性和起泡性以及玉米醇溶蛋白的溶解性和乳化活性。
Matheis[25]通过POCl3磷酸化酪蛋白和玉米醇溶蛋白,并使用与哺乳动物相似的必需氨基酸需求和类似酶系统的嗜热四膜虫体系来评价磷酸化酪蛋白和玉米醇溶蛋白的营养特性。发现磷酸化不影响酪蛋白体系中嗜热四膜虫的生长,且未磷酸化修饰的玉米醇溶蛋白体系中嗜热四膜虫的相对生长效应仅为4.5%,而磷酸化玉米醇溶蛋白体系中的嗜热四膜虫的相对生长效应为49%。
此外,通过POCl3磷酸化,大豆蛋白、酪蛋白、血清球蛋白、血清蛋白和谷蛋白的凝胶形成能力提高;磷酸化也可以改善β-乳清蛋白、酪蛋白(α-、β-和κ-)的结合钙离子的能力。进一步研究表明,β-乳球蛋白通过POCl3磷酸化后,在Ca2+存在下不经加热便可形成凝胶,这是Ca2+与带负电荷的磷酸基团之间交联的结果[26-29]。吴磊燕[30]系统研究了POCl3磷酸化玉米醇溶蛋白(Zein)的界面行为,发现磷酸化提高了Zein的界面活性,在空气-水界面形成的蛋白膜黏性模量(Eυ)增加;磷酸化通过改变 zein 蛋白膜的表面和机械性能,降低zein 蛋白膜表面疏水性,增加蛋白膜的临界表面张力。此外,磷酸化还使得zein形成的蛋白膜结构紧密,膜的机械性能如延伸率显著提高,蛋白膜的柔韧性提高[31-32]。
2.1.3 POCl3磷酸化对蛋白质构象的影响 POCl3对蛋白构象的影响主要表现为使蛋白的二级结构发生变化,α-螺旋降低、无规卷曲增加从而导致结构松散;已有研究表明人血清蛋白的荧光光谱在磷酸化后发生显著的红移现象,表明磷酸化导致蛋白质的三级结构伸展,且磷酰基的接入同时导致蛋白酪氨酸残基的荧光猝灭;,由于蛋白三级结构的构象变化导致疏水基团的暴露,磷酸化后玉米醇溶蛋白的表面疏水性增加[22,33]。
POCl3对蛋白构象的影响还表现为引起蛋白质分子间的交联,SDS-PAGE结果表明磷酸化程度越大生成的聚合物分子量越大,这些交联键的形式可能包括O,O′-磷酸二酯和N,N′-磷酸二酰胺键以及异肽键。此外,蛋白质的游离氨基或羟基也可以与磷酸化蛋白质的磷酰基反应[20,22]。然而,这些交联产物的性质是未知的,可能会生成具有潜在毒性的残基。
此外,POCl3易在水溶液中发生剧烈的放热反应并迅速降低体系的pH,造成蛋白质的变性,因此,需先将POCl3溶解于有机溶剂后逐滴加入到蛋白质溶液中,整个反应过程需要在冰水浴中进行,并且残余POCl3难以与蛋白分离。
2.2 焦磷酸钠参与的磷酸化
2.2.1 焦磷酸钠磷酸化的反应机制及磷酸键性质 在焦磷酸钠的存在下干燥加热蛋白质,蛋白质的功能特性得到一定的改善。干燥状态下的磷酸化过程可以通过以下反应方程式来表示:
X—OH+H3PO4=X—O—H2PO3+H2O
式(5)


表2 干燥加热条件下食品蛋白质与焦磷酸钠反应的磷酸化程度Table 2 Introduced phosphorus content of various food proteins by dry-heating in the presence of pyrophosphate
Li等[36]通过31P NMR光谱鉴定到焦磷酸钠磷酸化的蛋清蛋白中,磷酸基团的存在形式为磷酸单酯、磷酸二酯和多磷酸酯键。在磷酸化卵白蛋白中磷酸基团与蛋白分子中的糖链发生接枝反应,形成磷酸二酯和多磷酸酯键。磷酸化大豆白蛋白则是在丝氨酸和糖链上同时引入磷酸基团。磷酸化溶菌酶的31P NMR光谱中出现三重峰,表明溶菌酶的磷酸基团的两端还存在单磷酸。而在磷酸化聚赖氨酸中,磷酸基团与聚赖氨酸反应生成含N-P键的磷酸肌酸或磷酸精氨酸。这些结果表明,通过焦磷酸盐磷酸化改性不同种类的蛋白质,磷酸键的类型具有很大的差异。
2.2.2 焦磷酸钠磷酸化对蛋白质构效关系的影响 SDS-PAGE结果表明,由于引入带负电荷的磷酸基团,随着磷酸化程度的增加,蛋清蛋白和卵转铁蛋白(OTF)的电泳移动性增加,且磷酸化不会引起蛋清蛋白的热聚合效应。磷酸化后,蛋白分子的离子间相互作用增强,热稳定性提高;磷酸化提高了卵白蛋白和大豆清蛋白的水/油结合能力,并进一步提高蛋白乳化性。与油/水界面相似的,磷酸化还可以改善蛋清蛋白和大豆清蛋白在空气/水界面的起泡性和泡沫稳定性,通过显微镜观察发现磷酸化蛋清蛋白形成的泡沫细腻均匀、密度小且膨胀率高[35,37]。此外,磷酸化可以促进蛋白形成更坚固和透明的热诱导凝胶,并进一步提高热凝胶的持水能力[38-39]。在改善蛋白质功能特性的同时,磷酸化修饰的食品蛋白质还表现出了更好的生理活性。磷酸基团与钙离子的相互作用使得磷酸化后的蛋清蛋白、卵白蛋白、牛血清蛋白和卵转铁蛋白促进磷酸钙的溶解能力增加,并进一步促进钙的吸收。从而表现出磷酸化蛋白作为促进钙吸收的功能性食品的潜在应用前景。研究也表明,磷酸化的蛋清蛋白在α-胰蛋白酶和肌动蛋白酶E水解体系中的体外消化率增加[40-43]。Yin等发现由于磷酸化蛋清蛋白疏水基团的暴露,增加了与没食子酸酯(EGCG)的结合,磷酸化蛋清蛋白与EGCG结合前后的抗氧化活性,包括ABTS+自由基清除能力、氧自由基的抗氧化能力,还原力,螯合能力和超氧阴离子清除活性均显著的改善[44]。
通过焦磷酸钠的磷酸化修饰,卵白蛋白、蛋清蛋白和大豆清蛋白的表面疏水性增加;圆二色谱表明磷酸化对蛋白质的二级结构影响较小,其中大豆清蛋白的无规卷曲结构发生轻微的变化,卵白蛋白的α-螺旋含量略微减少;由于磷酸基团的屏蔽效应,磷酸化后卵白蛋白和大豆清蛋白的色氨酸内源荧光的荧光强度降低;DSC结果表明磷酸化的卵白蛋白呈现熔融(部分伸展)的构象。此外,磷酸化后卵白蛋白分子的巯基与二硫键之间的交换反应增强[36-38,40]。
2.2.3 焦磷酸钠的磷酸化位点鉴定 对焦磷酸钠磷酸化的卵白蛋白、溶菌酶的磷酸化位点进行研究,通过MALDI-TOF/MS检测溶菌酶的磷酸化位点为:Tyr20、Ser36、Thr40、Thr43、Thr47、Ser50、Thr51、Thr53、Ser60、Thr69、Ser72、Ser81、Ser85、Ser86、Thr89、Ser91、Ser100和Thr118,即焦磷酸钠可以与溶菌酶的Tyr,Thr和Ser残基反应,形成O-P,O-PP和O-PPP形式的磷酸酯键,其中在Thr118位点的磷酸酯键为O-PPP形式。对磷酸化卵白蛋白通过 MALDI-TOF/MS检测到的磷酸化位点为:Ser68、Thr91、Lys92、Tyr97、Ser98、Ser100、Ser103、Tyr111、Tyr117、Tyr125、Thr136、Ser147、Ser151、Thr153、Thr201、Ser205、Tyr212、Ser221、Ser224和Ser344,即焦磷酸钠可以与卵白蛋白的Tyr,Thr,Ser和Lys残基发生反应。其中Ser68和Ser344为卵白蛋白的天然磷酸化位点。磷酸化卵白蛋白的磷酸酯键的形式为O-P和O-PP[39]。Wang等[45]通过LC-FTICR/MS检测磷酸化卵白蛋白的位点,焦磷酸钠与卵白蛋白反应时间为1、2和5 d,对应的磷酸化位点数分别为8,8和10。LC-FTICR/MS鉴定到的磷酸化位点为:Tyr42、Ser48、Thr49、Thr51、Ser68、Ser100、Ser103、Ser147、Ser151、Thr153、Ser221、Ser224、Phe234、Ser236、Thr238、Ser240、Ser344,Thr373和Ser384,即卵白蛋白的Tyr,Thr,Ser和Phe残基参与磷酸化反应,而Lys未参与磷酸化。其中,磷酸化肽段41-59,142-157在反应时间从1 d增加至2 d时从单磷酸化转变为多磷酸化。
2.3 三聚磷酸钠参与的磷酸化
2.3.1 三聚磷酸钠(STPP)磷酸化的反应机制及磷酸键性质 三聚磷酸钠(STPP)是FDA允许的安全性食品添加剂。由于蛋白分子自由氨基(羟基)上氢原子的电子云偏向氮(氧)原子,因此自由氨基(羟基)具有亲核性。在STPP结构中(①P-O-②P-O-③P)两端磷氧键①P-O和O-③P的键能最低,稳定性较差,因而STPP中呈正电性的磷原子易与蛋白分子中亲核性的羟基或氨基发生反应[46]。而不同pH条件下,蛋白质的氨基或羟基反应活性不同。蛋白质分子中的自由氨基的活性较大,而自由羟基在pH>9的碱性环境中才能显示出较高的活性;因此在反应p H为7~9范围内,STPP主要与蛋白分子的自由氨基反应。STPP与蛋白质在p H7~9时的反应可以表示如下:
式(6)
已有研究表明,STPP可以与大豆分离蛋白的丝氨酸残基发生酯化反应,赖氨酸残基发生酰化反应。通过红外光谱和蛋白分子中磷酸基团的稳定性分析表明,大豆分离蛋白的丝氨酸、苏氨酸残基的-OH 和赖氨酸残基的ε-NH2均与磷酸基团发生了反应[47]。Xiong等[48]通过红外光谱、X-射线光电子能谱及31P NMR 分析STPP磷酸化的卵白蛋白的磷酸键特性,发现磷酸基团与卵白蛋白的丝氨酸、苏氨酸残基的-OH以及赖氨酸和精氨酸的-NH2反应,形成C-O-P和C-N-P键。而由于C-N-P键对pH不稳定,在磷酸化的卵白蛋白中磷酸键的主要存在形式为O-P。
2.3.2 STPP磷酸化对蛋白质构效关系的影响 通过STPP磷酸化后,大豆分离蛋白的水溶性、持水能力、乳化活性和蛋白溶液表观粘度均显著提高,磷酸化大豆分离蛋白和酪蛋白的起泡能力和泡沫稳定性增加[49-50]。Xiong等[51]研究了磷酸化对卵白蛋白在油/水界面的界面行为影响机制,由于磷酸化后卵白蛋白电负性增加,引起Zeta电位增加,使卵白蛋白分子间静电斥力增加,从而抑制乳液液滴的聚集,导致乳化液滴的平均粒径减小,使蛋白分子可以更迅速的扩散到油/水界面、降低界面张力,提高卵白蛋白的乳化活性。圆二色谱表明,磷酸化后卵白蛋白分子的β-折叠结构含量增加,促进了油/水界面处相邻蛋白质分子的相互作用,有助于形成更致密和刚性的界面膜。同时,磷酸化使得卵白蛋白分子的酰基无序化程度增加,酪氨酸和色氨酸残基暴露于更加极性的环境中。蔺丹华[52]采用胰蛋白酶水解磷酸化酪蛋白,发现水解程度随着磷酸化程度的增加而增加,SDS-PAGE和SEC-HPLC结果表明磷酸化后的酶解产物生成分子量更小的肽段,即磷酸化促进了酪蛋白的酶解效率。
许多研究表明STPP的磷酸化修饰在改善食品蛋白质凝胶特性方面取得了良好的效果。磷酸化的乳清蛋白可以在酸性环境中诱导凝胶的形成,使酸奶的硬度和粘度提高,并呈现均匀、致密的凝胶网络结构,从而改善酸奶质地,作为天然的酸奶增稠剂[53]。采用STPP修饰的明胶zeta电位下降、负电荷增加,从而导致强的离子间相互作用。当STPP的添加量为0.08%时,明胶的凝胶强度最大,且凝胶的微观结构更致密[54]。此外,蛋白质的磷酸化改性可以促进钙离子的交联,使蛋白质分子间通过离子键形成钙桥结构,从而增强凝胶网络结构[55]。采用CaCl2对磷酸化刺参胶原蛋白凝胶进行交联,磷酸化刺参胶原蛋白凝胶的硬度及粘性提高,凝胶与水分子的结合能力提高,使得胶原纤维结构更加稳定[56]。在磷酸化明胶中添加CaCl2和ZnCl2,凝胶强度随着CaCl2和ZnCl2浓度的增加而增加,且添加CaCl2的磷酸化明胶比添加ZnCl2具有更高的凝胶强度[57]。
2.3.3 STPP的磷酸化位点鉴定 Xiong等[51]使用STPP分别在反应pH5,7和9(P-OVA5,P-OVA7 和 P-OVA9)的条件下与卵白蛋白反应12 h,通过MALDI-TOF MS鉴定到的磷酸化肽段及位点如表3。通过对MS/MS结果分析,发现磷酸化主要发生在丝氨酸残基的羟基,较少发生在苏氨酸残基。由于磷酸基团之间存在静电斥力,卵白蛋白的天然磷酸化肽段通常被认为难以进一步的磷酸化,然而该研究发现STPP磷酸化修饰的卵白蛋白中,天然的磷酸化肽段成功接入了新的磷酸基团,并首次鉴定到磷酸化位点Ser353和Ser355。进一步的采用13C NMR精确定位磷酸化位点,发现磷酸化主要发生在卵白蛋白分子中丝氨酸残基的βCH2基团的C 原子位置[58]。

表3 MALDI-TOF MS鉴定磷酸化OVA(P-OVA5,P-OVA7和P-OVA9)典型肽段得到的磷酸根基团数量和位点[51]Table 3 The possible number of phosphate groups and sites in tryptic peptides from phosphorylated OVA (P-OVA5,P-OVA7 and P-OVA9)identified by MALDI-TOF MS[51]
2.4 其他
利用美拉德反应的磷酸化也是一种有效的非酶法磷酸化方法。一般通过美拉德反应的磷酸化可以分为两种途径,一种是先糖基化修饰蛋白,使其反应活性基团增加,再进一步对蛋白进行磷酸化;另一种是直接通过葡萄糖-6-磷酸(G6P)与蛋白发生美拉德反应而引入磷酸根基团。
2.4.1 糖基化蛋白的磷酸化 Li等[59]认为,乳清分离蛋白具有较低的糖含量,直接对其进行磷酸化修饰的效率较低,而引进足够的糖链可以有效的提高乳清分离蛋白的磷酸化效率。对糖基化乳清分离蛋白进一步磷酸化发现,与单独磷酸化相比,糖基化后蛋白的磷酸化程度提高,热稳定性、乳化稳定性、和凝胶特性如硬度、弹性以及持水能力提高;Enomoto等[60-61]通过糖基化修饰β-乳球蛋白(β-LG)和α-乳清蛋白(α-LA)并磷酸化,发现β-LG的视黄醇结合活性下降,而β-LG和α-LA的促进磷酸钙的溶解能力提高。磷酸化后β-LG和α-LA的二级结构并未发生明显的变化,而α-LA的色氨酸荧光强度减小,蛋白分子结构伸展。对生理活性的变化分析表明,β-LG的抗原性在糖基化后减小,而进一步的磷酸化对抗原性影响不明显;糖基化和进一步的磷酸化均降低了α-LA的抗体应答,使α-LA对细胞促炎因子(IL-6和肿瘤坏死因子-α)的抑制作用进一步增强。此外,磷酸化修饰还使得的α-LA抑制细胞凋亡的能力提高。
2.4.2 葡萄糖-6-磷酸通过美拉德反应磷酸化 葡萄糖-6-磷酸(G6P)是主要的糖代谢产物,其羰基基团具有半缩醛键。由于G6P同时具有羰基和磷酰基的特性,可以通过氨基-羰基反应将磷酰基引入蛋白质分子中,从而作为安全的蛋白质改性试剂[62]。Aoki等[63]使用G6P通过美拉德反应磷酸化乳清分离蛋白和蛋清蛋白,发现前者褐变程度更大,G6P修饰的蛋白在钙-磷溶液中可以有效的抑制磷酸钙沉淀的形成。Kato等[64]分别使用葡萄糖(Glu)和G6P对卵白蛋白改性,结果表明G6P诱导的磷酸化蛋白质聚集和褐变程度更大,溶解性和耐热性提高,且乳化活性与天然卵白蛋白相比提高了5倍。Aoki等[65]通过G6P磷酸化β-LG,发现β-LG的乳化活性和抑制磷酸钙沉淀形成能力均提高。研究还发现G6P对β-LG改性的反应时间需要控制在1 d以内,因为G6P与蛋白氨基的反应在1 d内会快速进行,而超过1 d反应速率下降,且褐变与聚合产生的副产物会变得更加稳定。
通过美拉德反应对蛋白质进行磷酸化的方法虽然在一定程度上提高了蛋白的磷酸化程度和反应效率,但美拉德反应所引起的蛋白褐变及蛋白分子间聚集仍是一个亟待解决的问题。
3 结论与展望
随着食品工业发展对蛋白质功能特性要求的提升,通过酶法或者非酶法对食品蛋白质进行磷酸化修饰以获得专项功能较好或多种功能特性达到平衡点的蛋白衍生物,并作为天然的食品添加剂用于改善食品的口感与质地、为食品体系补充必要功能,从而为蛋白质资源的进一步开发利用提供了良好的思路。酶法磷酸化可以在温和条件下实现蛋白质的磷酸化,具有较好的安全性,可以在一定程度上提高蛋白质的功能性质。但是由于磷酸化的蛋白激酶种类较少,只能引入少量的磷酸基团,因此磷酸化效率低。此外,酶法磷酸化必须在消耗ATP的情况下发生磷酸激酶与底物的作用,而ATP和磷酸激酶的成本较高,限制了其在工业化生产中的应用。非酶法磷酸化中,高反应活性的磷酸化试剂(如POCl3、P2O5)容易生成副产物,导致蛋白质交联生成赖丙氨酸,降低蛋白的营养价值。且反应产生的残余试剂和副产物难以去除。在食品中允许使用的相对安全的磷酸化试剂,如焦磷酸钠等诱导的磷酸化反应时间普遍较长,部分蛋白质的磷酸化程度低,磷酸化效率有待提高;而通过糖基化来提高磷酸化反应效率,则需要更长的反应时间,增加了成本,且褐变反应的发生影响了产品质量,降低了实际应用的价值。因此,尚需研究一种高效且温和的磷酸化反应,可以根据特定的需求对蛋白质进行定向的磷酸化改性,以进一步扩展磷酸化在改性蛋白功能性质的应用。
由于磷酸化的反应特性,磷酸化修饰对改善多种食品蛋白质的乳化活性及凝胶特性上取得了明显的效果,从而在食品亲水胶体领域表现出替代小分子表面活性剂以稳定多相食品体系,提高蛋白凝胶的流变及质构特性、形成均匀且具有良好机械性能的蛋白水凝胶的潜在应用价值。并可进一步利用凝胶网络结构为功能活性物质提供结合位点,或通过稳定的蛋白乳液体系包裹脂溶性功能因子,以提高功能因子的稳定性、最大程度的保持其功能活性,从而实现功能因子在体内的靶向输送和定向缓释。通过现有对蛋白质磷酸化修饰的研究,为阐明不同蛋白质在分子水平的磷酸化机制,深入理解食品体系结构-功能特性的内在联系,提供了较好的理论基础。使得在不久的将来,利用高效率的特异性磷酸化来定向改善食品蛋白质的功能特性成为可能。

