表达BG4蛋白对人胃癌AGS细胞凋亡和端粒酶逆转录酶表达的影响*
张毅强, 师帅帅, 裴晋红, 郑 军, 王星宇, 李云飞, 于 波, 张慧鹏, 胡文庆△
(1长治医学院生化教研室, 山西 长治 046000; 2长治医学院附属和济医院肾内科, 山西 长治 046011;3长治医学院临床一系, 山西 长治 046000; 4长治医学院附属和济医院普外科, 山西 长治 046011)
G-四链体(G-quadruplex,G4)是由富含鸟嘌呤的序列通过Hoogsteen氢键相连形成的一种非经典的核酸二级结构[1]。研究表明该二级结构广泛存在于DNA及RNA中,与基因的复制和转录密切相关[2],参与肿瘤与某些疾病的发生发展过程,具有重要的生物学功能,已成为抗肿瘤研究的重要靶点[3-4]。端粒是真核生物染色体线性DNA分子末端的结构,由富含TG序列的多次重复组成[5],位于端粒区的富含G的序列可以形成G4结构[6-7]。
本课题前期研究已成功构建了G-四链体DNA的单链抗体原核表达载体pSANG10-BG4,并在大肠杆菌BL21中成功表达及鉴定了该抗体BG4[8],但BG4在真核细胞内的功能并未研究。由于在真核细胞端粒区存在大量的G序列,因此本研究拟进一步构建并鉴定BG4真核表达载体,分析胃癌细胞株AGS中表达的BG4对其端粒酶逆转录酶(telomerase reverse transcriptase,TERT)表达及细胞凋亡的影响。
材 料 和 方 法
1 材料
大肠杆菌DH5α、pEGFP-N1和胃癌细胞株AGS为本室留存;pMDTM18-T Vector Cloning Kit(6011)、Gene Mark Plasmid Miniprep Purification KitⅡ(DP012)、 EX Taq DNA聚合酶(RR001A)、dNTP Mixture(4030)及限制性内切酶SacⅠ(1078S)和PstⅠ(1073S)购于TaKaRa;DNA Marker(SM0331)和T4 DNA Ligase(2011A)购自Thermo; MiniBEST Agarose Gel DNA Extraction Kit(9762)、1 kb DNA Ladder(3426A)、TRANS 100bp DNA ladder(BM301)购于TaKaRa;苏木素伊红染色试剂盒(AR-0781)购于北京鼎国昌盛生物技术有限公司;酵母提取物和胰蛋白胨购于OXOID;抗FLAG兔多克隆抗体(RG001060)购自索莱宝公司;抗人TERT(human TERT,hTERT;sc-7212)和β-actin (sc-4778)抗体购自Santa Cruz;HRP标记的羊抗兔II抗(D110058)购自上海生工生物工程股份有限公司;其余试剂选用国产分析纯。引物序列及测序由上海生工生物工程股份有限公司完成。
2 方法
2.1PCR扩增BG4序列 根据pSANG10-BG4中BG4的序列,设计BG4引物,上游引物序列为5’-GGAGCTCATGGCCGAGGTGCAGCTG-3’,下游引物序列为5’-CTGCTGCAGCTTGTCATCGTCATCCTTGTAATC-3’,下划线表示SacⅠ与PstⅠ酶切位点,其5’端序列为保护碱基。反应体系:灭菌去离子水36.5 μL,Ex Taq DNA聚合酶(5 U/μL)0.5 μL,10×PCR Buffer 5 μL,dNTP 5 μL,上游引物(10 μmol)1 μL,下游引物(10 μmol)1 μL,pSANG10-BG4 DNA 1 μL,总体积50 μL。反应程序为: 94 ℃ 10 min; 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 1 min, 30个循环; 72 ℃ 5 min。恒压120 V,跑1.5%琼脂糖凝胶电泳45 min,记录拍照。
2.2pMD18-T-BG4载体的构建及序列测定 取灭菌去离子水3 μL、上述纯化的PCR产物1 μL、pMD18-T载体1 μL和Ligation solutionⅠ 5 μL,16 ℃反应1 h。挑取平皿中生长的白色单克隆菌落溶解在含Kana的新鲜培养基中,37 ℃继续培养3~4 h,取2 μL菌液为模板进行PCR;扩增后提取质粒,用限制性内切酶SacⅠ与PstⅠ酶切鉴定,反应体系为:灭菌去离子水12 μL,10× QBuffer 5 μL,pMD18-T-BG4质粒1 μL,SacⅠ1 μL,PstⅠ1 μL,总体积20 μL。经1%琼脂糖凝胶电泳鉴定,凝胶成像仪记录结果。选取经双酶切鉴定成功与预期结果一致的菌株送上海生工生物工程股份有限公司进行测序,以最终确定重组真核质粒的正确性。
2.3pEGFP-N1-BG4载体的构建及鉴定 小量提取pMD18-T-BG4质粒,经SacⅠ和PstⅠ双酶切后回收含有黏性末端的小片段,反应体系为:灭菌水21 μL,pMD18-T-BG4质粒20 μL,10× QBuffer 5 μL,SacⅠ 2 μL,PstⅠ 2 μL,总体积50 μL。pEGFP-N1转化入DH5α感受态细胞,提取质粒,经SacⅠ和PstⅠ双酶切,切胶回收大片段,方法同上,反应体系为:回收的pEGFP-N1载体大片段1 μL,纯化目的片段16.6 μL,T4 DNA连接酶0.4 μL,10× T4 DNA Ligase Buffer 2 μL,总体积20 μL。提取质粒pEGFP-N1-BG4经SacⅠ和PstⅠ双酶切鉴定及SacⅠ单酶切鉴定,选取经双酶切鉴定成功的菌株送上海生工生物工程股份有限公司测序,以最终确定重组真核质粒的正确性,并命名为pEGFP-N1-BG4。
2.4细胞转染 转染分为空白对照(control)组(未加质粒及LipofectamineTM2000)、pEGFP-N1组及pEGFP-N1-BG4组将AGS细胞按每孔1×106接种于6孔板内,待细胞融合达80%时,按LipofectamineTM2000说明配好A、B液。A液含240 μL 无血清无抗生素RPMI-1640培养基和10 μL LipofectamineTM2000,总体积250 μL,室温孵育5 min;B液含双无RPMI-1640培养基及4.0 μg 去内毒素的质粒,总体积250 μL。混合A、B液室温避光孵育20 min。将混合液逐滴加入孔中,每孔培养基总量为2 mL,摇动培养板,轻轻混匀。培养6 h后,将孔内培养基换为完全RPMI-1640培养基,继续培养24 h后,倒置荧光显微镜下观察EGFP的表达,分析转染效果。
2.5Western blot鉴定BG4蛋白表达 pEGFP-N1-BG4质粒转染细胞48 h 后,弃去细胞培养基,用预冷的PBS洗细胞3次,吸净PBS,孔内加入150 μL RIPA,置冰上20 min,待充分裂解后,12 000×g、 4 ℃离心5 min,取上清,行SDS-PAGE分离待测蛋白,I 抗用抗FLAG-Tag于4 ℃孵育过夜,TBST洗膜3次,每次10 min。HRP标记的羊抗兔 II 抗按1 ∶5 000的比例稀释于5%脱脂奶粉中,室温下孵育2 h,TBST漂洗3次,每次10 min,ECL发光液显色。
2.6流式细胞术检测细胞周期 取收集转染48 h后的各组细胞,PBS洗3次,预冷的乙醇固定2 h,PBS洗去固定液,细胞沉淀中加 100 μL RNase A 溶液,重悬细胞,37 ℃水浴 30 min;再加入400 μL PI 染色液混匀,4 ℃避光孵育 30 min。于激发波长 488 nm 处记录实验结果。
2.7DAPI 法检测细胞凋亡 将6孔板内接种的AGS细胞分为空白对照(control)组、pEGFP-N1组和pEGFP-N1-BG4组,转染24 h后,PBS洗3次,每次2 min。每孔加入100 μL DAPI,室温染色5 min。吸除DAPI 染液,PBS洗3次,每次5 min,荧光显微镜下观察结果。
2.8HE染色 细胞用4%多聚甲醛固定10 min,蒸馏水洗涤2次,每次2 min。苏木素染10 min,自来水洗涤10 min,蒸馏水洗1次,1%氨水中返蓝2 min,自来水洗干净,95%乙醇5 s,伊红染液染1 min,70%乙醇洗2次,拍照观察。
2.9qPCR及Western blot测定hTERT表达 TRIzol法提取3组细胞总RNA,按TaKaRa公司Prime ScriptTMRT-PCR Kit逆转录为cDNA,用SYBR® Premix Ex TaqTMII体系进行荧光定量PCR,测定3组hTERT的表达。hTERT的上游引物序列为5’-GGAGGCTCGTGGAGACCATC-3’, 下游引物序列为5’-CATTTGCCAGTAGCGCTGGG-3’; β-actin的上游引物序列为5’-CCTGGCACCCAGCACAAT-3’, 下游引物序列为5’-GGGCCGGACTCGTCATAC-3’。反应条件为:94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,30个循环。用2-ΔΔCt法计算mRNA的相对表达量。细胞转染36 h后,提取细胞总蛋白,浓度测定后进行Western blot检测各组hTERT的蛋白表达(方法如前所述)。
3 统计学处理
采用SPSS 22.0进行统计学分析。数据以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 pMD18-T-BG4和pEGFP-N1-BG4载体的构建、鉴定和细胞转染
以pSANG10-BG4质粒为模板进行PCR扩增,显示扩增得到的BG4目的片段位于800~900 bp,与理论结果877 bp一致,无非特异扩增带出现,阴性对照无扩增条带。
PCR扩增BG4基因片段纯化回收后与pMD18-T载体进行连接,可见阳性菌落,将阳性菌提取质粒进一步用SacⅠ和PstⅠ双酶切,可见载体pMD18-T和目的片段BG4 2个条带,表明质粒连接正确,送测序并将阳性重组质粒命名为pMD18-T-BG4。
pEGFP-N1-BG4载体经SacⅠ和PstⅠ双酶切,结果出现的条带与预期的877 bp的小片段和4.7 kb的大片段相符合。经SacⅠ单切条带位于5 000~6 000 bp之间,与预期结果一致。pEGFP-N1-BG4测序显示插入片段序列与BG4序列完全一致,表明载体构建成功,见图1。

Figure 1.The sequencing results of pEGFP-N1-BG4 recombinant plasmid (partial).
细胞转染24 h后观察EGFP在AGS细胞中的表达,空白对照组无EGFP表达,而pEGFP-N1组和pEGFP-N1-BG4组可见绿色荧光蛋白的表达,见图2。图中可见pEGFP-N1 组绿色荧光蛋白表达量较pEGFP-N1-BG4多,可能是因为pEGFP-N1-BG4质粒较大。

Figure 2. EGFP expression in vitro imaging of AGS cells 24 h after gene transfection. A and B: pEGFP-N1 group; C and D: pEGFP-N1-BG4 group.
2 Western blot检测BG4的蛋白表达
pEGFP-N1-BG4组可见BG4蛋白的表达,BG4蛋白的分子量为30~35 kD,增强型绿色荧光蛋白分子量为27 kD,融合蛋白分子量为57~62 kD,目标蛋白分子量介于48~63 kD之间,与理论值相符。结果表明AGS细胞转染pEGFP-N1-BG4质粒成功表达BG4蛋白,见图3。

Figure 3.The image of Western blot analysis for determining the expression of BG4 fusion protein in the AGS cells. M: standard molecular weight protein marker; A: proteins from the AGS cells transfected by pEGFP-N1-BG4 vector; B: proteins from the AGS cells transfected by pEGFP-N1 vector.
3 流式细胞术检测细胞周期
与空白对照组及pEGFP-N1组相比,pEGFP-N1-BG4 组可使细胞周期阻滞于G1期,抑制细胞进入S 期(P<0.05),见图4。
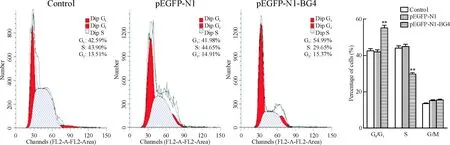
Figure 4.Flow cytometry analysis for cell cycle distribution.Mean±SD. n=3.**P<0.01 vs control group.
4 DAPI 法及HE染色检测细胞凋亡
空白对照组及pEGFP-N1组细胞核染色均一,表面光滑,圆形或类圆形;pEGFP-N1-BG4组细胞核轮廓不规则,出现偏位及新月形改变,出现核固缩的凋亡表现,见图5。
5 qPCR及Western blot测定hTERT的表达
qPCR结果表明,与control组相比,hTERT的mRNA表达在pEGFP-N1-BG4 组受到抑制(P<0.05)。Western blot实验表明,与control组相比,pEGFP-N1-BG4 组hTERT表达降低(P<0.05),与hTERT mRNA结果一致。空白对照组与pEGFP-N1 组比较 hTERT在mRNA和蛋白水平上的差异无统计学显著性,见图6。
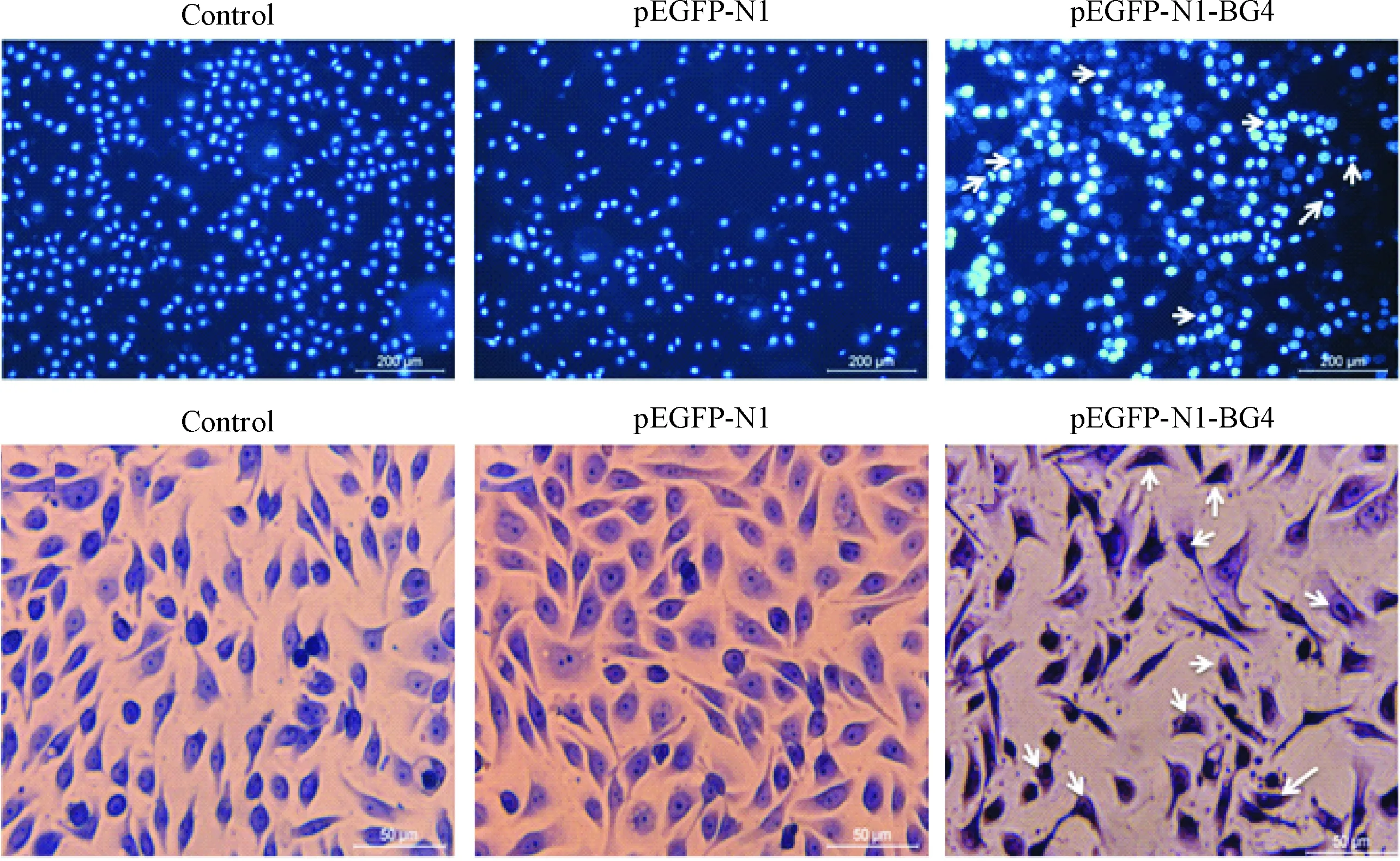
Figure 5.Detection of apoptosis by DAPI method (upper panel, ×200) and morphological observation (lower panel, ×400).
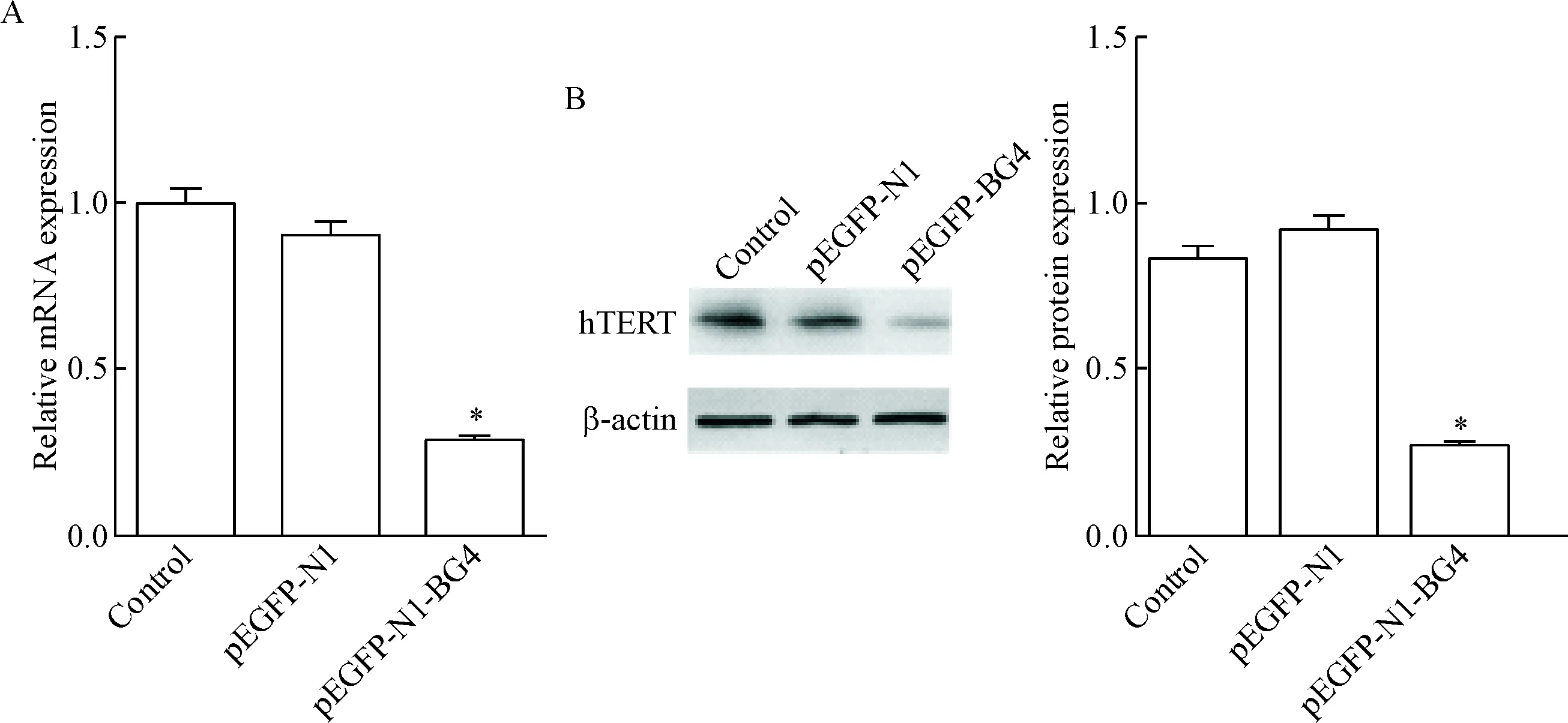
Figure 6.qPCR (A) and Western blot (B) analysis of the expression of hTERT. Mean±SD. n=3.* P<0.05 vs control group.
讨 论
G4结构广泛存在于端粒及基因的启动子区,调节基因的转录与翻译[9-11]。Fernando等[12]在2009年即提出针对DNA G4结构的单链抗体,当其在人类细胞内表达时,可以通过与预测存在的G4结构相互作用,影响一系列基因的表达。由于BG4与DNA端粒G4结构有很高的亲和力[13], Biffi等[14]于2014年报道利用BG4抗体发现在胃癌和肝癌组织中G4表达增高,因此端粒区的G4结构也成为本课题研究的切入点。真核细胞内端粒像两顶帽子盖在染色体的两端,由于其特殊的结构,早已成为抗肿瘤研究的重要领域。细胞端粒酶在细胞增殖中发挥重要作用,而在端粒酶的激活过程中,端粒酶的主要组成单位hTERT起关键作用,其表达与端粒酶活性密切相关,控制着端粒酶的活性。端粒是位于染色体末端的由TG构成的短串联序列,由于该区域富含G序列可以形成G4结构。本研究中细胞周期实验证实G4抗体真核表达载体pEGFP-N1-BG4转染AGS细胞可以阻止细胞进入S期,从而抑制细胞的增殖,这表明G4真核表达载体转染细胞后,主要通过BG4蛋白与细胞端粒区的G4结合发挥生物学功能,进一步研究表明是通过抑制hTERT活性而抑制端粒酶的表达,阻滞细胞周期进程而促进细胞凋亡。
综上所述,该研究在本课题组前期构建G4抗体原核表达载体pSANG10-BG4的基础上,成功构建了G4抗体真核表达载体pEGFP-N1-BG4,通过酶切、测序对该载体序列进行了鉴定,并成功在胃癌细胞AGS内表达。pEGFP-N1-BG4转染AGS细胞抑制细胞增殖,抑制端粒酶活性,其机制与下调hTERT mRNA与蛋白的表达有关,由于肿瘤细胞中端粒酶活性调控方式的多样性和复杂性,也可能有更多机制参与了该过程。由于研究的细胞株数量较少,在不同的肿瘤细胞株中是否具有相似的作用还需要实验论证,这些问题有待于更进一步的研究,具体的机制还需要进一步阐明,以便更好地研究其功能。

