1-磷酸鞘氨醇受体2介导PI3K/AKT/eNOS通路抑制甲型流感病毒诱导的病毒性肺炎*
尹香琳, 张婧瑶▲, 刘卫东, 多久和阳, 崔 弘△
(1延边大学医学院, 吉林 延吉 133002; 2金泽大学大学院医学部循环医科学血管分子生理学,日本 金泽 920-8640)
1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)作为细胞内“第二信使”参与调节多种生物学作用,如血管内皮细胞和淋巴细胞等多种细胞的增殖、分化、凋亡、黏附和迁移等。S1P是一种存在于血浆中的多效信号脂质分子[1],在保护血管内皮、诱导应急纤维形成、抑制平滑肌细胞迁移、保护心肌缺血/再灌注损伤及抑制黏附分子表达等方面的作用显著,这些功能都是通过作用于G蛋白偶联受体来实现的。S1P受体(S1P receptor, S1PR)共有5种,分别为S1PR1、S1PR2、S1PR3、S1PR4和S1PR5,其中S1PR1通过与Gi偶联并依赖Rac-GTP途径加强内皮细胞屏障功能, 抑制细胞的迁移,促进纤维的形成[2];然而,S1PR2是通过G12/13途径,激活小GTP酶Rho进而抑制Rac的活性,从而促进纤维的形成,抑制细胞的迁移[3-4]。
甲型流感病毒是成年人和老人病毒性肺炎中最为常见的病原体,罹患流感时肺炎的发生率为5%~38%。在病毒性肺炎中,肺血管内皮细胞是各种致损伤因素的主要靶细胞,在炎性介质作用下,血管壁通透性升高,血液成分渗出,造成水肿甚至出血;同时血管内皮细胞被激活,多种细胞黏附分子呈高表达,诱导大量单核巨噬细胞和淋巴细胞的聚集和过度活化,过度的炎症反应导致肺组织严重的病理损伤[5-6]。因此,减少肺微血管内皮细胞损伤,降低血管通透性,减轻肺水肿,是流感病毒性肺炎治疗中的关键环节之一。 在我们前期工作中发现S1PR2在肺血管内皮中高表达,且可增强血管内皮细胞钙黏蛋白的表达,从而抑制血管通透性。但是S1PR2在血管通透性以及肺炎中的作用机制尚未完全明了。因此,本实验主要研究S1PR2对甲型流感病毒诱导小鼠病毒性肺炎中的作用及作用机制,为临床治疗流感病毒性肺炎提供理论与实验依据。
材 料 和 方 法
1 材料
8~10周龄C57BL/6J小鼠和同窝出生的S1pr2-/-小鼠,体重为22~25 g,雌雄各半,由日本金泽大学医学部实验动物中心提供。甲型流感病毒鼠肺适应株FM1(A/FM/1/47,H1N1)购自美国典型培养物收藏中心(ATCC);S1PR2高效拮抗剂JTE-013(JTE)购自Sigma;抗蛋白激酶B(protein kinase B, PKB/AKT)抗体和抗内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)抗体均购自Cell Signaling Technology; 肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β和IL-6 ELISA试剂盒购自RB。
2 方法
2.1甲型流感病毒性肺炎动物模型建立 实验分为3组:野生型(wild-type mice,WT)组、S1pr2-/ -组和WT+JTE组。流感病毒鼠肺适应株FM1接种于9日龄鸡胚尿囊腔,35 ℃培养2 d,收集尿囊液,测定其血凝滴度,以Reed-Muench法测定半数致死量(50% lethal dose, LD50),稀释至25 μL,野生小鼠和S1pr2-/-小鼠经乙醚轻度麻醉后,滴鼻感染病毒液,制备甲型流感病毒性肺炎模型。JTE组为C57BL/6野生型小鼠, FM1滴鼻感染病毒性肺炎7 d前开始给药, 以30 mg/kg灌胃,每天1次,完全抑制动物体内的S1PR2活性。
2.2肺组织病理检查 滴鼻感染FM1病毒液4 d和6 d时,将小鼠腹腔注射戊巴比妥钠(30 mg/kg)进行麻醉,打开腹腔,切断腹主动脉放血;暴露气管和肺,用1根导管插入气管,结扎固定后,以距水平20 cm高度注入4%多聚甲醛进行内固定。内固定后拔出导管,结扎气管,将全肺置于4%多聚甲醛中固定24 h,然后将肺组织常规脱水,石蜡包埋,切片,HE染色,二甲苯透明,中性树胶固定封片。光镜下观察肺组织炎性细胞浸润、水肿以及损伤情况。
2.3支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的收集 滴鼻感染FM1病毒液4 d和6 d时,将小鼠腹腔注射戊巴比妥钠50 mg/kg,进行安乐死后,暴露气管,用一次性静脉留置针进行气管插管,丝线结扎固定,然后取生理盐水用1 mL注射器进行支气管肺泡灌洗。每次取1 mL生理盐水,经气管套管冲洗双侧支气管肺泡,反复注入回收3次后收灌洗液,重复3次,回收率超过80%。将BALF以4 ℃、150×g离心10 min,取上清,保存于-80 ℃冻存,备测生化指标,细胞进行分类计数。
2.4BALF的蛋白浓度测定和细胞分类计数 取-80 ℃冻存的BALF上清液,室温水浴快速化冻,BCA法测定蛋白含量。将BALF细胞沉淀以100 μL生理盐水重悬,取10 μL悬液与台盼蓝混匀,于血球计数板上进行细胞计数。
2.5BALF中TNF-α、IL-1β及IL-6含量的测定 取-80 ℃冻存BALF上清液,室温水浴快速化冻,按ELISA试剂盒操作说明书分别进行TNF-α、IL-1β及IL-6含量的测定。
2.6肺组织总蛋白的抽提及指标的检测 称取肺组织100 mg,并加入预冷的蛋白质抽提试剂,以超声波细胞粉碎机低速粉碎细胞,低温冷冻14 000 r/min 离心15 min 后,取上清液,按BCA法测定蛋白浓度。
2.7Western blot检测 p-AKT和p-eNOS 的蛋白水平 按每泳道加总蛋白20 μg进行SDS-PAGE,半干式电转移至PVDF膜上。37 ℃恒温摇床封闭3.5 h 后,加入抗p-AKT和p-eNOS多克隆抗体(1 ∶500), 4 ℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的 II 抗(1∶2 000),ECL显色,X线胶片曝光,经显影、定影、扫描后观察结果。应用ImageJ软件对扫描图像的目的条带进行吸光度分析,各目的条带与目的总蛋白条带的吸光度比值为目的蛋白的相对表达量。
3 统计学处理
采用GraphPad Prism 5.0进行统计分析。实验数据以均数±标准差(mean±SD)表示,多组间比较采用方差分析法,组间比较采用Bonferroni校正t检验,以P<0.05为差异有统计学意义。
结 果
1 S1PR2对甲型流感病毒诱导肺炎的作用
1.1肺组织病理变化 野生小鼠和S1pr2-/-小鼠经滴鼻感染FM1病毒4 d和6 d时,病理切片检查结果表明,FM1病毒感染的肺组织内均可见以中性粒细胞为主的细胞浸润、间质肥厚和肺泡水肿等肺炎和肺损伤病理现象。与对照组比较,S1pr2-/-组及JTE处理组这些病理现象更加显著,表明S1PR2基因缺陷加重病毒性肺炎,见图1。
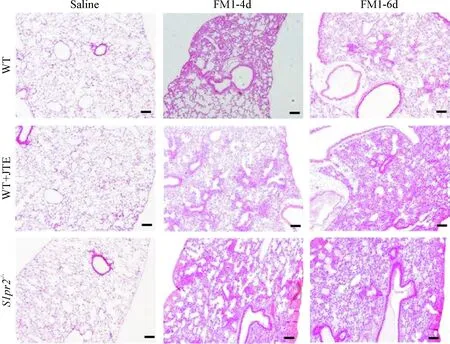
Figure 1.The effects of S1PR2 deficiency on influenza A virus-induced viral pneumonia. The representative images of HE-stained sections of the lung tissues were showed (×100). The scale bar=100 μm.
1.2BALF中蛋白含量和细胞数的测定 野生型和S1pr2-/-小鼠经滴鼻感染FM1病毒4 d和6 d时,发现BALF中的总蛋白浓度和总细胞数均显著增加。与对照组比较,S1pr2-/-组和JTE处理组中的总蛋白浓度和总细胞数的增加更加显著(P<0.01),见图2。

Figure 2.The effects of S1PR2 deficiency on influenza A virus-induced increases in total protein concentration and total cell numbers in the BALF. A: total protein concentration in the BALF; B: total cell numbers in the BALF. BALF was prepared from the mice with or without influenza A virus challenge. Mean±SD. n=5.** P<0.01 vs WT group.
1.3BALF中TNF-α、IL-1β和IL-6含量的测定 甲型流感病毒感染使肺内促炎性细胞因子过度激活与适应性免疫相关的细胞因子被抑制,是H1N1流感病毒感染所致肺损伤的重要原因。野生型和S1pr2-/-小鼠经滴鼻感染FM1病毒4 d和6 d时,发现BALF中的TNF-α、 IL-1β和IL-6含量显著增高;与对照组比较,S1pr2-/-组和JTE处理组的增加更加显著(P<0.01),见图3。

Figure 3.The effects of S1PR2 deficiency on influenza A virus-induced changes of TNF-α (A), IL-1β (B) and IL-6 (C) concentrations in the BALF. Mean±SD. n=5. ** P<0.01 vs WT group.
2 S1PR2对甲型流感病毒诱导的肺炎中p-AKT和p-eNOS 蛋白水平的影响
2.1肺组织的AKT 磷酸化水平测定 Western blot实验结果显示,在甲型流感病毒感染4 d和6 d时, 模型组的小鼠肺组织中,PI3K下游靶点AKT磷酸化水平均增高。与对照组比较,S1pr2-/-组和JTE处理组的增高更加显著(P<0.01),见图4。

Figure 4.S1PR2 deficiency augmented influenza A virus-induced phosphorylation of AKT in the lung tissues. Mean±SD. n=5. **P<0.01 vs WT group.
2.2肺组织的eNOS 磷酸化水平的测定 Western blot实验发现,在甲型流感病毒感染4 d和6 d时,野生型和S1pr2-/-小鼠肺组织的eNOS磷酸化水平均增高。与对照组比较,S1pr2-/-组和JTE处理组肺组织的eNOS磷酸化水平增高更加显著(P<0.05),见图5。
讨 论
S1P是一种具有多种生物活性的鞘脂类代谢产物,由鞘氨醇激酶1/2 (sphingosine kinase 1/2,SphK1/2)磷酸化鞘氨醇产生。S1PR在血管系统中广泛表达,是维持上皮细胞和内皮细胞屏障功能重要的信号分子[7-8]。S1P信号通路通过调节黏附连接和紧密连接组装、细胞骨架重排、黏着斑形成,发挥对屏障功能的调控作用,因此S1P信号通路可能成为改善急性肺损伤、炎症性肠病和败血症等疾病中屏障功能紊乱的新靶点[8]。Hunag等[9]的研究显示在高果糖诱导的脂质沉积中,激活SphK1/S1P信号通路,可升高SphK1、S1P和S1PR1蛋白水平,进一步激活NF-κB,释放出IL-1β、IL-6和TNF-α等,从而触发炎症反应。并且SphK1/S1P 信号通路与肾脏炎症有着密切的关系,在肾脏炎性反应中可以刺激系膜细胞增殖,促进炎性介质合成以及细胞外基质积聚。S1P在炎症疾病中起着很重要的作用。
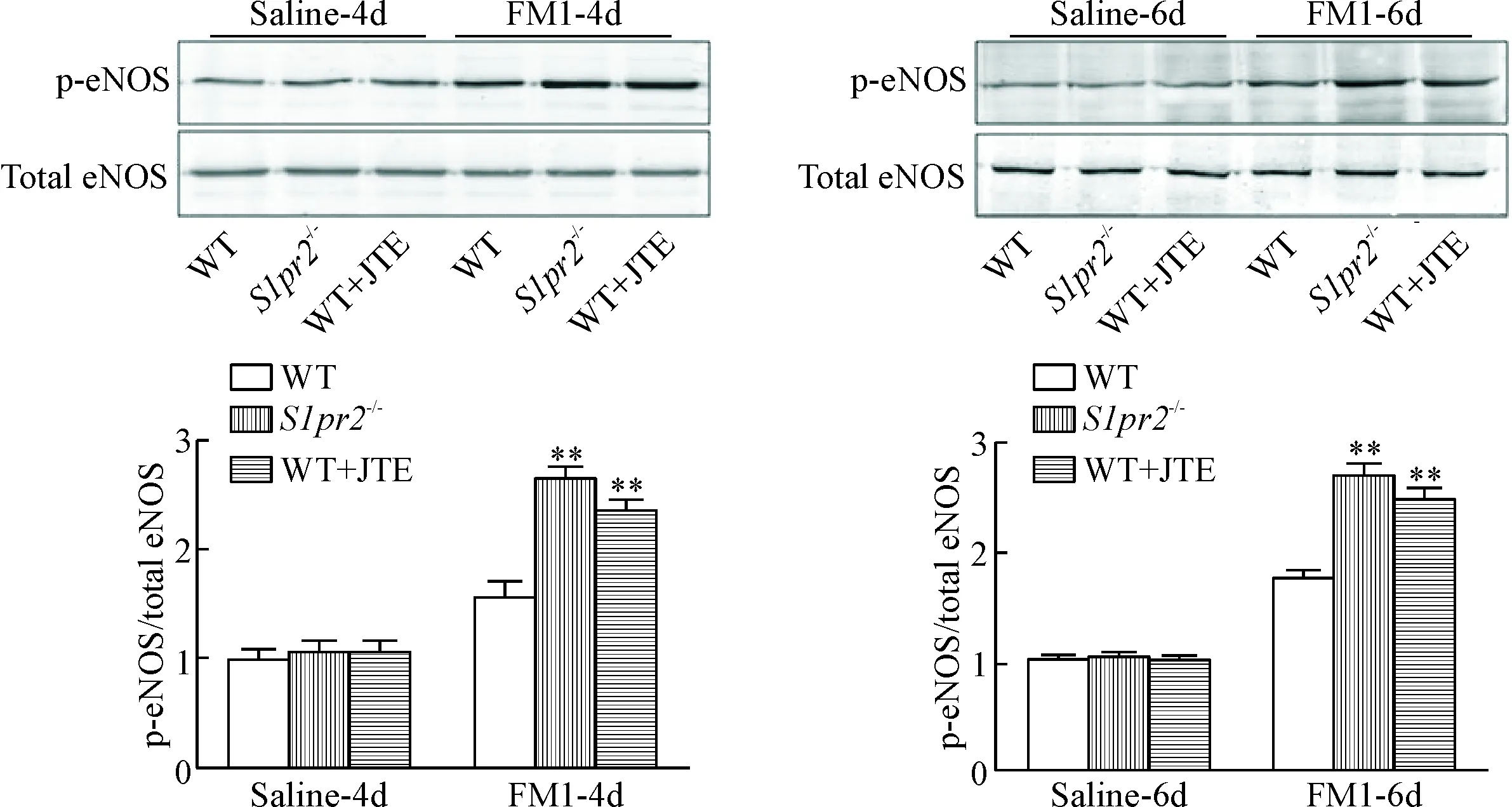
Figure 5.S1PR2 deficiency augmented influenza A virus-induced phosphorylation of eNOS in the lung tissues. Mean±SD. n=5. **P<0.01 vs WT group.
甲型H1N1流感病毒感染后,中性粒细胞在肺内和循环血液中各种炎性刺激的作用下迁移到肺泡腔内,释放一系列损伤介质(IL-1、IL-6、IL-8、TNF-α和MCP-1等),引起弥漫性肺泡损伤和血管内皮损害,导致急性肺水肿或急性呼吸窘迫综合征[10-12]。Teijaro等[5]研究发现,甲型流感病毒感染导致的致死性细胞因子风暴中,内皮细胞尤其是肺内皮细胞起着主导作用,S1PR1激动剂通过在内皮细胞的表达,抑制致死性细胞因子的产生,减少甲型流感病毒感染动物的死亡率,表明S1P介导S1PR1抑制甲型流感病毒感染的肺部炎症。而对肺内皮细胞高表达的S1PR2对甲型流感病毒感染肺炎的作用尚不清楚。
本研究利用S1pr2-/-小鼠,主要观察在肺内皮细胞高表达的S1PR2对甲型流感病毒感染肺炎的作用及作用机制。与流感病毒性肺炎模型组的对照组相比,JTE处理组和S1pr2-/-组显著恶化甲型流感病毒性肺炎。甲型流感病毒感染4 d和6 d时,模型组均呈现肺间质肥厚,肺泡炎症细胞浸润等肺炎病理变化,肺炎严重程度在JTE处理组和S1pr2-/-组中更加严重。并且,滴鼻感染FM1病毒4 d和6 d时,发现在野生型和S1pr2-/-小鼠BALF中的总蛋白浓度和总细胞数均显著增加。与模型组中的对照组比较,JTE处理组和S1pr2-/-组的总蛋白质浓度和总细胞数增加更加显著。甲型流感病毒感染使肺内促炎性细胞因子过度激活与适应性免疫相关的细胞因子被抑制,是H1N1流感病毒感染所致肺损伤的重要原因。同样,甲型流感病毒感染4 d和6 d时,与WT组比较,JTE处理组和S1pr2-/-组BALF中的TNF-α、IL-1β和IL-6炎症因子含量显著增高。以上结果说明,S1PR2基因缺乏或S1PR2活性抑制均恶化甲型流感病毒性肺炎的发生发展,S1PR2在甲型流感病毒性肺炎中起着重要的作用。
S1P/SphK是诱发FcεR1激活的信号通路之一,早在1996年Choi等[13]首先发现了在鼠肥大细胞中FcεR1刺激诱导SPHK活性增加,促使体内S1P水平升高。此外,FcεR1还通过激发Ca2+动员抑制产生SphK的抑制剂二氢鞘氨醇(DL-dihydrosphingosine),使S1P合成增加。FcεR1/SphK通路是通过依赖网格蛋白活化的PI3K而参与信号传递。表皮生长因子受体(epidermal growth factor receptor,EGFR)/PI3K/AKT信号通路是生物体内一条非常重要的生存信号通路。EGFR通过二聚化后刺激Ras蛋白,导致磷酸化级联反应的发生来激活PI3K/AKT信号通路,从而引起炎症的发生发展。Biswas等[14]报道了S1P通过PI3K/AKT信号通路来介导内皮细胞的迁移,报道显示,PI3K与流感病毒的感染过程有关。流感病毒可以激活细胞的PI3K通路,加快流感病毒的增殖。因此,本课题组通过Western blot检测在病毒性肺炎中PI3K/AKT信号通路活性的变化,结果发现与空白对照组相比,模型组磷酸化的AKT蛋白水平升高。与对照组比较,JTE处理组和S1pr2-/-组的升高程度更显著。PI3K/AKT信号通路下游分子eNOS是调控内皮源性NO产生的关键酶。活化的AKT主要通过磷酸化eNOS促进内源性NO生成,NO又进一步促进炎性细胞因子释放,参与各种肺脏的病理过程。Dimmeler等[15]研究发现激活的eNOS参与了VEGF引起的血管内皮细胞迁移。Bucci等[16]证实eNOS基因敲除的小鼠血管通透性明显降低。Gonzalez等[17]报道NO能够破坏体外培养的内皮细胞的VE-cadherin黏附连接形成的屏障,使内皮细胞通透性增加。我们的研究结果也发现,流感病毒感染4 d和6 d时,与对照组的野生鼠比较,小鼠肺组织的eNOS磷酸化程度在流感病毒感染的JTE处理组和S1pr2-/-组显著升高,说明S1PR2在病毒性肺炎中通过AKT/eNOS信号途径,抑制过多的NO生成而抑制血管通透性,进而抑制流感病毒性肺炎的发展。
本研究证实了S1PR2在H1N1流感病毒性肺炎中的重要作用,S1PR2通过PI3K/AKT/eNOS信号转导途径,抑制NO的生成,又进一步抑制血管通透性和炎性细胞因子释放,抑制H1N1病毒性肺炎的发生发展。目前甲型流感的抗病毒治疗药物只有奥司他韦(达菲)、扎那米韦等神经氨酸酶抑制剂。因此,研制多种有效治疗甲型流感的治疗药物是一项非常重要的工作。S1PR2选择性激动剂有望成为治疗流感病毒性肺炎新的治疗药物。

