DAPT阻断Notch通路对动脉粥样硬化型缺血性脑卒中大鼠的保护作用*
温艺超, 陈伟燕, 谢富华, 陈洁茹
(广州医科大学附属第二医院重症医学科, 广东 广州 510260)
缺血性脑卒中(cerebral ischemic stroke,CIS)是由于脑部血液供应障碍、缺血以及缺氧导致的脑组织缺血性坏死或者脑软化[1]。脑卒中发病机制复杂且具有严重危害性,一旦发生尚无特效的治疗方式,为全球第二大致残致死疾病,故如何有效防治脑卒中是当前医学专家致力研究的重点领域[2-3]。流行病学以及动物实验研究等成果显示,性别、年龄、心脏病、糖尿病、高血压、吸烟以及高脂血症等均是CIS发生的危险因素[4]。动脉粥样硬化(atherosclerosis,AS)是由不健康的生活方式如高脂饮食、运动量少及生活压力大等引起的机体脂代谢紊乱,从而诱导局部慢性炎症反应以及氧化应激损伤引起的[5]。已有研究证实AS是引发心血管疾病的重要危险因素之一[6]。脑动脉粥样硬化导致血管腔狭窄、阻塞引起脑组织缺血、缺氧坏死。
Notch信号通路由Notch配体、Notch受体以及细胞内效应器分子3个部分组成。已有研究证实脑组织缺血损伤后可通过激活Notch信号通路抑制神经干细胞向神经元和胶质细胞分化,由此维持神经干细胞增殖来保护缺血组织[7]。γ-分泌酶通过组成型酶切能够激活Notch通路相关基因的表达,因此γ-分泌酶抑制剂DAPT能够抑制Notch信号通路信号的传递。研究发现DAPT阻断Notch信号通路后,由缺血诱导的Notch1和Hes1表达以及细胞增殖显著下降[8]。Notch信号通路相关分子在正常组织中呈低表达,而脑缺血后其表达可被激活,因此通过研究Notch信号通路与动脉粥样硬化以及缺血性脑卒中的关系,可以增加对动脉粥样硬化型缺血性脑卒中发病机制的了解[9]。本研究通过建立动脉粥样硬化型缺血性脑卒中大鼠模型,探索Notch信号通路在动脉粥样硬化型缺血性脑卒中的作用。本研究结果可为阐明缺血性脑卒中性血管疾病的理论基础提供新思路,为临床诊断治疗提供新策略。
材 料 和 方 法
1 实验动物与分组
SPF级成年雄性SD大鼠24只,体重(250±20) g,购自广州医科大学实验动物中心。采用数字随机法随机分为对照(control,6只)组和模型(18只)组,AS模型建立后随机分为假手术(AS-sham)组、缺血处理(AS-ischemia)组和DAPT处理(AS-ischemia-DAPT)组,每组6只。
2 主要试剂
DAPT购自Tocris Bioscience;戊巴比妥钠购自上海信裕生物科技有限公司;大鼠白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒购自Bio-Swamp;RIPA裂解液购自上海碧云天公司;抗Notch1、Hes1、核因子κB(nuclear factor-κB,NF-κB)、Toll样受体4(Toll-like receptor 4,TLR4)抗体和羊抗兔IgG购自Abcam。
3 主要方法
3.1大鼠AS和AS-ischemia模型的建立 对照组大鼠给予基础饲料喂养,AS模型组均给予高脂饲料(2%胆固醇、10%猪油、10%蛋黄粉、0.5%胆酸钠、8%全脂奶粉和69.5%基础饲料)喂养,每天30~40 g,自由摄水,并定期观察体重、饮水、外观以及活动情况,饲养6周。从第7周开始对AS-ischemia-DAPT组进行隔天皮下注射DAPT (5 mg/kg),control组、AS-sham组和AS-ischemia组隔天皮下注射同等体积的生理盐水,注射周期为6周。然后参考Mestl等[10]的方法制作双侧颈总动脉(2VO)结扎模型。AS建模结束后,缺血性脑卒中建模前实验动物禁食8 h,腹腔注射40 mg/kg戊巴比妥钠麻醉,仰卧固定并沿颈中线切开,分离出双侧颈总动脉;control和AS-sham组动物仅作双侧颈总动脉分离但不结扎,AS-ischemia和AS-ischemia-DAPT组动物采用尼龙线结扎双侧颈总动脉。造模6 h后心脏采血,取颈动脉组织固定于4%多聚甲醛用于组织病理观察,取动脉组织和脑组织于EP管中保存于-80 ℃备用。
3.2HE染色检测大鼠颈动脉结构变化 将大鼠颈动脉组织从多聚甲醛中取出,使用梯度浓度乙醇脱水以及使用二甲苯透明,石蜡包埋、切片。将切片在二甲苯中脱蜡处理,经蒸馏水转入苏木精染色,1%盐酸乙醇分色20 s,流水冲洗后0.5%伊红染液染色,乙醇脱水透明,封片,显微镜下观察分析。
3.3Western blot检测大鼠颈动脉组织中Notch1和Hes1以及脑组织中NF-κB和TLR4的蛋白表达 取组织50 mg于1.5 mL EP管中并加入含蛋白酶抑制剂的RIPA裂解液1 mL,每管加入2粒玻璃珠,匀浆器匀浆;4 ℃、12 000 r/min离心15 min,取上清保存备用。使用BCA试剂盒进行蛋白定量。每组取30 μg动脉组织蛋白进行SDS-PAGE,检测Notch1和Hes1蛋白表达情况;每组取30 μg脑组织蛋白进行SDS-PAGE,检测NF-κB和TLR4蛋白表达情况;以GAPDH作为内参照,使用BandScan 5.0软件进行图像分析。
3.4血脂以及血清炎症因子的检测 采用全自动生化分析仪检测大鼠血液甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C);使用ELISA试剂盒检测大鼠血清炎症因子IL-6和TNF-α的水平。
4 统计学处理
使用SPSS 19.0统计分析软件进行数据的统计学分析。实验数据均采用均数±标准差(mean±SD)表示,各组之间的比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验,以P<0.05表示差异具有统计学意义。
结 果
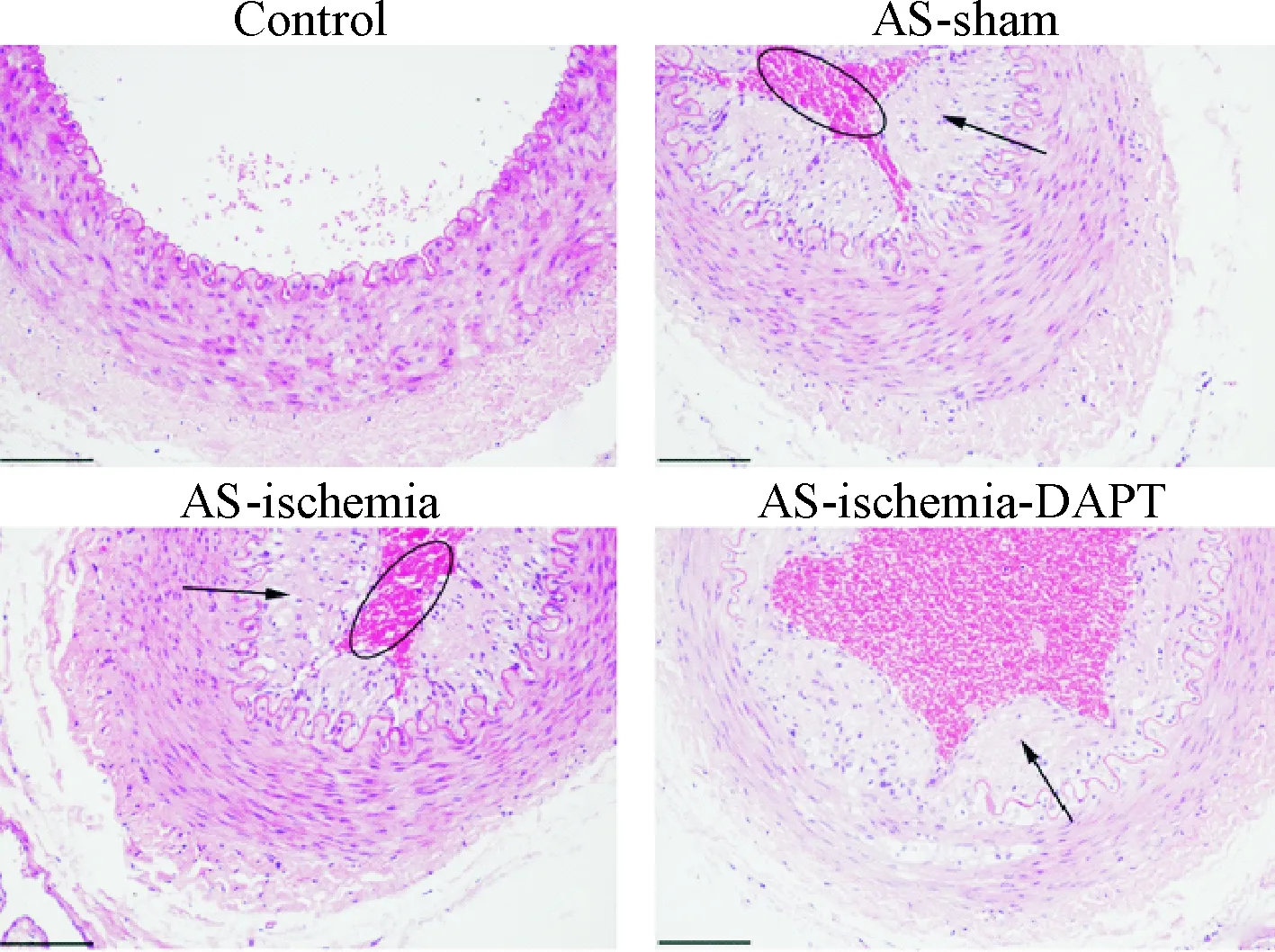
1 抑制Notch通路对大鼠颈动脉组织结构的影响
对照组大鼠动脉血管壁光滑完整,无脂质沉积、斑块形成和血管狭窄现象出现。AS模型大鼠动脉血管较正常组呈现出内膜层增厚、血管狭窄、形成粥样硬化斑块等明显病理形态改变。DAPT抑制Notch信号通路以后能够降低内膜层增厚以及血管狭窄,明显减轻动脉粥样硬化的病变程度,见图1。
2 DAPT显著抑制大鼠颈动脉Notch1和Hes1蛋白的表达
AS以及AS缺血性脑卒中大鼠颈动脉组织中Notch1和Hes1蛋白表达显著高于正常大鼠;但与AS缺血性脑卒中组相比,DAPT处理后大鼠颈动脉组织中Notch1和Hes1蛋白表达显著下降(P<0.05),见图2。这一结果说明AS能够激活Notch通路,但DAPT处理能够显著抑制AS诱导的Notch通路的激活。
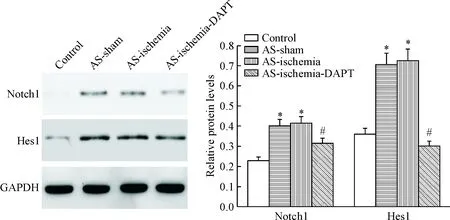
Figure 2.The protein expression levels of Notch1 and Hes1 in the rat arterial tissues. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs AS-ischemia group.
3 抑制Notch对大鼠血脂水平的影响
与对照组相比,AS-sham组以及AS-ischemia组大鼠血液指标TG、TC、HDL-C和LDL-C的水平显著升高(P<0.05);与AS-ischemia组相比,使用DAPT抑制Notch信号通路以后大鼠TG、TC、HDL-C和LDL-C的水平显著降低(P<0.05),见图3。
4 抑制Notch对大鼠血清炎症因子的影响
与对照组相比,AS-sham组以及AS-ischemia组大鼠血清中促炎因子IL-6和TNF-α的水平显著升高(P<0.05),且AS-ischemia组大鼠血清中促炎因子IL-6的水平显著高于AS-sham组(P<0.05);与AS-ischemia组相比,使用DAPT抑制Notch信号通路以后大鼠血清中IL-6和TNF-α的水平显著降低(P<0.05),见图4。
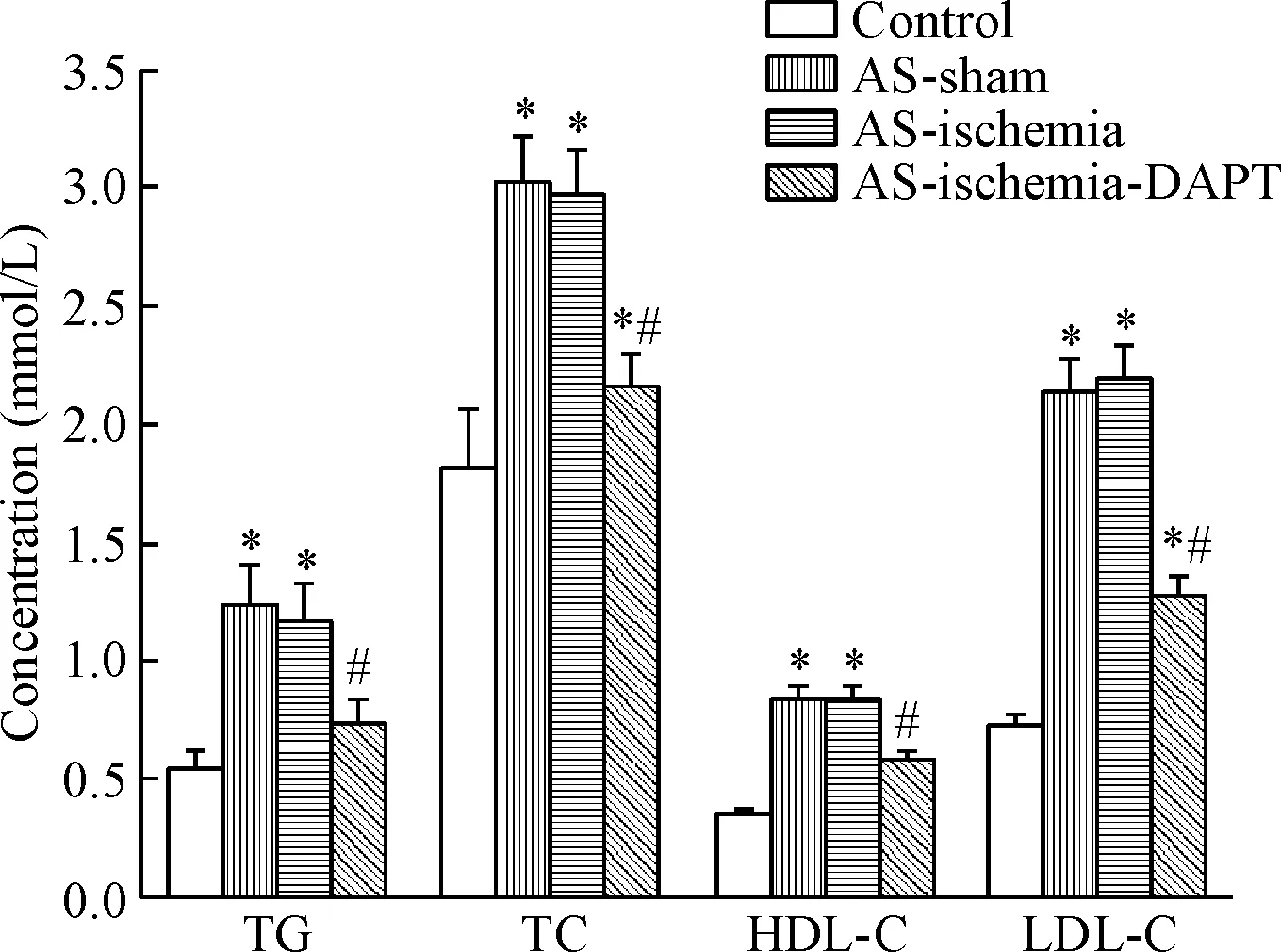
Figure 3.The effects of blocking Notch pathway by DAPT on lipid levels of the rat. Mean±SD. n=6. *P<0.05 vs control group; #P<0.05 vs AS-ischemia group.
5 抑制Notch对大鼠脑组织中NF-κB和TLR4蛋白水平的影响
各组大鼠脑组织中NF-κB和TLR4的蛋白水平示,与对照组相比,AS-sham组和AS-ischemia组大鼠脑组织中NF-κB和TLR4的蛋白水平显著升高(P<0.05),且AS-ischemia组大鼠脑组织中NF-κB和TLR4的蛋白表达水平显著高于AS-sham组(P<0.05);与动脉粥样硬化脑缺血大鼠相比,经过DAPT抑制Notch通路以后动脉粥样硬化脑缺血大鼠脑组织中NF-κB和TLR4显著降低(P<0.05),见图5。
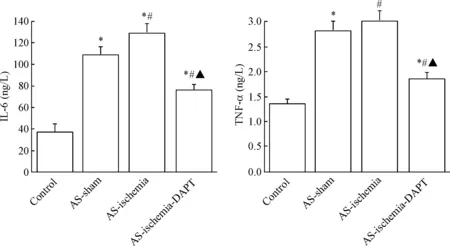
Figure 4.The rat serum levels of IL-6 and TNF-α. Mean±SD. n=6. *P<0.05 vs control group; #P<0.05 vs AS-sham group; ▲P<0.05 vs AS-ischemia group.
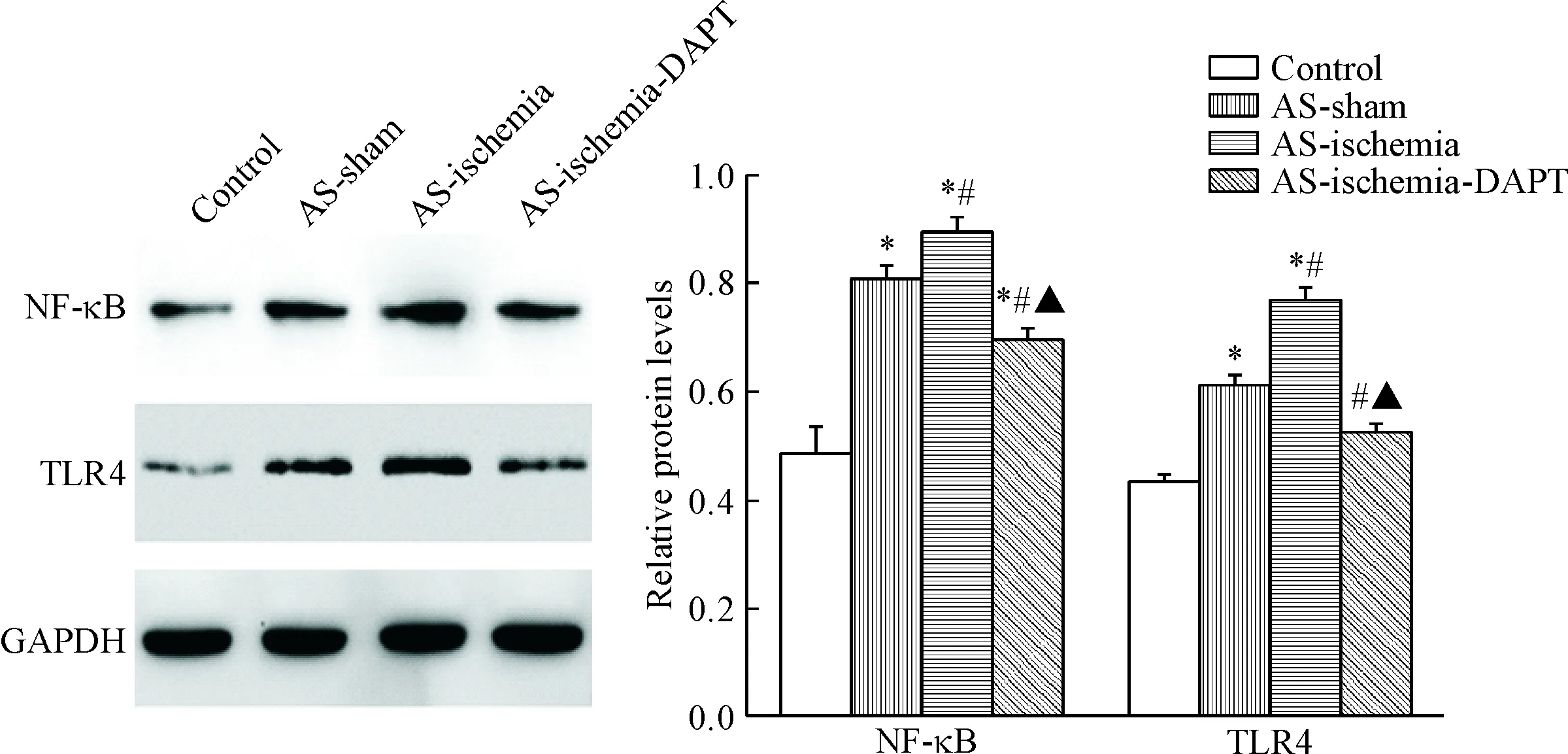
Figure 5.The protein expression levels of NF-κB and TLR4 in the rat brain tissues. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs AS-sham group; ▲P<0.05 vs AS-ischemia group.
讨 论
颈动脉粥样硬化被认为是急性缺血性脑卒中的主要病因,急性脑梗死的危险因素和临床预后与颈动脉血管狭窄程度呈明显正相关[11]。动脉粥样硬化能够引起血管内膜增厚、损伤形成斑块,导致血管狭窄。动脉粥样硬化斑块脱落形成栓子、血管狭窄以及引起血液流变动力学改变是诱发脑缺血的主要机制[12]。已有研究证实AS发生的过程中LDL-C经过氧化修饰形成氧化低密度脂蛋白(oxidized low-density lipoprotein, ox-LDL)损伤血管内皮细胞、促进泡沫细胞的形成和促炎介质的释放、激活氧化应激反应,从而导致AS斑块纤维帽变薄,增加CIS的风险[13]。高TG也是AS发生的危险因素之一,其可降低LDL-C的颗粒大小,诱发炎症反应以及增加血管内膜的通透性,促进AS的发生[14]。因此,全面控制血脂指标,抑制血管内膜炎症反应,稳定AS斑块,是预防CIS的关键。
Notch通路由一类编码高度保守的细胞表面受体基因组成,通过细胞间的信号传递作用参与细胞的增殖、分化和凋亡调控[15]。已有研究发现ox-LDL能够显著提高Notch1受体在巨噬细胞中的表达,证实Notch信号通路的表达与动脉粥样硬化形成相关[16]。Notch信号通路的激活不仅可以促进巨噬细胞活化释放促炎因子,还可以通过调节Th17细胞分化参与炎症反应[17]。Notch通路中配体与受体结合后经γ-分泌酶进行组成型酶切激活相关基因的表达。γ-分泌酶抑制剂DAPT能够抑制Notch信号通路传递。本研究通过使用DAPT抑制大鼠体内Notch信号通路活性,探究其对动脉粥样硬化缺血性脑卒中大鼠的影响。结果发现,AS模型大鼠动脉血管内膜明显增厚,TG、TC、HDL-C和LDL-C水平以及血清炎症因子IL-6和TNF-α水平显著升高,且AS缺血性脑卒中模型组IL-6和TNF-α水平显著高于AS模型大鼠。但是使用DAPT抑制Notch信号通路活性以后大鼠动脉血管内膜增厚得到改善,血清炎症因子IL-6和TNF-α水平也显著降低。本研究结果表明抑制Notch通路能够通过抑制促炎因子的释放显著改善AS缺血性脑卒中的症状。
在缺血性脑损伤中,TLR4可以通过一系列的信号级联反应,诱导IL-6、IL-1和TNF-α等炎症因子的表达,激活炎症反应。NF-κB位于TLR4下游信号通路的枢纽中心,参与细胞增殖、凋亡中的炎症反应和免疫应答,在动脉粥样硬化形成以及缺血性脑卒中的脑损伤中发挥重要作用[18]。NF-κB激活后可以通过调节靶基因的活性参与炎症反应、细胞凋亡和自由基损伤等过程。在动脉粥样硬化缺血性脑卒中,NF-κB的激活是引起脑组织继发性损伤的重要枢纽[19]。本研究发现动脉粥样硬化大鼠脑组织中NF-κB和TLR4的蛋白表达水平显著高于正常大鼠,且动脉粥样硬化缺血性脑卒中大鼠大脑组织中NF-κB的水平显著高于动脉粥样硬化大鼠;且使用DAPT抑制Notch信号通路以后动脉粥样硬化缺血性脑卒中大鼠脑组织中的NF-κB和TLR4蛋白水平显著降低。Notch通路对于NF-κB TLR4的作用可以表现为激活,也可以表现为抑制。肝星状细胞中抑制Notch可以降低NF-κB的活性,但是在小鼠造血前体细胞中Notch可以促进NF-κB通路中p60等的表达。在大鼠肾脏缺血再灌注损伤的研究中发现DAPT抑制Notch通路可以通过降低NF-κB/TLR4的表达抑制炎症反应和细胞凋亡[20-21]。但是Notch通路在动脉粥样硬化缺血性脑卒中的作用机制尚不清楚。本研究结果发现,抑制Notch通路可以通过降低动脉粥样硬化缺血性脑卒大鼠脑组织中NF-κB/TLR4通路的活化,抑制大鼠脑组织中的炎症反应,发挥脑保护作用[22]。
综上所述,本研究通过建立AS缺血性脑卒中大鼠模型,从血脂水平和炎症反映两个方面探究了Notch通路对AS缺血性脑卒中的影响。研究发现抑制Notch通路能够显著改善AS缺血性脑卒中大鼠的血脂水平以及降低其血清炎症因子水平,达到改善AS的作用。不仅如此,抑制Notch还可以通过降低AS缺血性脑卒中大鼠脑组织中NF-κB/TLR4通路的表达抑制脑组织炎症反应,发挥对动脉粥样硬化缺血性脑卒中的保护作用。

