原儿茶酸对金黄色葡萄球菌性肺炎模型小鼠的保护作用及相关机制研究
饶春晖 陆淼炯 杨 燕
肺炎在全球具有较高的发生率和病死率,是儿童死亡的重要原因,据统计,2010—2011年有超过100万儿童死于肺炎[1]。金黄色葡萄球菌(staphylococcus aureus,SA)是分布极为广泛的感染性病原体之一,SA能够引起包括菌血症、感染性心内膜炎、皮肤和软组织感染、骨髓炎、化脓性关节炎、肺部感染(如肺炎和脓胸)、脑膜炎、中毒性休克综合征和尿路感染等感染性疾病[2-3]。经临床数据统计,在SA引起的所有感染性疾病中,肺炎发病率位居第二,并伴随高死亡率[4]。原儿茶酸(protocatechuic acid,PA),是一种常见的酚酸类化合物,也是人类日常饮食中常见的化合物,存在于多种食用植物中[5],临床上主要用于治疗慢性气管炎。目前研究[6-9]发现,PA还具有抗氧化、抗菌抗癌、抗溃疡、降糖、抗老化、抗纤维化、抗病毒、抗炎、镇痛、抗动脉粥样硬化等生物学活性。本实验通过气道滴注建立SA肺炎模型小鼠,观察PA是否对SA肺炎小鼠具有保护作用,并进一步通过RAW264.7细胞实验探讨PA保护作用的可能机制,希望为SA肺炎的临床治疗提供新的思路。
1 实验材料
1.1 实验动物 清洁级C57BL/6雌鼠36只,6~8周龄,体质量16~20g,购自浙江大学实验动物中心,动物合格证号:SCXK(沪)2013-0016。RAW264.7细胞由浙江大学医学院病原微生物实验室馈赠。
1.2 试剂及仪器 原儿茶酸于阿拉丁试剂官网订购(批号P104383,规格250mg)。金黄色葡萄球菌(杭州市中医院提供)。异戊巴比妥钠(批号20180102)、小鼠白介素 6(interleukin-6,IL-6)(批号4313607)和小鼠肿瘤坏死因子(tumor necrosis factor-α,TNF-α)(批号 169143001)ELISA 检测试剂盒购置于美国Ebioscience公司。兔抗鼠多克隆抗体p38丝裂原活化蛋白激酶(P38 mitogen-activated protein kinase,P38MAPK)(批号 9212S)和磷酸化(p)-P38MAPK(批号 #9215S)、胞外信号调节激酶(extracellular signal-regulated kinase,ERK MAPK)(批号 #9102)和 p-ERK MAPK(批号 #4370S)、c-Jun氨基末端激酶 (c-Jun N-terminal kinase,JNK MAPK)(批号 #9258) 和 p-JNK MAPK(批号4668S)、核转录因子-κB P65 (nuclear factor κB P65,P65)(批号 8242S)和 p-P65(批号 3033S)(Cell Signaling Technology公司,美国)、总RNA提取试剂盒(批号07062018)、逆转录试剂盒(批号19122019)、荧光定量 PCR检测试剂盒(批号26122019)均购置于北京康为世纪生物科技有限公司。Western Blot电泳仪(BIO-RAD,美国),光学显微镜(OLYMPUS,日本)等。
2 实验方法
2.1 SA菌体培养 取一管金黄色葡萄球菌冻存液,室温解冻后,吸取加至50mL无菌离心管中,含经高压灭菌的10mL胰蛋白胨大豆肉汤培养基(Tryptic soy broth,TSB),放于 37℃摇床过夜培养,随后从中吸取100μL加入至新鲜无菌的10mL TSB液体培养基中,摇菌4h,离心后加无菌磷酸缓冲盐溶液(phosphate buffer saline,PBS)重悬备用。
2.2 小鼠SA肺炎模型建立 小鼠随机分笼,并在无特定病原体(specific pathogen free,SPF)级实验室自由进食进水饲养,待小鼠适应2~3天后开始实验,随机分为对照组、模型组和PA干预组,各12只。以12μL/1g体质量的1.5%异戊巴比妥钠溶液量对小鼠行腹腔注射麻醉,对模型组小鼠和PA干预组小鼠麻醉后行气道滴注金黄色葡萄球菌,菌量为5×107菌落形成单位(colony-forming units,CFU),其中 PA 干预组小鼠麻醉前1h腹腔注射0.2mL PA(30mg/kg);对照组小鼠行气道滴注等量的无菌PBS。
2.3 细胞感染模型建立 RAW264.7细胞随机分为对照组、模型组和PA干预组进行铺板。对照组:RAW264.7细胞置于37℃、含5%CO2的细胞培养箱中培养,取对数期细胞用于实验,细胞计数后以5×105/mL的密度铺于6孔板中;模型组:RAW264.7细胞计数后,培养过夜至细胞贴壁,滴加菌量为1×107CFU的SA刺激细胞;PA干预组:RAW264.7细胞计数后,培养过夜至细胞贴壁,滴加PA(50μM)预处理1h,加菌量为1×107CFU的SA刺激细胞。
2.4 小鼠肺组织病理检测 小鼠感染12h后,每个实验组各取4只小鼠,断颈处死并固定,解剖小鼠打开胸腔,小心取出全肺,浸放于4%多聚甲醛中固定,送谷歌生物公司常规制备石蜡切片并行苏木精伊红染色方法(hematoxylineosin staining,HE)染色,于光学显微镜下观察小鼠肺部病灶形态变化。
2.5 小鼠肺泡灌洗液(BALF)抽取 小鼠感染12h后,断颈处死于70%酒精浸泡后,固定在解剖板上,打开胸腔,暴露气管和肺组织,吸取0.8mL无菌的PBS缓慢冲洗肺组织3次,回收支气管肺泡灌注液(BALF),回收率均在80%以上,回收的肺泡灌洗液于-80℃保存备用或冰上存放现用,用于炎症因子检测实验。
2.6 RT-PCR检测 使用RNA提取试剂盒分别提取各组小鼠肺组织匀浆和RAW264.7细胞总RNA,浓度测定后进行定量,根据逆转录试剂盒和荧光定量PCR检测试剂盒,在mRNA水平检测所有样本TNF-α和IL-6的表达,引物信息见表1。
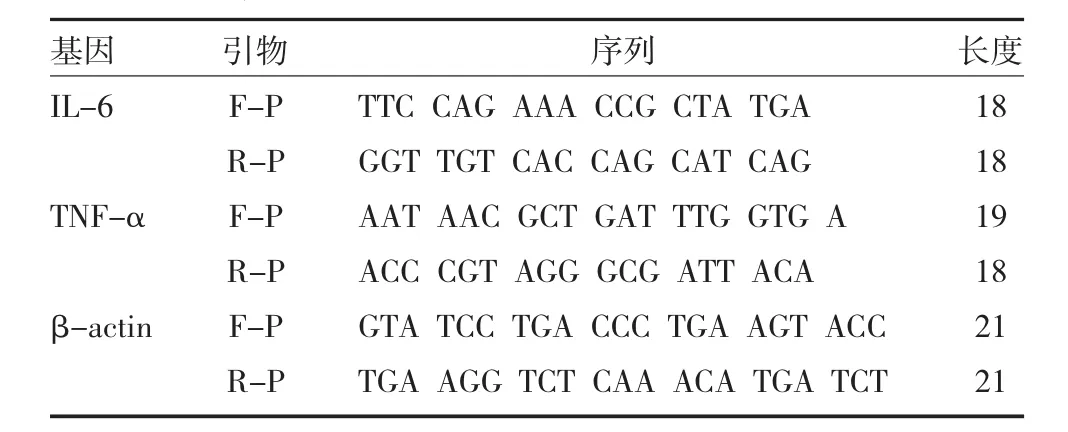
表1 实时定量PCR检测的引物序列
2.7 ELISA检测 RAW264.7细胞培养,依次收取三组细胞上清液,按照ELISA试剂盒说明书操作步骤检测各组小鼠肺泡灌洗液BALF和细胞上清液中TNF-α和IL-6表达水平。
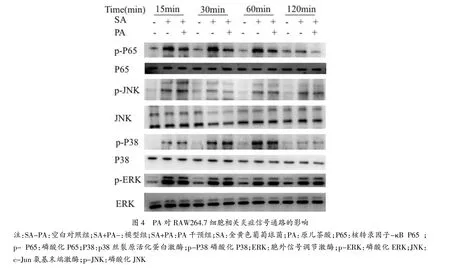
2.8 Western Blot检测 在 SA 刺激 15、30、60和120min四个时间点收集各组RAW264.7细胞至1.5mL EP管中,加入细胞裂解液后在冰上裂解30min 后,4°C 12 000r/min 离心 10min,并依照二联喹啉酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒要求进行蛋白浓度测定。每组蛋白样本加上样缓冲液后100°C水浴5min使蛋白变性,而后进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE)分离蛋白,转膜后,封闭液室温缓慢摇床封闭2h,加入p38MAPK和p-p38MAPK、ERK MAPK和p-ERK MAPK、JNK MAPK 和 p-JNK MAPK、P65和p-P65多克隆抗体4°C孵育过夜。回收一抗,加PBST缓冲液洗膜10min,重复3次,加二抗室温摇床上缓慢孵育1.5h,加PBST缓冲液洗膜10min,重复3次,膜上滴加ECL发光液,待铺满PVDF膜,即可曝光并分析各蛋白表达情况。
2.9 统计学方法 数据分析和作图应用GraphPad软件,数据统计采用独立样本的t检验。所得数据结果用均数±标准差(±s) 表示,P<0.05为差异有统计学意义。
3 结果
3.1 三组小鼠肺组织病理改变 光镜下HE染色结果显示,对照组小鼠肺组织结构正常,肺泡数量丰富,支气管结构完整;模型组小鼠肺泡结构破坏严重,血管和支气管外均可见较多淋巴细胞浸润(封四图1绿色箭头所示);肺泡壁增厚,其中散布有淋巴细胞(封四图1黑色箭头所示);支气管管腔中可见红细胞(封四图1黄色箭头所示);血管管腔内可见淋巴细胞贴壁(封四图1红色箭头所示);PA预处理组小鼠肺组织损伤程度较模型组显著减轻,局灶性炎性细胞浸润,大部分肺泡结构清晰,见封四图1。
3.2 三组小鼠肺泡灌洗液和肺组织TNF-α和IL-6表达水平比较 SA感染小鼠后,小鼠BALF液炎症因子TNF-α和IL-6表达和小鼠肺组织匀浆TNF-α和IL-6 mRNA表达水平显著升高(P均<0.05);PA预处理后,能显著抑制TNF-α和IL-6表达(P均<0.05)。见封四图 2。
3.3 三组上清液和细胞TNF-α和IL-6表达水平比较 SA刺激细胞后,细胞上清液TNF-α和IL-6表达和细胞裂解后TNF-α和IL-6 mRNA表达水平明显升高(P均<0.05);PA预处理后,能显著抑制TNF-α和IL-6表达(P均<0.05),见封四图3。
3.4 PA对RAW264.7细胞相关炎症信号通路的影响 SA刺激能引起P38、ERK、JNK和P65蛋白显著活化,PA预处理明显抑制P65蛋白活化,但对P38、ERK和JNK的活化无抑制作用,显示PA预处理可以抑制SA诱导的P65炎症信号通路激活。见封三图4。
4 讨论
SA是人类最常见的化脓感染性病原体,当SA感染机体后释放一系列毒素和侵袭性酶,会引发局部性化脓感染,也可引起包括心包炎、肺炎、败血症、脓毒症等致死性疾病[10-13]。临床数据[14-15]显示,金葡菌肺炎在全球已经十分普遍,并且伴随着较高的死亡率,这对人类的身心健康造成极大的挑战。SA作为Toll样受体信号通路配基能特异性结合细胞膜上的TLR2受体,诱导细胞内信号级联反应,包括诱导TNF-α和IL-6等炎症因子释放,进一步扩大炎症级联反应,并引起中性粒细胞募集,在急性肺炎中发挥重要的作用[16]。
本实验显示,与对照组小鼠比较,SA可显著提高肺组织炎症因子TNF-α和IL-6表达(P<0.05),促进小鼠肺部病理学损伤,显示SA肺炎模型建立成功。SA感染宿主后,促进机体释放大量炎症因子,诱导机体发生病理学改变[17-18]。PA常见于人类食用植物中,能被人体吸收,研究[19]发现,PA具有良好的抗炎生物学活性。本研究结果显示,SA感染小鼠后,小鼠BALF液炎症因子TNF-α和IL-6表达和小鼠肺匀浆TNF-α和IL-6 mRNA表达水平显著升高(P均<0.05);SA刺激巨噬细胞RAW264.7后,细胞上清液TNF-α和IL-6表达和细胞裂解后的TNF-α和IL-6 mRNA表达水平明显升高(P均<0.05);PA可显著抑制肺组织和巨噬细胞TNF-α和IL-6的表达(P均<0.05),减轻小鼠肺部病理学损伤。实验结果显示PA可能通过抑制炎症因子的释放改善肺组织病理损伤。
MAPK和NF-κB信号通路是近年来研究极为广泛的炎症信号通路,MAPK家族包括P38 MAPK、ERK MAPK和JNK MAPK三个亚家族,已有研究[20-21]报道MAPK在急性炎症应激反应中起到重要作用,是参与应激过程中调控多种基因表达的重要介质。NF-κB参与免疫和炎症反应早期过程炎症因子表达的调控,包括激活多种炎性细胞因子如TNF-α、IL-1β、IL-6 等[22]。
由于 TNF-α、IL-1β、IL-6等炎症因子主要由细菌毒素等物质作用的巨噬细胞、单核细胞等产生[3],加上小鼠体内实验耗时长,影响因素较多,而细胞内的分子信号传导变化较快,故为进一步深入研究PA作用的分子机制,本实验采用体外小鼠腹腔巨噬细胞系RAW264.7细胞培养,PA提前干预的方法进行研究。实验发现,SA刺激巨噬细胞RAW264.7后p-ERK、p-JNK、p-P38和p-P65的表达明显增加,同时发现PA提前干预之后p-ERK、p-JNK和p-P38的表达与模型组一致,而P65磷酸化较模型组明显减轻。提示PA对SA肺炎小鼠的保护机制可能与抑制P65蛋白的过度磷酸化有关,因此我们推测PA抑制炎症而减轻SA肺炎,可能与抑制P65信号通路激活相关,至于PA是通过何种途径抑制P65信号通路激活有待进一步探讨。

