奶牛小肠上皮细胞氧化损伤模型的构建
孔令联,崔艳军,杨金勇,李东平,刘东鑫, 王 羽中*, 茅慧玲*
(1. 浙江农林大学动物科技学院,动物营养研究所,浙江杭州 311300;2. 浙江省畜牧技术推广总站,浙江杭州 310021)
氧化应激是机体内氧化-抗氧化平衡状态的一种失衡,会导致细胞损伤。大多数细胞能够承受一定程度的氧化应激,这是由于其具有足够的抗氧化防御能力和修复系统,能够识别和清除被氧化损伤的分子[1]。当体内高活性分子如活性氧(ROS)产生过多且超出机体的防御能力时,就会导致氧化应激,从而导致诸如脂类、DNA和蛋白质等生物大分子的损伤,并可导致疾病[2]。
小肠上皮细胞是体内更新速度最快的一类细胞,消化食物、吸收营养的同时防止有害物质侵入体内,其结构和功能的完整性对奶牛的健康状况和生产性能有重要影响。引起奶牛氧化应激的因素有很多,包括高强度代谢、环境因素、日粮结构等[3]。肠上皮细胞容易受到氧化应激的影响,在多种生理、病理及饮食不当过程中都可能产生氧化损伤,如炎性肠病、断奶应激、热应激等[4]。目前,在细胞水平上关于奶牛氧化应激的报道主要集中在乳腺,对奶牛肠细胞氧化损伤机制的研究甚少,因此建立奶牛小肠上皮细胞氧化应激模型,对于揭示细胞氧化应激机制、研究开发抗氧化型日粮,提高机体抗氧化能力和肠道营养物质吸收能力具有重要的意义。过氧化氢(H2O2)是一种氧化作用较强的ROS,可诱导细胞产生氧化应激,由于其性质相对稳定且易于获得,被广泛应用于各类细胞氧化应激损伤的研究[5]。本试验利用奶牛小肠上皮细胞系,以H2O2为诱导剂,建立奶牛小肠上皮细胞体外氧化应激模型,为进一步研究奶牛肠道的氧化损伤机制及氧化应激下的营养物质吸收规律提供平台和基础。
1 材料与方法
1.1 主要试剂与仪器 永生化奶牛小肠上皮细胞系(取自空肠段)购自上海赛齐生物工程有限公司;DMEM培养基、胎牛血清购自美国Gibco公司;PBS、0.25%胰蛋白酶-EDTA消化液购自上海生工生物工程有限公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)、氯化硝基四氮唑蓝(NBT)、甲醇、氢氧化钾均购自上海阿拉丁生化科技股份有限公司;3%H2O2、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)试剂盒均购自南京建成生物工程研究所;96孔板和6孔板购自Corning公司。CO2培养箱(THermo)、倒置显微镜(Motic)、酶标仪(THermo)、T6紫外可见光分光光度计(北京普析通用仪器有限责任公司)。
1.2 试剂配制 H2O2贮备液的配制:3% H2O2浓度约为882 mmol/L,分别加入无菌双蒸水稀释至50、100、200、400、800 mmol/L作为贮备液备用。
处理培养液的配制:分别取20 μL不同浓度的H2O2贮备液加入到19.98 mL的DMEM培养基中[6],使处理培养液中H2O2浓度分别为0、50、100、200、400、800 μmol/L。配制好的培养基过滤除菌,H2O2贮备液现用现配。
氯化硝基四氮唑蓝(NBT)反应液的配制:准确称取10 mg NBT,加无菌PBS溶解定容至10 mL,配制成浓度为1 mg/mL的NBT反应液过滤除菌备用。
1.3 试验方法
1.3.1 细胞培养与试验分组 将奶牛小肠上皮细胞按3×105个/mL接种在含10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素、10 mmol/L Hepes缓冲液、2 mmol/LL-谷氨酰胺的DMEM培养基中,放入37 、5% CO2培养箱中温育,每2~3 d传代1次,取对数生长期的第3代贴壁生长的细胞用于试验,对数期为2~4 d。试验一:采用单因子完全随机试验设计,将细胞随机分为6组,每组6个重复,试验重复3次。试验组培养液中分别添加0、50、100、200、400、800 μmol/L 的 H2O2(0 μmol/L 为 对照组),分别作用细胞2、4、6 h,测定细胞存活率,初步筛选适宜的H2O2作用时间。试验二:在筛选出适宜H2O2作用时间(2 h)的基础上,采用单因子完全随机试验设计,用不同浓度(0、50、100、200、400、800 μmol/L)的H2O2分别作用细胞2 h,收集细胞和培养液,测定抗氧化指标,进一步筛选出建立奶牛小肠上皮细胞氧化损伤模型的适宜H2O2浓度。
1.3.2 细胞存活率检测 采用MTT比色法检测细胞存活率[7],取对数生长期奶牛肠小上皮细胞以5×104个/mL细胞密度接种于96孔板上,共设6组,每组6个重复孔,试验重复3次,置于37 、5% CO2培养箱中培养24 h后,去除培养液,每孔分别加入100 μL的0、50、100、200、400、800 μmol/L H2O2浓度的处理培养液,分别处理细胞2、4 、6 h,去除处理培养液,换新鲜培养液,同时每孔加入20 μL 5 g/L的MTT,于37 、5%CO2培养箱中孵育4 h,去除培养液及MTT,每孔加入150 μL 二甲基亚砜(DMSO),震荡5 min,用酶标仪测定各孔在波长490 nm处的吸光度。根据下列公式计算存活率。
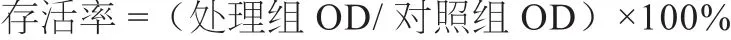
1.3.3 ROS检测 采用NBT还原法检测ROS[8]。NBT法通常作为超氧化物的检测方法,可生成难溶的蓝色结晶甲瓒,同样也可用于ROS检测[9]。将对数生长期的奶牛小肠上皮细胞以5×104个/mL细胞密度制成细胞悬液,每孔100 μL接种于96孔板上,加入H2O2处理2 h,去除含H2O2的培养液,PBS洗3遍,加入NBT反应液,每孔100 μL,37 、5% CO2孵育2 h,去除NBT反应液,每孔加入200 μL甲醇,5 min后用70%甲醇洗2次,去除液体、吹干,每孔加入120 μL 2 mol/L的氢氧化钾(KOH)和140 μL DMSO。待结晶物充分溶解后,用酶标仪测定各孔在波长620 nm处的吸光度值。
1.3.4 LDH、SOD、GSH-Px测定 将奶牛小肠上皮细胞以2×105个/mL的密度接种于6孔板,试验重复3次,倒置显微镜下观察细胞长至70%~80%,换含H2O2的处理培养液,H2O2处理2 h后,收集细胞培养液于2 mL Eppendof管中,12 000 r/min离心10 min,取上清用于LDH活性测定。取细胞,无菌PBS洗2遍,加入0.25%胰蛋白酶-EDTA消化,收集细胞悬液于10 mL离心管,1 000 r/min离心5 min,弃上清,加入无菌PBS洗1次再离心5 min,弃上清后加入1 mL PBS制成细胞悬液,细胞破碎仪破碎(冰水浴,功率200 W,超声3 s,间隔4 s,超声5 min),参照南京建成生物工程研究所提供的试剂盒说明书,测定细胞内SOD和GSH-Px活性。LDH活性采用微板法测定,单位定义为1 000 mL细胞培养液37 与基质作用15 min,在反应体系中产生1 μmol丙酮酸为1单位;SOD活性采用黄嘌呤氧化酶法测定,单位定义为每毫升反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U);GSH-Px活性采用比色法测定,单位定义为每0.1 mL反应液在37 反应5 min,扣除非酶促反应作用,使反应体系中GSH浓度降低1 μmol/L为一个酶活力单位。
1.4 统计分析 试验采用SPSS 22.0统计软件,选择单因素ANOVA程序对数据进行方差分析,两两比较采用LSD法。结果表示为平均值±标准差 。P<0.05为差异有统计学意义。
2 结 果
2.1 H2O2对奶牛小肠上皮细胞存活率的影响 由表1可见,随着H2O2浓度增加,H2O2处理组细胞存活率较对照组显著降低(P<0.05)。50 μmol/L组存活率均在80%以上,细胞损伤较小;100 μmol/L组处理细胞6 h后,细胞存活率 降低至55%,2 h和4 h组存活率均大于70%;200 μmol/L组处理细胞2 h后,细胞存活率相对于对照组显著降低至64.03%(P<0.05),符合建立氧化应激模型的条件;400、800 μmol/L组存活率进一步降至30%左右,细胞存活率较低。
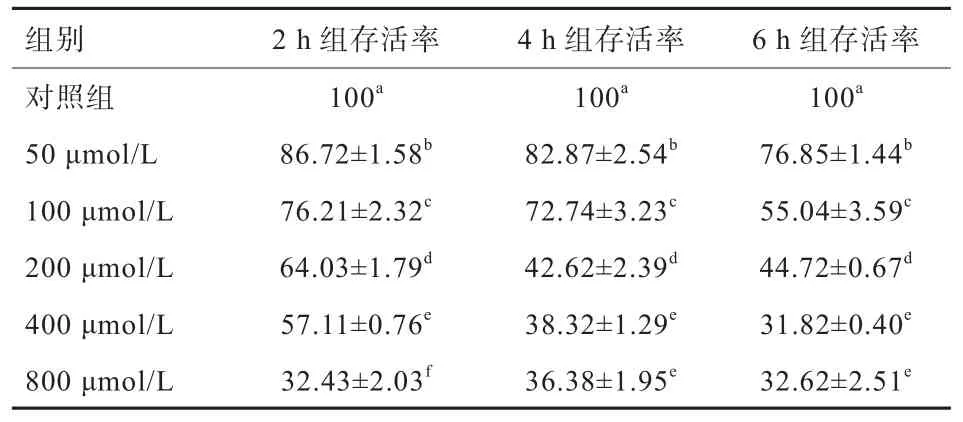
表1 H2O2对奶牛小肠上皮细胞存活率的影响(n=6) %
2.2 H2O2作用2 h对奶牛小肠上皮细胞形态的影响由图1可见,不同浓度H2O2处理奶牛小肠上皮细胞2 h后,对照组细胞贴壁良好,形态正常且分布均匀;50、100 μmol/L组细胞形态无明显变化,细胞间隙变大,少量细胞变圆脱落;200 μmol/L组细胞体积缩小,细胞间隙增大并出现小部分脱落,少量细胞变圆死亡;400、800 μmol/L组细胞形态显著改变,细胞变圆变亮,死亡数量较多;800 μmol/L组大量细胞脱落,细胞核突出,产生了DNA损伤。
2.3 细胞内ROS和培养液中LDH含量 由表2可见,随着H2O2浓度的增加,100~800 μmol/L组细胞内ROS含量相对于对照组和50 μmol/L组显著上升(P<0.05)。细胞培养液中LDH含量随着H2O2浓度的增加逐渐升高,当浓度达到200 μmol/L时,LDH的含量显著高于对照组(P<0.05)。

图1 H2O2作用2 h对奶牛小肠上皮细胞形态的影响(×100 )
2.4 H2O2作用2 h对奶牛小肠上皮细胞ROS、LDH、SOD、GSH-Px活性的影响 由表2可见,50 μmol/L组细胞内T-SOD活性较对照组无显著变化(P>0.05),100 μmol/L组T-SOD活性上升(P>0.05);相对于对照组,200、400、800 μmol/L组T-SOD活性显著降低(P<0.05)。随着H2O2浓度增加,细胞内GSH-Px活性呈降低趋势,当H2O2浓度达到200 μmol/L时,与对照组相比细胞内GSH-Px活性显著降低(P<0.05)。
3 讨 论
氧化应激是ROS在体内产生的一种负面作用,机体在受到外界刺激及生理代谢过程中会产生很多具有潜在毒性的自由基[10],这些物质具有高度的活性,可以修改蛋白质、脂类和核酸(DNA和RNA)等多种生物大分子,导致细胞氧化应激,引发功能障碍,导致细胞死亡。高产奶牛代谢旺盛,肠道作为消化和吸收的主要部位容易发生氧化应激并产生损伤。H2O2可穿过细胞膜与细胞内Fe2+反应生成高活性的自由基,且由于H2O2性质相对稳定且易于获得,已经成为研究细胞氧化损伤的重要工具[11]。不同细胞建立氧化应激模型的条件存在显著差异,这可能与细胞本身的耐受性有关,但选用的存活率大都在50%~70%。细胞存活率过高说明细胞氧化应激不明显;细胞存活率过低说明细胞产生了不可逆损伤,细胞大量死亡。ROS包括超氧阴离子(O2-)、羟自由基(•OH)和H2O2等,对细胞有很强的破坏性,即使ROS是正常呼吸过程中产生的,也会造成累积的损伤,最终导致细胞和组织功能丧失。本试验选用200 μmol/L的H2O2作用奶牛小肠上皮细胞2 h,细胞存活率显著降低至64.03%且ROS产量相对于对照组显著上升,说明细胞产生了一定程度的氧化损伤,同时又保持了较理想的存活率,符合建立模型的条件。

表2 H2O2作用2 h对奶牛小肠上皮细胞ROS、LDH、SOD、GSH-Px活性的影响(n=3)
LDH存在于机体所有组织细胞的胞质内,细胞发生氧化损伤时,细胞膜受损,胞质内的LDH外泄出来。LDH在细胞培养液中的含量变化反映了细胞膜的损伤程度。本试验结果表明,随着H2O2浓度提高,培养液中LDH含量显著上升,说明细胞产生了不同程度的氧化损伤。正常状态下,机体氧化与抗氧化系统处于平衡状态,代谢过程中产生的ROS能被体内的抗氧化酶及时清除,如SOD和GSH-Px。超氧化物主要通过SOD来调节[12],作为氧化磷酸化的副产物,线粒体会产生大量O2-,SOD使其转化为H2O2,再由GSH-Px将H2O2分解为H2O。SOD和GSH-Px活性是机体抗过氧化能力的重要指标。本试验中细胞内总SOD活性随着H2O2浓度的提高呈先略升高再显著降低的趋势,这可能是细胞内氧化-抗氧化系统调控的结果,H2O2浓度为50、100 μmol/L时,细胞氧化损伤较轻,抗氧化系统通过提高SOD活性来缓解氧化应激损伤;H2O2浓度为200 μmol/L时,SOD活性较对照组显著降低,细胞发生了一定程度的氧化应激。GSH-Px是抗氧化防御系统的重要组成部分[13],是机体内广泛存在的一种重要的过氧化物分解酶,其活性中心为硒半胱氨酸。硒是GSH-Px酶系的组成成分,它能催化GSH变为GSSG,使有毒的过氧化物还原成无毒的羟基化合物,同时促进H2O2分解,从而保护细胞膜的结构及功能不受损害。本试验中,H2O2作用细胞2 h后GSH-Px活性逐渐降低,当H2O2浓度达到200 μmol/L时,GSH-Px活性相对于对照组显著降低,导致细胞抗氧化防御能力下降,干扰了氧化和抗氧化系统之间的平衡,产生氧化损伤。
4 结 论
本试验中,200 μmol/L H2O2作用奶牛小肠上皮细胞2 h,可成功构建以H2O2为诱导剂的奶牛小肠上皮细胞氧化损伤模型,为今后研究氧化应激下奶牛肠道养分消化吸收提供平台和基础。

