不同厂家猪冷冻精液应用效果的比较
周开锋,董胜华,张井清,杨景晁,王燕男,张思聪,唐 辉
(1.山东省畜牧总站,山东济南 250022;2.山东华盛江泉农牧产业发展有限公司,山东临沂 276000;3.山东农业大学动物科技学院,山东泰安 271018)
猪冷冻精液技术是指利用干冰(-79 )、液氮雾等作冷却源,将精液特殊处理后,在超低温液氮(-196 )状态下长期保存,解冻后输精的过程[1]。精液冷冻保存是人工授精的一项重大变革,Polge等[2]首次进行了猪的冻精试验并成功获得后代。自此以后,世界各国对猪冻精技术开展了大量研究,但早期应用效果并不理想,使用猪冷冻精液配种后分娩率仅为40%~70%,窝产仔猪数仅为7~10头[1,3-4]。近年来,猪冷冻精液技术进展迅速,国内外业界都有商业化推广的猪冷冻精液,其受胎率和分娩率稍低于鲜精配种[5-6]。
本研究选择商业化推广使用较多的国内和国外2家猪冷冻精液,通过分析其解冻和配种产仔效果,旨在验证国内猪冷冻精液的技术水平,为我国本土猪冷冻精液基因库的建设和精液推广提供科学依据。
1 材料与方法
1.1 实验时间及地点 实验于2017年3—8月在山东华盛江泉农牧产业发展有限公司原种猪场进行,试验期5个月。
1.2 实验材料
1.2.1 冻精与实验动物 选购北京某公司猪冷冻精液145头份(BJ组),每头份4支冻精细管;某国外公司猪冷冻精液145头份(GW组),每头份8支冻精细管。实验动物选择临沂华盛江泉农牧产业发展有限公司经产大白和长白母猪各70头。
1.2.2 实验仪器 实验仪器包括scA780-54fc全自动精子质量分析系统(法国卡苏公司)、恒温水浴锅(HH-8型,金坛市杰瑞尔电器有限公司)、磁力搅拌器(85-2型,常州翔天实验仪器厂)、MⅠNⅠTUB长效稀释粉(德国米尼图公司)、BJ专用稀释液(北京百均达科技公司)、解冻杯、剪刀、长针器械、一次性注射器、液氮罐、一次性深部输精管等。
1.3 实验方法
1.3.1 实验分组 从国内(BJ组)和国外(GW组)2家公司的冻精中分别随机选取5支大白猪冷冻精液,解冻后测定精子活率;从本场每日发情母猪中选择3~5胎正常断奶、体况基本一致的健康大白母猪和长白母猪,每个品种的70头母猪随机分给2种来源冻精组人工授精,统计繁殖性能指标。
1.3.2 解冻流程 按2家公司提供的解冻说明书进行冻精的解冻。BJ组冻精细管每次取出1支后,迅速置于50 解冻杯中,用手轻轻搅动细管,保证受热均匀,解冻16 s后迅速取出,将管外水分擦拭干净,用剪刀减去细管1头,用长针器械从冻精管另一端将精液挤出到放置在37 恒温水浴锅中的输精瓶中。待4支冻精细管的精液全部挤入输精瓶后,再往输精瓶中缓慢加入37 恒温BJ专用稀释液至40 mL,轻轻摇晃,解冻完成,获得1头份40 mL精子总数8亿(2亿个/支冻精细管×4支= 8亿)的输精用精液。
GW组冻精细管每次取出1支后,迅速置于38解冻杯中,用手轻轻搅动细管,保证受热均匀,解冻20 s后迅速取出,将管外水分擦拭干净,用剪刀减去细管一头,用长针器械从冻精管另一端将精液挤出到放置在26 恒温水浴锅中的输精瓶中。待8支细管的解冻精液全部挤入输精瓶后,再往输精瓶中缓慢加入26恒温MⅠNⅠTUB稀释液至60 mL,轻轻摇晃,解冻完成,获得1头份60 mL精子总数40亿(5亿个/支冻精细管×8支= 40亿)输精用精液。
1.3.3 精子活率测定 用洁净玻璃棒蘸取1滴精液置于载玻片上,然后轻轻放上盖玻片(不要有气泡,盖玻片不游动),通过scA780-54fc全自动精子质量分析系统测定冻精解冻后0 min、5 min、15 min、1 d、2 d、3 d的精子活率。
1.3.4 母猪的人工授精 采用子宫深部输精技术进行输精,当输精器外管海绵头到达子宫颈并锁紧后,再将内管延长10~15 cm,以通过子宫颈到达子宫体内或子宫颈前端接近子宫体的部位进行输精[3]。所有冻精配种均由同一名配种员操作,要求冻精稀释后15 min内完成首次输精,间隔8 h进行第2次输精。配种后18 d开始进行返情检查,28 d利用B超妊娠检查。返情和妊娠检查阴性的猪为未孕,妊娠检查为阳性的猪为受孕。妊娠鉴定后统计配种情期受胎率,母猪分娩后记录产仔母猪数、每窝总产仔数、健仔数、死胎数、木乃伊数等繁殖性能指标。
1.4 统计分析 数据用SAS9.2软件包进行统计分析,精子活率以冻精类型为固定效应进行单因素方差分析;窝产仔数、健仔数以精子来源、品种为固定效应进行两因素的方差分析,结果以平均值±标准误表示,组间均数用Duncan´s方法进行多重比较,P<0.05表示差异显著;情期受胎率和配种分娩率指标的显著性检验方法采用百分数资料的t检验。
2 结果与分析
2.1 不同来源冻精精子活率 根据猪场生产标准要求,经过SCA精子全自动分析系统检测,配种精液精子活率不得低于48%。从表1可见,2组冻精除了解冻后15 min精子活率无显著差别外,其他时间点均表现为BJ组精子活率显著或极显著高于GW组(P<0.05或P<0.01)。BJ组冻精在保存2 d时的精子活率仍能达到配种使用标准,而GW组冻精在保存1 d后就已低于使用标准,不能用于配种。
2.2 不同来源冻精的配种效果 从表2可见,BJ组情期受胎率比GW组冻精高出8.56个百分点(P<0.05),其中BJ组大白猪和长白猪的情期受胎率分别较GW组高出5.71和11.42个百分点(P<0.05);BJ组配种分娩率比GW组冻精高9.99个百分点(P<0.05),其中BJ组大白猪和长白猪的配种分娩率分别高出GW组8.57和11.42个百分点(P<0.05)。后续实验可通过加大实验样本含量对结果进行进一步验证。
2.3 不同来源冻精的产仔性能 从表3可见,剔除品种影响,BJ组繁育的窝均总产仔数比GW组高1.48头,窝均健仔数平均高出1.61头,提高幅度分别达15%和18%(P<0.05);其中,BJ组大白猪繁育的窝均总产仔数和窝均健仔数比GW组分别高出1.25头和1.59头(P<0.05);BJ组长白猪繁育的窝均总产仔数和窝均健仔数比GW组分别高出1.70头和1.65头(P<0.05)。BJ组窝均总产仔数的稳定性优于GW组(BJ组的变异系数小)。
3 讨 论
本实验中,除了解冻后15 min 2组精子活率无显著差别外,其他时间点均表现为BJ组精子活率均显著或极显著高于GW组。BJ组冻精解冻保存2 d时的精子活率仍符合配种使用标准,而GW组冻精在保存1 d后精子活率低于使用标准,不能用于配种。这可能与各自使用的稀释液有关,也可能与2种来源冻精的精子密度不同有关(BJ组冻精解冻稀释后的精子总数仅为GW组的1/5)。
本实验中,BJ组和GW组冷冻精液情期受胎率分别达87.14%、78.57%,窝均总产仔数分别为11.30、9.82头,窝均健仔数分别为10.70、9.09头,此3项指标均达到或接近常温精液的繁育标准,与李兆华[4]、刘莹[7]报道结果近似,明显高于陈映等[8]的报道。冻精良好的繁育效果与近年来国内外猪冷冻精液制作工艺、解冻流程、稀释液的改进等技术的成熟有关。本实验条件下,BJ组在情期受胎率上有高于GW组的趋势,在产仔性能上显著优于GW组,说明国内冻精技术近年来取得较大进步。

表1 不同来源冻精解冻后精子活率 %
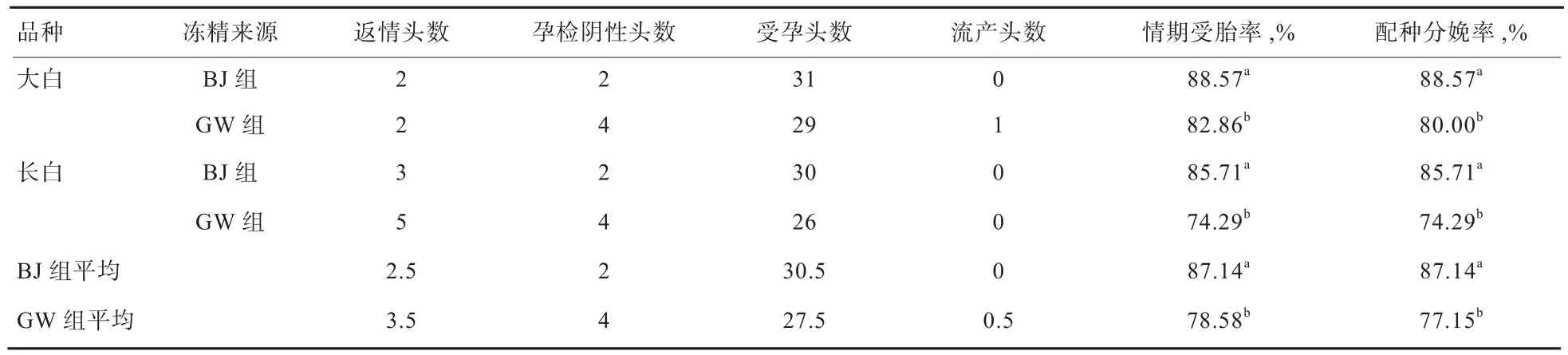
表2 不同来源冻精的后配种效果
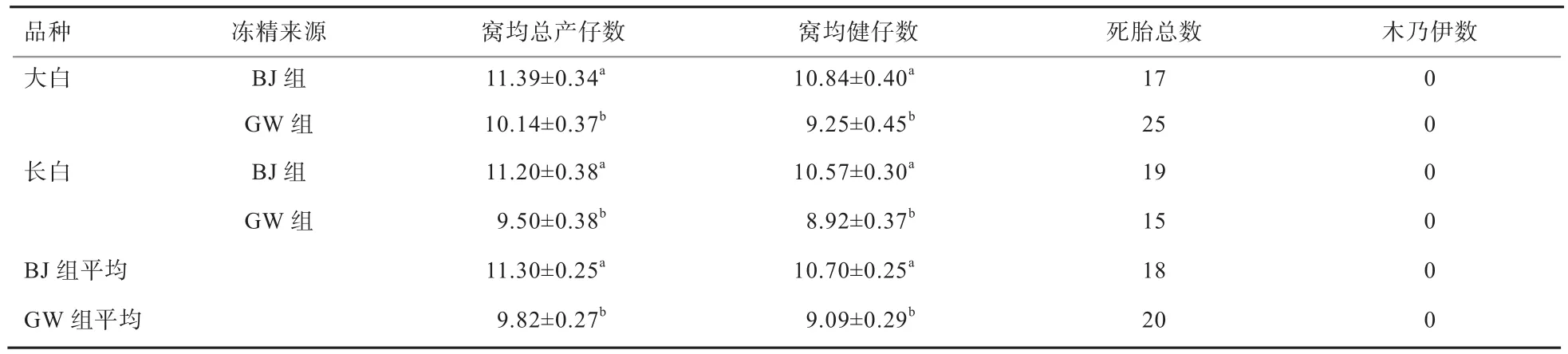
表3 不同来源冻精的产仔性能
现有产品标准下,BJ组猪冷冻精液一次输精剂量、输精总精子数仅为GW组的67%和20%,相比之下BJ组冻精在利用效率上更有优势,但其相同输精量和精子数的配种效果有待进一步验证。实验结果除了主要受冻精质量(冷冻保存技术)影响外,还会受到公猪品种、配种时机、配种方法、输精操作人员、饲养管理等因素的影响[9-11]。本实验对上述干扰因素进行了控制,以提高实验结果的可靠性。
4 结 论
本实验条件下,BJ组猪冷冻精液在冻精解冻后的精子活率和窝均总产仔数、窝均健仔数等指标上均优于GW组,利用冷冻精液技术达到或接近了大群生产常温精液配种繁育效果,表明国内猪冻精技术进步显著、优势明显,能为我国利用此技术体系建立本土种猪冷冻精液基因库,以及猪冷冻精液的推广应用提供技术支持。

