液相色谱-串联质谱法测定配合饲料中16种头孢菌素类药物
张 艳,吴银良
(宁波市农业科学研究院,浙江 宁波 315040)
头孢菌素类药物(Cephalosporins,CEPs)又名先锋霉素类药物,属β-内酰胺抗生素,兽医临床应用广泛。CEPs品种多,现已发展到第五代。头孢菌素类药物虽较青霉素类药物过敏反应低,但过量使用会导致人体内白血球降低,影响内脏功能,发生脏器损伤等,对老人、儿童,特别是胎儿的影响较大[1-2]。为保障公众健康安全,我国已对头孢氨苄、头孢喹肟和头孢噻呋3种头孢菌素类药物制定了动物性食品中最高残留限量(Maximum residue limit,MRL)(20~200 μg/kg)[3];但对于常用的头孢拉定、头孢噻肟等药物,目前尚未制定其MRL,因此在畜禽生产中存在滥用头孢菌素类药物的现象。考虑到抗生素的耐药性问题,部分国家目前已禁止在家畜饲料中使用头孢菌素类药物[4]。因此,为保障人类用药和我国动物性食品安全,建立简单、快速的测定饲料中头孢菌素类药物的液相色谱-串联质谱(LC-MS/MS)方法具有重要意义。
目前头孢菌素类药物的检测方法常使用微生物法[5]、液相色谱法[6-7]、液相色谱-串联质谱法[8-16]和毛细管电泳法[17],且主要集中于牛奶[10-11,15]和肉[9,14,17]类样品,少数方法涉及鸡蛋[16]和饲料样品[12-13]。国内尚无有关饲料中头孢菌素类药物分析方法的研究。固相萃取小柱净化是最常用的前处理手段[8,10,15],考虑到头孢菌素类药物在中性和酸性条件下固相萃取保留较差,通常在上柱前将溶液调至pH 8.5左右[15],从而导致已有方法工序复杂、操作繁琐、成本较高,难以满足批量样品同时分析的需要。本研究比较了提取液直接稀释与固相萃取净化方法的性能参数,建立了提取后直接稀释进样分析配合饲料中头孢菌素类药物的LC-MS/MS方法。该方法具有简单、快速、准确、灵敏的优点,为饲料中头孢菌素类药物的风险监测提供了技术支持。
1 实验部分
1.1 仪器与试剂
Waters UPLC XevoTMTQ-S micro超高效液相色谱-串联质谱仪(美国Waters公司),配置电喷雾离子源; IKA Vortex Genie 3漩涡振荡器(德国IKA公司),低温高速离心机(德国Sigma公司)。
头孢菌素类药物标准品:头孢氨苄、头孢拉定、头孢唑林、头孢哌酮、头孢喹肟、头孢噻肟、头孢噻呋、头孢羟氨苄、头孢呋辛(德国 Dr.Ehrenstorfer GmbH),头孢乙腈、头孢匹林(德国WITEGA laboratorien Berlin-Adlershof GmbH),头孢洛宁、头孢噻吩、头孢他定(加拿大Toronto Research Chemicals公司),头孢克洛、头孢丙烯(中国食品药品检定研究院),所有标准品的纯度均大于92%。甲醇、乙腈(色谱纯,德国Merck公司),甲酸(色谱纯,美国Tedia公司),HLB小柱(500 mg/6 mL,美国Waters公司);实验用水为 Milli-Q 超纯水。
1.2 色谱-质谱条件
色谱柱:Acquity BEH C18(100 mm×2.1 mm,1.7 μm);流动相:A为0.1%甲酸溶液,B为甲醇;梯度洗脱条件:0~1.0 min,5%B;1.0~4.5 min,5%~50%B;4.5~7.5 min,50%~70%B;7.5~7.6 min,70%~5%B,7.6~9.0,5%B;流速0.30 mL/min;进样量10 μL。
ESI源正离子模式电离;多反应监测(MRM);毛细管电压:2.5 kV;萃取锥孔电压:25 V;RF透镜电压:0.5 V;离子源温度:150 ℃;脱溶剂气温度:500 ℃;锥孔气流速:30 L/h;脱溶剂气流速:1 000 L/h;其它条件见表1。
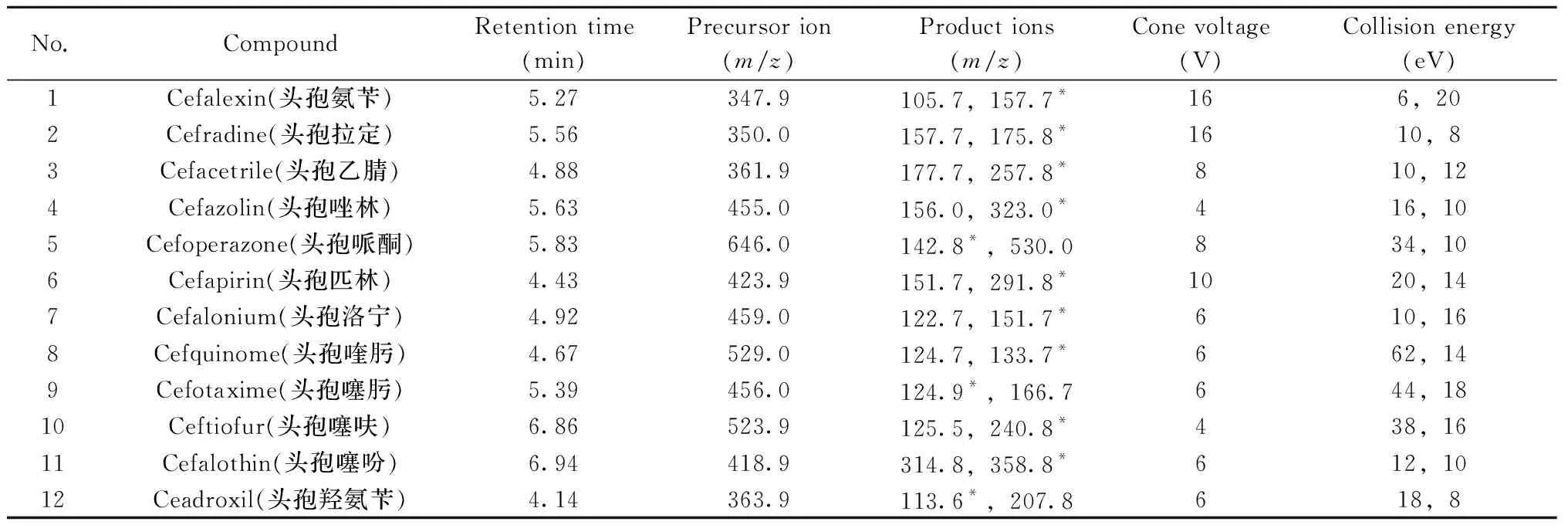
表1 16种头孢菌素类药物的保留时间、母离子、子离子、锥孔电压及碰撞能量Table 1 Retention times,precursor ions,product ions,cone voltages and collision energies of 16 cephalosporins
(续表1)

No.CompoundRetention time(min)Precursor ion(m/z)Product ions(m/z)Cone voltage(V)Collision energy(eV)13Cefuroxime(头孢呋辛)5.57447.0341.9*,385.91612,1014Ceftazidime(头孢他定)4.48547.0166.7,467.9*426,1015Cefaclor(头孢克洛)5.15367.9105.7*,173.8618,1416Cefprozil(头孢丙烯)4.95390.0113.6*,207.8618,8
*quantitation ion
1.3 样品前处理
取试样5 g(精确至0.01 g),置于50 mL聚丙烯离心管中,加入乙腈-水(40∶60)溶液25 mL,以300 r/min振荡提取30 min,再以5 000 r/min离心5 min后,用乙腈-水(40∶60)溶液25 mL重复提取1次,合并上清液至50 mL容量瓶中,用乙腈-水(40∶60,体积比)溶液定容。吸取0.4 mL上清液,加0.1%甲酸溶液0.6 mL,混合均匀,过0.22 μm滤膜后,待测定。
1.4 加标回收实验
对阴性猪配合饲料进行加标回收实验,样品处理同“1.3”,头孢唑林、头孢哌酮、头孢乙腈、头孢喹肟、头孢噻吩、头孢呋辛和头孢他定7种药物的加标水平为50、500、2 500 μg/kg,其余头孢菌素类药物的加标水平为10、50、500、2 500 μg/kg。称样后加入标准溶液,涡旋混匀放置0.5 h后进行样品处理。
2 结果与讨论
2.1 仪器条件的优化
已建立的头孢菌素类药物的LC-MS/MS分析方法通常采用正离子模式进行电离[8-16]。本实验用水-甲醇(95∶5,体积比)溶液分别配制1.0 mg/L的16种头孢菌素类药物溶液,利用仪器自带Intellistart软件优化质谱条件并获得定性、定量离子对,结果发现16种头孢菌素类药物在正离了模式下均能获得较好的响应,其中头孢唑林、头孢乙腈、头孢噻吩和头孢呋辛的母离子均为[M+Na]+,其余头孢菌素类药物的母离子为[M+H]+;同时发现头孢噻吩和头孢呋辛在负离子模式下也有较好的响应,但与正离子模式下的分析灵敏度差异不显著,因此本研究采用表1中的质谱条件进行实验。
文献表明,当采用Waters超高效液相色谱仪分析头孢菌素类药物时,Waters Acquity UPLC BEH C18、Waters Acquity Xselect CSH C18等色谱柱均能取得较好的保留和分离效果[7],因此本实验采用Waters Acquity UPLC BEH C18柱考察了甲酸溶液-甲醇和甲酸溶液-乙腈2种流动相体系的响应情况,发现当采用0.1%甲酸-乙腈为流动相进行梯度洗脱时,头孢乙腈、头孢唑林等药物的响应较差,而采用0.1%甲酸-甲醇体系进行梯度洗脱时16种头孢菌素类药物的响应均较好,因此确定0.1%甲酸-甲醇体系为流动相,梯度洗脱条件见“1.2”。
2.2 前处理条件的优化
生物样品中头孢菌素类药物的常用提取剂有甲醇[13]、甲醇-水[12]和乙腈-水[8-9,16]等。因饲料样品中通常富含蛋白质和脂类物质,用甲醇或甲醇-水提取时样液较混浊,需进一步净化去除蛋白。而用乙腈提取时,因蛋白变性沉淀,提取后杂质少,且提取液澄清,因此本研究使用乙腈、乙腈-水(50∶50,体积比)、乙腈-水(40∶60,体积比)和乙腈-水(25∶75,体积比)4种提取液对猪配合饲料在500 μg/kg加标水平下进行提取,结果发现用乙腈提取时所有药物的回收率均在10%以下,采用乙腈-水(50∶50)和乙腈-水(25∶75)提取时,不能使所有头孢菌素类药物的提取回收率达到90%以上;而采用乙腈-水(40∶60)时,所有头孢菌素类药物的回收率均大于90%,因此确定以乙腈-水(40∶60)进行提取。目前用于动物性食品提取的乙腈溶液中乙腈含量均高于60%[7-8,15],而本实验中乙腈的比例仅为40%,可能是饲料样品比动物性食品的含水量低所致。
500 μg/kg的猪配合饲料加标样品经乙腈-水(40∶60)提取后,比较了直接稀释法与固相萃取法的加标回收率、方法灵敏度、基质效应和用时,其中固相萃取法参考GB/T 22942-2008[18],即5 mL提取液用25 mL磷酸二氢钠缓冲溶液稀释后,调至pH 8.5过柱,用乙腈洗脱吹干后以15%乙腈溶解(溶解液体积分别为1.0、12.5 mL)。结果发现,直接稀释法的回收率(88.7%~93.6%)明显高于固相萃取法(75.2%~82.1%);当固相萃取法采用1.0 mL的15%乙腈溶解时,基质效应明显大于直接稀释法(图1),而采用12.5 mL 15%乙腈溶解时,基质效应比直接稀释法略有改善,斜率比值(基质标准曲线斜率和溶剂标准曲线斜率的比值)在0.8~1.2范围外的药物由4种减至1种(图1);直接稀释法的灵敏度(检出限为1.5~15 μg/kg)比固相萃取法采用1.0 mL 15%乙腈溶液溶解时(检出限为0.12~1.5 μg/kg)的灵敏度低;时间方面,直接稀释法完成6个样品的稀释仅需3 min,而固相萃取法则需约2.5 h。动物性食品中MRL限量为20~200 μg/kg,头孢菌素类药物在饲料中使用浓度通常较高[3]。综合考虑用时、基质效应和回收率,本实验最终采用直接稀释法。
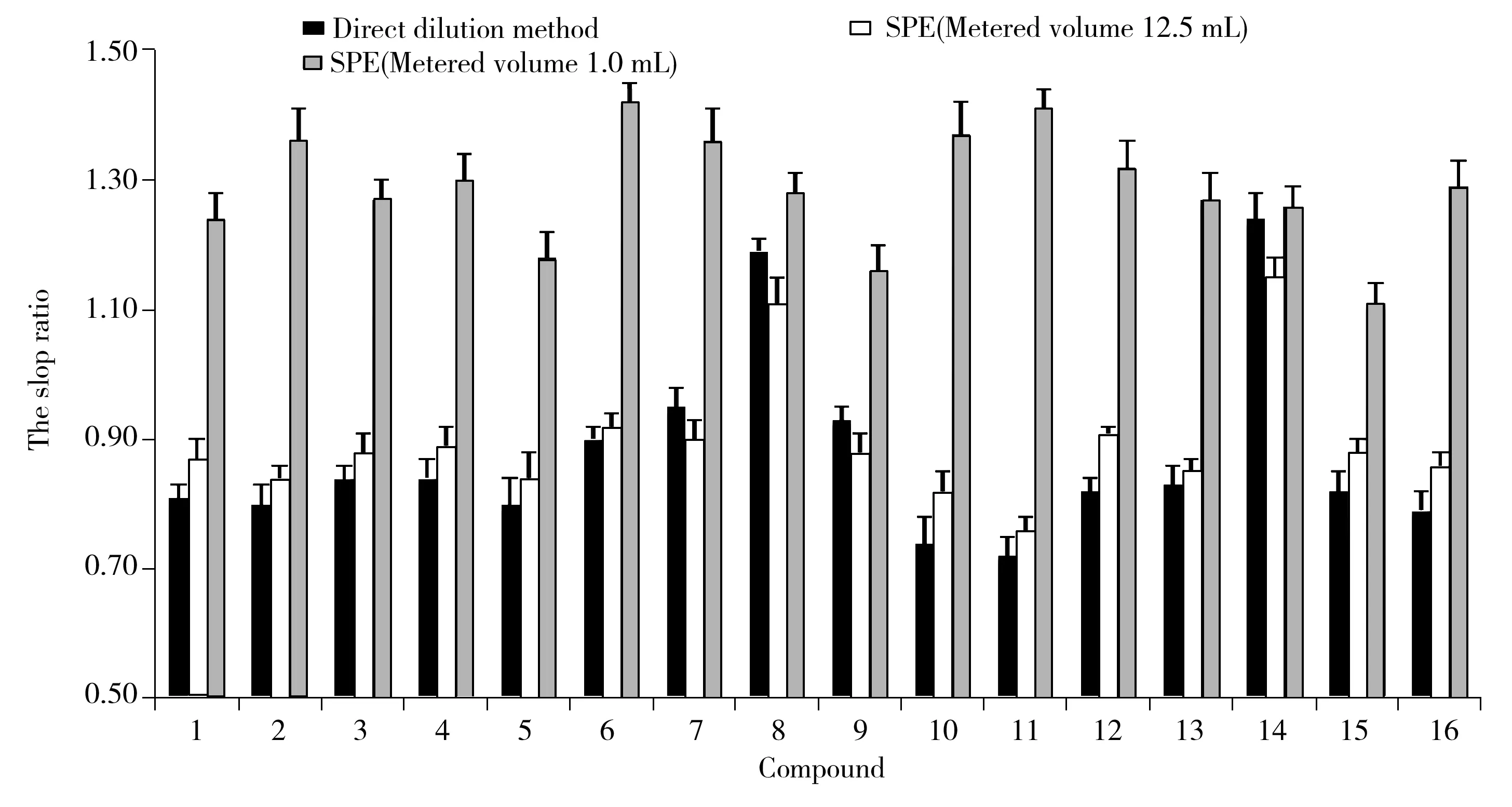
图1 不同净化方式下的基质效应Fig.1 Matrix effects of different purification methods the order number of the cephalosporins is the same as that in Table 1
2.3 线性实验
在优化条件下,利用稀释后的猪配合饲料空白样品提取液配制0.1、0.5、5、20、50、200、500 μg/L的系列基质标准工作溶液(其中头孢唑林、头孢哌酮、头孢乙腈、头孢喹肟、头孢噻吩、头孢呋辛和头孢他定为0.5、5、20、50、200、500 μg/L)进行LC-MS/MS分析,以峰面积(Y)对相应质量浓度(X,μg/L)作标准曲线,得到回归方程和相关系数(r2)。16种头孢菌素类药物在上述质量浓度范围内线性关系良好,r2均大于0.999。
2.4 方法的专属性
按照“1.4”方法同时进行空白猪配合饲料样品、加标样品和干扰样品(空白样品中添加β-内酰胺类药物青霉素G、青霉素V、氯唑西林、苯唑西林、氨苄西林、阿莫西林、双氯西林)实验,结果发现空白样品和干扰样品未出现干扰峰,表明方法的专属性较好。
2.5 回收率、精密度与检出限
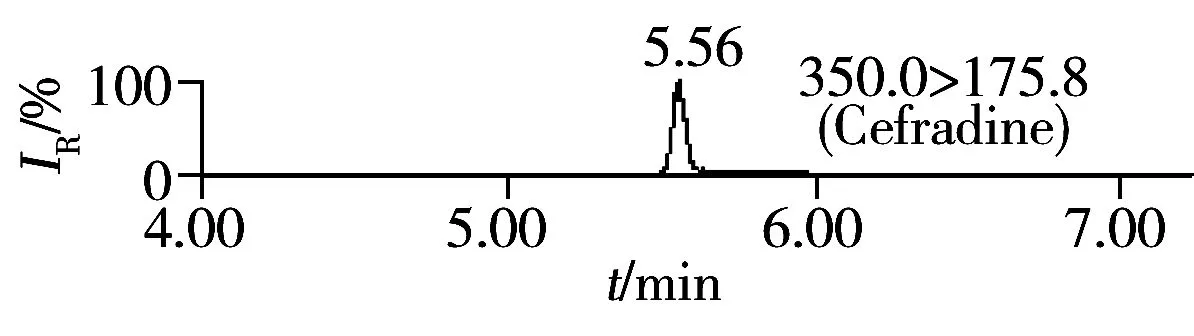
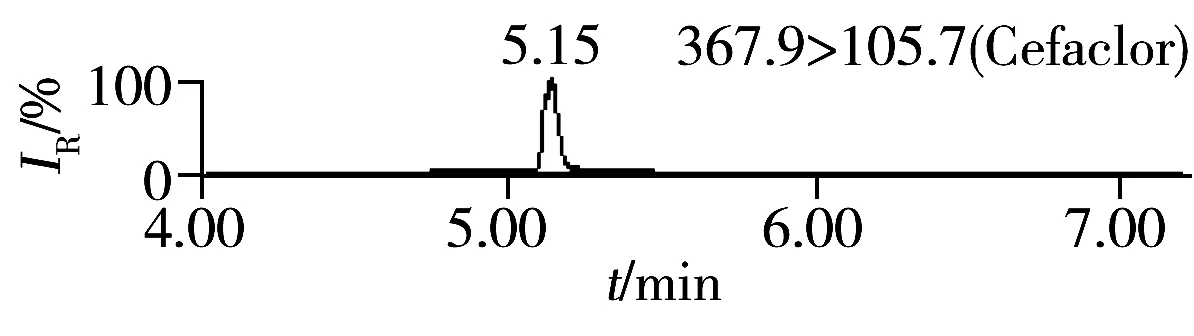
按照“1.4”方法进行加标回收实验,每批次同一浓度5个平行样品,重复3次,其中第1批的结果见表2,加标样品的MRM色谱图见图2。由表2可知,16种头孢菌素类药物的加标回收率为88.4%~93.6%,相对标准偏差(RSD)为0.8%~4.7%,满足饲料中头孢菌素类药物含量的测定要求。按3倍信噪比(S/N=3)计算该方法对16种头孢菌素类药物的检出限(LOD)为1.5~15 μg/kg;按S/N=10计算得定量下限(LOQ)为5.0~50 μg/kg。我国农业部235号公告规定头孢氨苄、头孢喹肟和头孢噻呋在动物性食品中的MRL为20~200 μg/kg[3],而本研究的分析对象为饲料,其分析要求通常低于动物性食品,且本方法检出限可达1.5~15 μg/kg,因此能满足饲料中该类药物含量的分析需要。

表2 猪配合饲料中16种头孢菌素类药物的回收率与相对标准偏差
*no recovery experiments have been carried out


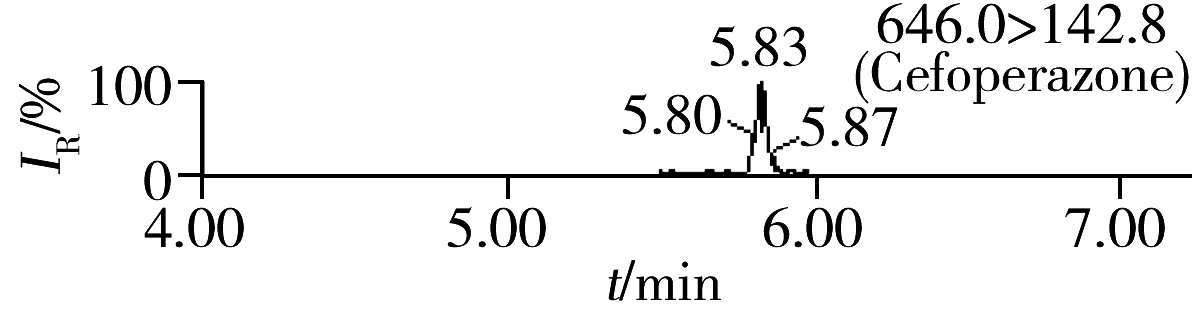
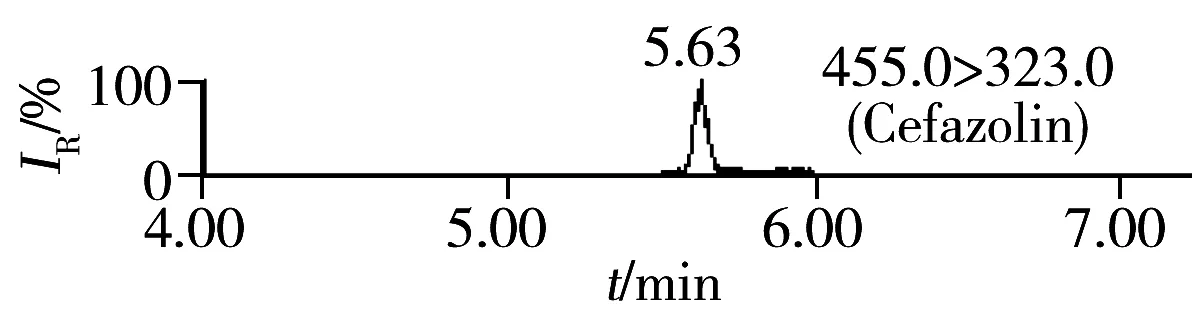
2.6 方法应用
采用优化后的样品前处理方法和分析条件分别对随机采集的16个配合饲料样品进行分析,均未检出上述16种头孢菌素类药物。
3 结 论
通过提取方法和仪器条件优化,建立了同时分析配合饲料中16种头孢菌素类药物的液相色谱-串联质谱方法,样品经乙腈-水溶液提取后可直接稀释进样分析。16种药物在10~2 500 μg/kg加标范围内的平均回收率为88.4%~93.6%,RSD为0.8%~4.7%;检出限为1.5~15 μg/kg,定量下限为5.0~50 μg/kg。方法具有简单、快速、准确和灵敏的特点,能满足饲料中16种药物含量分析的需要。

