红枣中4种链格孢菌毒素的检测及风险评估
程家兴,黎明阳,杨雨希,杨 茜,袁 涤,杨 颉,王毅聪,张锐利,杜振霞*
(1.北京化工大学 理学院,北京 100029;2.塔里木大学 生命科学学院,新疆 阿拉尔 843300)
红枣是中国新疆产量较大的瓜果之一,具有较高的营养和保健价值。真菌毒素污染是现阶段影响红枣产业健康发展的重大隐患,相关菌株侵染造成的新疆红枣“黑斑病”爆发越来越频繁,导致近几年红枣产量平均损失达30%以上(极端天气达60%),和田地区枣园发病率更是高达50%以上[1],造成了巨大经济损失。有研究报道红枣黑斑病致病菌主要为链格孢菌[2],而链格孢菌链格孢菌毒素对人体有较大危害[3],会引发细胞DNA突变,提高癌症发病率[4]。链格孢菌较为重要的代谢物有二苯并吡喃酮衍生物——链格孢酚(Alternariol,AOH) 、交链格孢酚单甲醚(Alternariol monomethyl ether,AME)、细交链格孢菌酮酸(Tenuazonic acid,TEA)及腾毒素(Tentoxin,TEN),而TEN是仅有的一种多肽类代谢产物,且毒性较强[5-6]。链格孢菌种可在低温下生长,在红枣的生长、采摘、储运及加工过程中也有产生链格孢菌毒素的风险。因此,针对新疆红枣中链格孢菌毒素的检测及风险评估具有重要的理论意义和应用价值。
Arcella等[7]使用毒理学关注阈值(TTC)方法评估了这些毒素对人体健康的影响。2011年,欧洲食品安全局(EFSA)针对饲料和食品中链格孢菌产生的毒素导致的公共卫生风险提出了科学意见[8]。目前,除巴伐利亚健康和食品安全权威机构外,世界各地均无关于霉菌毒素的法规[9]。Wei等[10]对中国干果中的链格孢菌毒素与其他毒素进行调查,发现在31.4%的干果中同时存在2~4种真菌毒素。故对链格孢菌的定性定量分析意义重大。目前关于红枣中链格孢菌毒素的定性定量研究较少,因此亟需建立红枣中该毒素的快速检测方法。
目前文献报道的检测链格孢毒素的方法有液相色谱(LC)法及液相色谱-质谱联用(LC-MS)法[11]、薄层色谱(TLC)法[12]、气相色谱(GC)及气相色谱-质谱联用(GC-MS)法[13]、酶联免疫吸附法(ELISA)法[14]。本研究建立了超高效液相色谱-串联质谱技术检测红枣中链格孢菌毒素的方法,借鉴QuEChERS前处理方法,在保证较高回收率的情况下,简化了前处理的步骤,相比已有方法具有检出限低、检测时间短等优势。本方法样品前处理简单,回收率高,基质效应低,提高了TEA、AOH在质谱中的灵敏度,具有灵敏度高、重现性好等优点,可满足大枣中4种链格孢菌毒素的检测要求。
1 实验部分
1.1 仪器与试剂
Waters Quatrro-Premier XE超高效液相色谱-串联质谱仪(美国Waters公司),配有ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7 μm);KH-100DE型超声波清洗器(昆山禾创超声仪器有限公司);WH-861涡旋混合器(太仓市华利达实验设备有限公司);Anke TGL-16G高速离心机(上海安亭科学仪器厂);Milli-Q A10超纯水器(美国Millipore公司);0.22 μm有机滤膜(津腾公司)。
交链格孢酚单甲醚(AME)、链格孢酚(AOH)、腾毒素(TEN)、细交链格孢菌酮酸(TEA)标准品(纯度>98%,新加坡Pribolab公司)。乙腈(色谱纯,Fisher Chemical公司);甲酸(纯度>98%,Acros公司);氯化钠(分析纯,Aladdin公司)。
1.2 标准溶液的配制
标准储备液:准确称取1.00 mg 4种毒素标准样品溶于1 mL 2.0%甲酸-乙腈溶液中,配制成质量浓度为1.0 g/L标准贮备液,-20 ℃保存。
标准工作液:使用2.0%甲酸-乙腈溶液配制质量浓度分别为1、2、5、10、50、100、500、1 000、2 000、5 000 μg/L的TEA、AME、TEN和AOH混合标准溶液。
1.3 样品前处理
准确称量0.2 g(精确至0.01 g)红枣样品于10 mL离心管中,加入5 mL 2.0%甲酸-乙腈溶液,20 ℃下恒温超声提取30 min,加入0.2 g NaCl固体粉末,涡旋30 s后以8 000 r/min离心10 min,用注射器取上清液,过0.22 μm有机滤膜后上机检测。
1.4 色谱-质谱条件
超高效液相色谱条件:流动相:A为超纯水,B为乙腈。洗脱梯度:0~3.0 min,95%~60%A;3.0~4.3 min,60%~5%A;4.3~5.0 min,5%A;5.0~5.1 min,5%~95%A;5.1~6.0 min,95%A;流速:0.35 mL/min,色谱柱:Acquity UPLC BEH C18液相色谱柱( 50 mm ×2.1 mm,1.7 μm);柱温:35 ℃,进样量:2 μL。
质谱条件:离子化模式:电喷雾离子源(ESI-);扫描方式:多反应监测(MRM);毛细管电压2.5 kV,离子源温度120 ℃,脱溶剂温度 350 ℃,脱溶剂气流量 650 L/h,锥孔反吹气流量 50 L/h,碰撞气流量 0.15 L/min。4种链格孢霉毒素的母离子、子离子、锥孔电压和碰撞电压等质谱参数如表1所示。

表1 4种链格孢霉毒素的串联质谱测定参数Table 1 MS/MS parameters of fouralternaria mycotoxins
*quantitation ion
2 结果与讨论
2.1 色谱-质谱条件的选择
在ESI-电离模式下,以[M-H]-的准分子离子峰作为母离子,得到TEN、TEA、AOH、AME的母离子分别为m/z413.3、196.1、257.1、271.1。再进行子离子扫描,确定MS/MS中两个子离子丰度较高时的碰撞电压,并确定各目标化合物的定性和定量离子对。
实验发现在配制标准品溶液时加入甲酸可显著提高TEA和AOH的质谱响应。分别比较了使用0.1%甲酸-初始流动相、0.5%甲酸-初始流动相、1.0%甲酸-初始流动相、1.5%甲酸-初始流动相、2.0%甲酸-初始流动相和2.5%甲酸-初始流动相配制毒素标准品时的质谱响应,结果表明用2.0%甲酸-初始流动相配制的毒素标准品溶液的响应最高。
选用ACQUITY UPLC BEH C18色谱柱进行色谱条件优化。考察了甲醇-水、乙腈-水、乙腈-0.1%甲酸水溶液、乙腈-5 mmol乙酸铵水溶液和0.1%甲酸乙腈-0.1%甲酸水溶液多种流动相的分离效果,结果表明在流动相中加入甲酸或乙酸铵均会抑制毒素在质谱中的响应,最终确定以乙腈-水作为流动相,优化并确立了梯度洗脱程序。
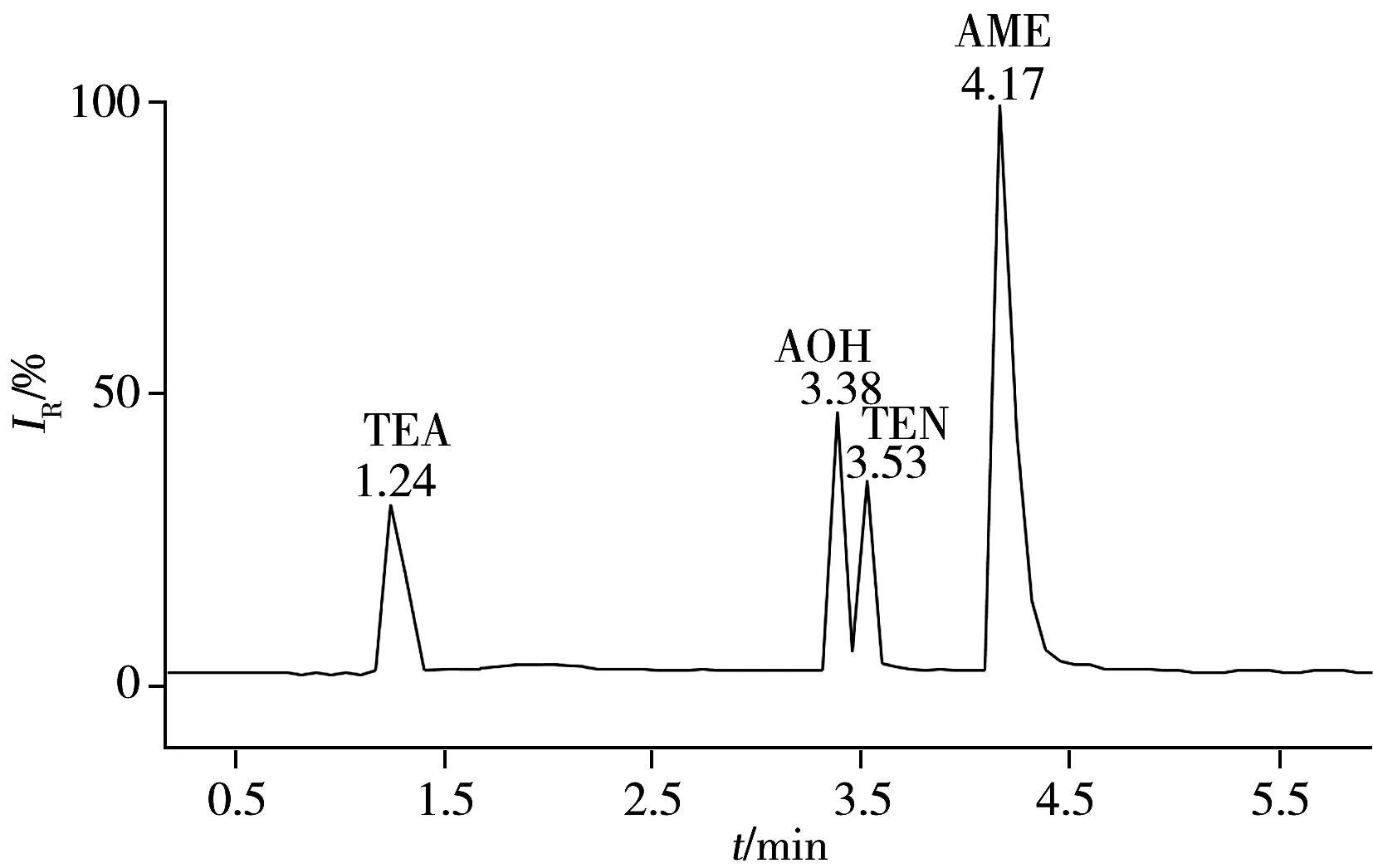
图1 4种链格孢菌毒素的总离子流色谱图Fig.1 Total ion flow chromatogram of fouralternaria mycotoxins
在优化色谱条件下,难分离的AOH和TEN得到更好的分离[15],TEA和AOH的灵敏度也进一步提高,图1为4种毒素混合标准溶液的总离子流图。
2.2 前处理条件的优化
2.2.1样品量的影响文献[16-17]一般采用2.0~5.0 g样品进行链格孢菌毒素提取,通过前期实验发现,实际被链格孢菌感染的红枣中4种毒素的含量很高,尤其是TEA在样品量高于0.5 g时即超出线性范围,易造成色谱柱过载。本实验分别考察了0.1、0.2、0.5 g样品量对红枣链格孢菌毒素回收率的影响。结果表明,当样品量为0.1、0.2 g时的回收率相近,4种毒素的回收率均在90%以上,但0.1 g样品量下部分毒素的精密度和重现性差,AOH和TEA的相对标准偏差(RSD)为10.1%~21.3%。样品量为0.5 g时,TEA的平均回收率降至75.4%,因此选择0.2 g为样品的称取量。
2.2.2提取溶剂的影响4种毒素极性均较大,因此本实验分别选用极性较大的有机溶剂(即含2.0%甲酸的甲醇和含2.0%甲酸的乙腈)对红枣中的链格孢菌毒素进行提取。结果发现,以含2.0%甲酸的甲醇作为提取溶剂时,溶液颜色变深,表明基质效应明显,且4种毒素的回收率均下降,其中TEA的回收率由103%降至62.4%。因此,本实验选择2.0%甲酸-乙腈作为提取溶剂。
2.2.3干燥剂的影响本实验的前处理方法借鉴QuEChERS方法,简化了其吸附剂的步骤,比较了使用无水MgSO4干燥和不使用干燥剂两种情况下4种毒素的回收率。由于红枣本身水分较少,因此两种情况下4种毒素的回收率相差不大,均在90%以上。在不引入其他杂质的情况下,选择不使用干燥剂。
2.3 基质效应的影响
分别用溶剂标准溶液和基质空白标准溶液配制500 μg/L的4种毒素混合溶液。通过下式计算基质效应(ME):ME=(S1-S2)/S2,式中S1为毒素标准品在基质空白标准溶液中的平均峰面积,S2为毒素标准品在纯溶剂标准溶液中的平均峰面积。
结果表明,AME的ME为-4.65%,AOH的ME为-12.44%,TEN的ME为-1.56%,TEA的ME为-25.35%,在基质空白标准溶液中未检测到强烈的离子抑制(ME<-30%)。表明外标法可用于4种链格孢菌毒素的测定。
2.4 方法学评价
2.4.1线性范围与检出限在优化条件下,对一系列质量浓度的混合标准溶液进行检测。以质量浓度为横坐标,定量离子对的色谱峰面积为纵坐标,绘制标准曲线,结果见表2。由表2可见,AOH的线性范围为1.0~100 μg/L,AME、TEA和TEN的线性范围为10~1 000 μg/L,在此范围内线性关系良好(r2>0.990)。当信噪比S/N≥3时,TEN、AME、AOH和TEA的检出限( LOD )为0.5~12.4 μg/kg。

表2 红枣基质中4种链格孢菌毒素的线性范围、线性方程、相关系数及检出限(LODs)Table 2 Liner ranges,linear equations,correlation coefficients and limits of detection(LODs) of four alternaria mycotoxins in jujube
2.4.2回收率与相对标准偏差按优化条件,在空白样品基质中进行3个水平(40、100、400 μg/kg)的加标回收实验,每个加标水平平行实验3次,测定4种链格孢菌毒素的加标回收率及相对标准偏差(RSD)。结果显示,4种链格孢菌毒素的平均回收率为92.8%~116%,RSD为0.5%~11.2%,日间精密度为2.1%~12.3%,表明方法具有良好的准确度与精密度。
2.5 实际样品的测定
采用本方法检测10份新疆红枣实际样品,其中4份检出链格孢菌毒素,AOH、AME、TEN和TEA的检出量分别为0.048~5.050 mg/kg、LOD~11.770 mg/kg、LOD~0.320 mg/kg、1.205~1 070.300 mg/kg;其中TEA在红枣中检出量最高,与文献报道一致[17-18]。
2.6 风险评估
目前,全世界有80多个国家和地区制定了果品中真菌毒素的限量标准,但均未包括链格孢菌毒素[6]。链格孢菌毒素广泛分布于果蔬食品中,其检出率为25%~75%[19]。本研究在红枣中检出的最高含量达1 070.300 mg/kg,远高于链格孢菌毒素在其他食品中的含量。高检出率与高含量可能会存在潜在的健康隐患,因此本实验基于T.E.S.T软件和Toxtree软件计算了4种链格孢菌毒素的毒理学评估数据(表3)。表3中TTC Class、Protein binding Alerts 和DNA binding Alerts由Toxtree软件给出,生物蓄集系数(Bioaccumulation factor)和LD50由T.E.S.T软件给出。LD50(man)根据LD50值使用等效剂量系数转换的方法计算得到[20]。最大无效水平(The maximal no-effect level,NOEL)根据公式(1)得到,在此基础上根据公式(2)得到允许每日暴露量(The permitted dailyexposure,PDE)[21-22]。
(1)
(2)
式中,BW表示成年人的体重,F1~F5均为不确定因子,在本研究中的取值依次为12、10、10、10、1。由表3可知,体重为60 kg的成年人的PDE范围为19.30~25.65 μg/d,而TEA在红枣中的最高含量高达1 070.300 mg/kg,虽然目前尚无中国人的饮食数据,但果品中链格孢菌毒素尤其是检测含量最高的TEA确实存在健康隐患。同时,相对于TEA,虽然AOH和AME的含量较低,但AOH和AME具有遗传毒性,其潜在危害亦不可忽视。

表3 4种链格孢菌毒素的毒理学评估Table 3 Toxicological assessment of four alternaria mycotoxins
3 结 论
本文利用超高效液相色谱-串联质谱法并结合简化的QuEChERS技术,建立了快速检测红枣中TEA、AOH、TEN和AME 4种链格孢菌毒素的方法。该方法样品前处理简单,回收率均大于90%,基质效应小,具有操作简便、快速、灵敏度高、检出限低、重现性好等优点,能满足红枣中链格孢菌毒素的检测要求。同时运用毒理学软件对4种链格孢菌毒素进行毒理学评估,发现链格孢菌毒素对于人体具有潜在危害,值得关注。未来可扩大范围测定其他果蔬中链格孢菌毒素含量,并结合中国人饮食数据,从而更加准确评估中国人链格孢菌毒素的日暴露量。

