基于特征肽段的液相色谱-质谱技术鉴定胶原蛋白的物种来源
阳洪波,王韦达,李 意,刘奕雄,朱宇薇,杜业刚*,杨国武*
(1.深圳市计量质量检测研究院,广东 深圳 518109;2.深圳大学西丽校区测试中心,广东 深圳 518055;3.深圳明德实验学校,广东 深圳 518034)
胶原蛋白是动物体内含量相对最多、分布最广的蛋白质(占动物体内总蛋白含量的25%~33%),根据每条肽链上的氨基酸序列及交联方式不同,胶原蛋白有很多种类型[1]。目前,至少有28种不同类型的胶原蛋白[2],其中Ⅰ型是人和动物中最丰富及最为广泛研究的胶原蛋白,大部分存在于皮肤、肌腱、角膜等结缔组织中,约占生物体全部胶原的80%~90%[3];Ⅱ型主要存在于软骨、玻璃体和椎间盘;Ⅲ型主要存在于新生皮肤、血管和网状纤维等组织中,Ⅵ型主要存在于真皮、软骨、胎盘等组织中[4]。胶原蛋白作为一种天然的生物原料,其高度的生物相容性、可降解性以及生物活性使之在医药、食品、保健品、摄影、化妆品、皮革、造纸等领域中应用广泛[5-6]。胶原蛋白主要来源于动物的皮、骨或筋腱等组织,其中来源于猪牛羊最为常见,且易于获得,所以本实验主要选择猪牛羊3种动物进行研究。近年来疯牛病和口蹄疫的发生以及食物过敏的危险使人们备加关注胶原蛋白的动物来源[7];另外,由于宗教因素,虔诚的宗教徒们对食物有严格的限制,犹太教和伊斯兰教禁忌猪及其制品,印度教禁忌牛及其制品[8]。而中国药典对阿胶、鹿角胶、龟甲胶等传统名贵胶类药材的动物来源有严格的要求,但这些中药材因生产原料资源有限,价格昂贵,有不法厂商为降低成本向其中掺入牛皮源、猪皮源或羊皮源原料[9-10]。因此,建立胶原蛋白动物来源的鉴别方法具有重要的现实意义。
不同动物的胶原蛋白具有较高的同源性,导致其光谱性质和理化性能差异不显著,因此鉴别其物种来源十分困难,文献报道胶原蛋白的鉴定方法有电泳法[11-12]、免疫学方法[13]和质谱技术[14]。电泳法的自动化程度低、蛋白质易丢失,对强酸、强碱、难溶、低丰度的蛋白质分离效果差。酶联免疫吸附法(ELISA)一次只能检测单个蛋白质,不能同时检测多个物种,反应特异性差。基于高通量和高分辨率质谱技术,结合蛋白质数据库分析不同物种蛋白质的方法简单、准确、可靠,近年来已成为蛋白质鉴定的主要方法。由于不同物种蛋白质的氨基酸序列存在差异,通过序列差异鉴别胶原蛋白是一种潜在的追溯其物种来源的方法。肽质量指纹图谱(Peptide mass fingerprinting,PMF)是一种蛋白质鉴定技术[15-16],但基于PMF的蛋白鉴定依赖单一蛋白,混合蛋白会使PMF的分析复杂化,并可能得到不正确的结果,对于含有超过2~3种蛋白样品的PMF鉴定,需额外使用液相色谱-串联质谱(LC-MS/MS)技术以提升蛋白鉴定的特异性。基于特征肽段的质谱检测技术多用于鉴别蛋白的来源,Kumazawa等[17]基于LC-MS,利用胶原蛋白特征肽段鉴别皮革的动物源性,结果显示只有羊的特征肽段具有特异性,未找到牛、马、猪、鹿的胶原蛋白特征肽段。Li等[18]先通过生物信息学的方式寻找鉴别几个物种胶原蛋白的理论肽段,再利用LC-MS/MS分析与理论肽段匹配,结合高分辨质谱确证,选择实际样品中能检测到的特征肽段进行研究。由于前处理、肽段含量或肽段稳定性等因素,很多理论上存在的特征肽段在实际样品可能检测不到,增加了鉴定的工作量,且多反应监测方法(MRM)仅扫描1个子离子,易产生假阳性峰。
本研究利用纳升液相色谱-串联飞行时间质谱(nanoLC-TOF-MS)对猪皮、牛皮和羊皮样品中的蛋白和多肽进行分离鉴定,数据经ProteinPilotTM软件与UniProt蛋白数据库对比分析,筛选出实际样品中能检测到的猪、牛和羊胶原蛋白潜在的特征肽段后在美国国立生物技术信息中心(NCBI)网站上进行blast分析,进一步确认其特异性;采用四极杆/线性离子阱串联质谱(QTRAP-MS)独特的MRM-IDA-EPI模式,建立MRM方法,并结合MRM触发的增强子离子扫描(Enhanced product ion,EPI)方式进一步确认肽段序列,从而可有效消除假阳性的MRM峰,增加了检测结果的可靠性和准确性。该方法操作简便,在胶原蛋白的动物来源鉴别中具有独特优势。
1 实验部分
1.1 仪器与试剂
TripleTOF®6600飞行时间质谱仪(配纳升电喷雾电离源和EksigentnanoLC-Ultra®液相系统),QTRAP®6500+四极杆/线性离子阱串级质谱(美国AB Sciex公司);Waters AcquityTM超高效液相色谱仪(UPLC,美国Waters公司);5424R型冷冻离心机(德国Eppendorf公司);DNP-9272型电热恒温培养箱(上海精宏实验设备有限公司);SK2510LHC型超声波萃取仪(上海科导超声仪器有限公司);CPA224S型万分位分析天平(德国赛多利斯公司);HV-110型自动高压灭菌器(日本Hirayama公司);KS4000i型空气控温摇床(德国IKA公司);Trap柱Eksigent C18(350 μm×0.5 mm,3 μm)、分析柱Eksigent C18(75 μm×150 mm,3 μm)(美国AB SCIEX公司);分析柱Eclipse Plus C18(2.1 mm×100 mm,1.8 μm)(美国Agilent公司);10 kDa超滤离心管(德国赛多利斯公司)。
TPCK-胰蛋白酶(序列分析级,美国Sigma-Aldrich公司);乙腈、水(质谱纯,德国Merck公司);甲酸(质谱纯,美国Thermo Fisher公司);尿素、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)、二硫苏糖醇(DTT)、碘乙酰胺(IAA,美国Amresco公司);硫脲(美国Sigma-Aldrich公司);其他试剂均为国产分析纯。
1.2 样品采集
猪皮、牛皮和羊皮均购自当地正规的商业屠宰场。剔除皮样品中的毛及肌肉组织后将其分割成小块,冻干后于-20 ℃保存,待用。
1.3 蛋白质的提取
分别称取猪皮、羊皮和牛皮各1 g高温高压处理1 h(121 ℃,0.1 MPa),加入5 mL蛋白提取液(7 mol/L 尿素,2 mol/L硫脲,40 g/L CHAPS),振荡过夜。于12 000 r/min离心20 min,取上清液备用。采用Bradford法测定蛋白浓度。
1.4 蛋白样品前处理
根据测定的蛋白浓度,取适量上清液转移至低吸附离心管中,补加尿素(8 mol/L)至100 μL,加2 μL二硫苏糖醇(1 mol/L),37 ℃反应1 h,还原二硫键,然后加入10 μL碘乙酰胺(1 mol/L)室温避光反应30 min,进行烷基化处理。将样品溶液转移至超滤离心管中(截留分子量为10 kDa),离心过量的DTT、IAA和部分杂质,并用碳酸氢铵(50 mmol/L)溶液置换3次;向超滤管中加入100 μL测序级胰蛋白酶(1∶80,质量比),摇匀,37 ℃酶解过夜,离心收集滤液。
1.5 特征肽段的筛选
1.5.1色谱条件色谱柱:Trap柱Eksigent C18(350 μm×0.5 mm,3 μm),分析柱Eksigent C18(75 μm×150 mm,3 μm);流动相:A为0.1%甲酸水-乙腈溶液(98∶2,体积比),B为0.1%甲酸乙腈-水溶液(98∶2,体积比);梯度洗脱程序:0~0.5 min,95%~93%A;0.5~40 min,93%~78%A;40~70 min,78%~65%A;70~75 min,65%~20%A;75~80 min,20%A;80~81 min,20%~95%A;81~90 min,95%A;流速:300 nL/min;进样量:6 μL。
1.5.2质谱条件采用TOF-MS系统结合纳升喷雾电离源,喷雾电压2 300 V,气帘气:207 kPa(30 psi),雾化气:41 kPa(6 psi),加热温度150 ℃,质谱扫描方式为信息依赖的采集工作模式(Information dependent analysis,IDA)。一级TOF-MS单张图谱的扫描时间为250 ms,每次IDA循环下,最多采集30张电荷为2+~5+且单秒计数大于150的二级质谱,每张二级质谱的累积时间为50 ms。
1.5.3数据分析对质谱采集到的原始.wiff图谱文件,采用ProteinPilot 5.0软件进行检索分析。参数设置如下:半胱氨酸烷基化为碘乙酰胺修饰、胰蛋白酶酶解,数据库为Uniprot-Mammlia,检索方式为彻底检索分析。
1.6 MRM质谱方法的建立
1.6.1色谱条件色谱柱:Eclipse Plus C18(2.1 mm×100 mm,1.8 μm);柱温:40 ℃;进样量2 μL;流速:300 μL/min;流动相:A为乙腈,B为1%甲酸水溶液;梯度洗脱程序:0~10 min,5%~15%A;10~11 min,15%~80%A;11~13.5 min,80%A;13.5~14.5 min,80%~5%A;14.5~18 min,5%A。
1.6.2质谱条件离子源:电喷雾离子源(ESI);扫描模式:正离子扫描,多反应监测触发增强子离子扫描(MRM-IDA-EPI)模式;喷雾电压:5 500 V;离子源温度:550 ℃;气帘气:276 kPa(40 psi);雾化气:379 kPa(55 psi);反吹气:379 kPa(55 psi);MRM质谱采集参数见表1。
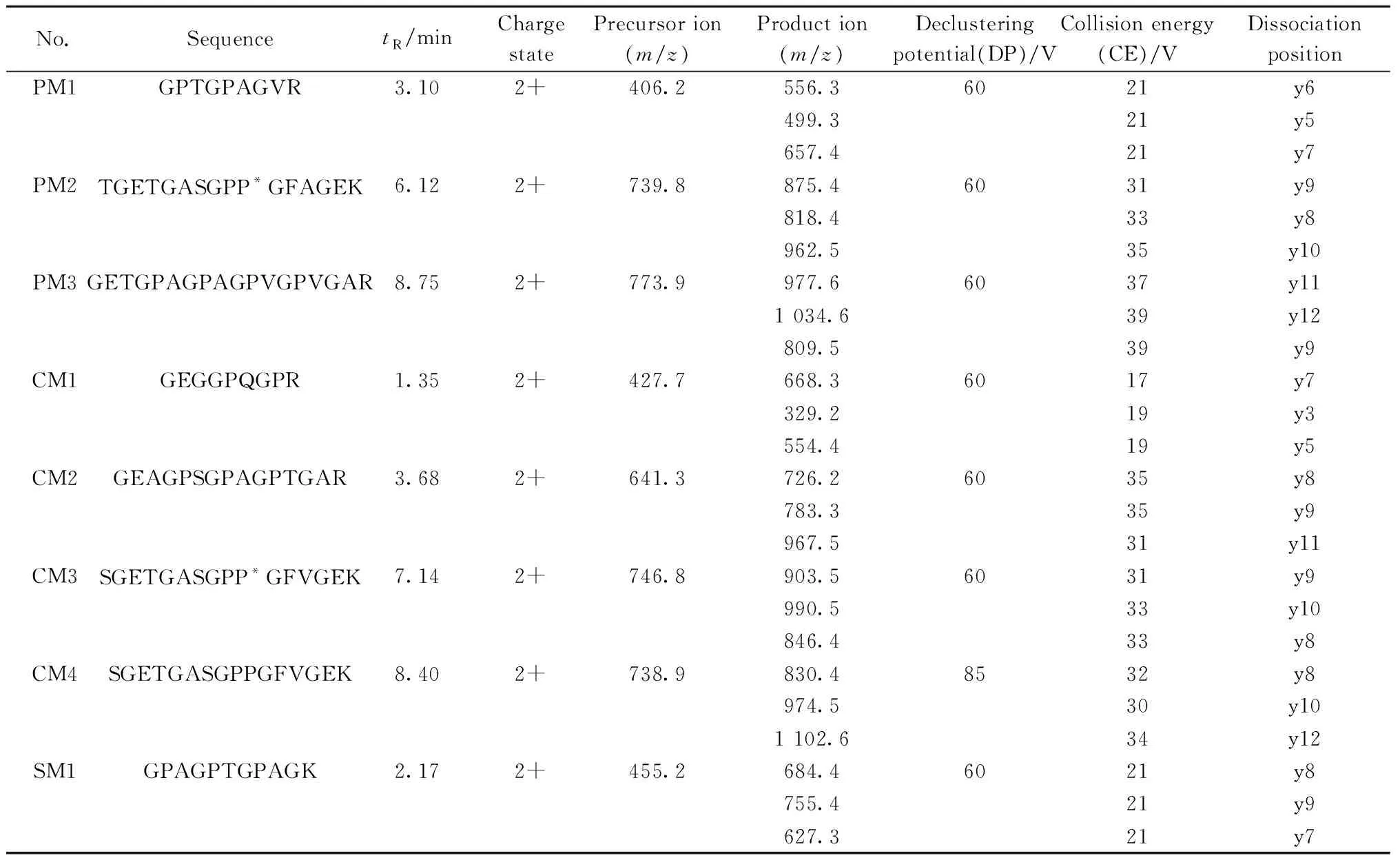
表1 MRM质谱采集参数Table 1 MRM mass spectrometric acquisition parameters
P*:prolinehydroxylation(脯氨酸羟基化);PM:pig collagen peptide marker(猪胶原蛋白特征肽段);CM:cattle collagen peptide marker(牛胶原蛋白特征肽段);SM:sheep collagen peptide marker(羊胶原蛋白特征肽段)
2 结果与讨论
2.1 猪牛羊胶原蛋白特征肽段的筛选
采用纳升液相色谱-串联飞行时间质谱分析胰蛋白酶酶解后的猪皮、牛皮和羊皮多肽样品,数据经ProteinPilotTM软件与UniProt蛋白数据库对比分析。通过比较各个物种皮类鉴定的蛋白质和肽段列表,找到只在猪皮、牛皮或羊皮样品中的特征肽段,这些特征肽段可作为猪、牛或羊的特异标志物,且这些肽段对应的蛋白质在此3个物种中均能鉴定到,只是肽的氨基酸序列有差别。最后将这些特征肽段在NCBI网站上进行blast分析,排除自身存在而未检测到的肽段或其他可能物种的肽段干扰,进一步确认其特异性,即这些肽的氨基酸序列不能与其他几个物种100%匹配。经过蛋白数据库鉴定筛选及blast分析,猪、牛和羊的特征肽段信息见表2,鉴定到猪、牛、羊的特征肽段主要来源于胶原蛋白Ⅰ型的α1链和α2链,其中羊胶原蛋白Ⅰ型α2链的特征肽段“GPAGPTGPAGK”,以及猪胶原蛋白Ⅵ型α2链和α3链的3条特征肽段“LFAVPPNLQLNEQGLR”、“DILTESAGSR”和“VVIHFTDGADGDLADLQR”均未见文献报道。猪胶原蛋白特征肽段“TGETGASGPP*GFAGEK”和牛胶原蛋白特征肽段“SGETGASGPP*GFVGEK”存在脯氨酸羟基化修饰位点,羟脯氨酸作为胶原蛋白的特异性氨基酸,含量稳定,约占总胶原蛋白的7%~10%,且在其它动物蛋白质中含量极微[19],因此选择有脯氨酸羟基化修饰位点的肽段作为鉴别胶原蛋白的特征肽段具有很强的特异性。胶原蛋白中脯氨酸的含量仅次于甘氨酸,且脯氨酸和羟脯氨酸的含量与胶原蛋白的稳定性、变性温度呈正相关[20],而鉴定到的肽段大部分均含有多个脯氨酸,故能在高温高压等严苛的处理过程中稳定存在,不受胶原蛋白生产制备工艺的影响。在寻找猪皮、牛皮、羊皮的潜在特征肽段时,排除了鉴定蛋白中置信度(ProteinPilot软件自动给出)小于95%的肽段,增加了特征肽段的可靠性。另外,由于胰蛋白酶酶切效率的影响,会出现过切或漏切等现象[21],筛选潜在特征肽段时,应及时排除存在过切或漏切位点的特征肽段,同时避免选择出现天冬酰胺脱酰胺、谷氨酸N-末端环化、甲基化和磷酸化等不稳定存在的肽段。
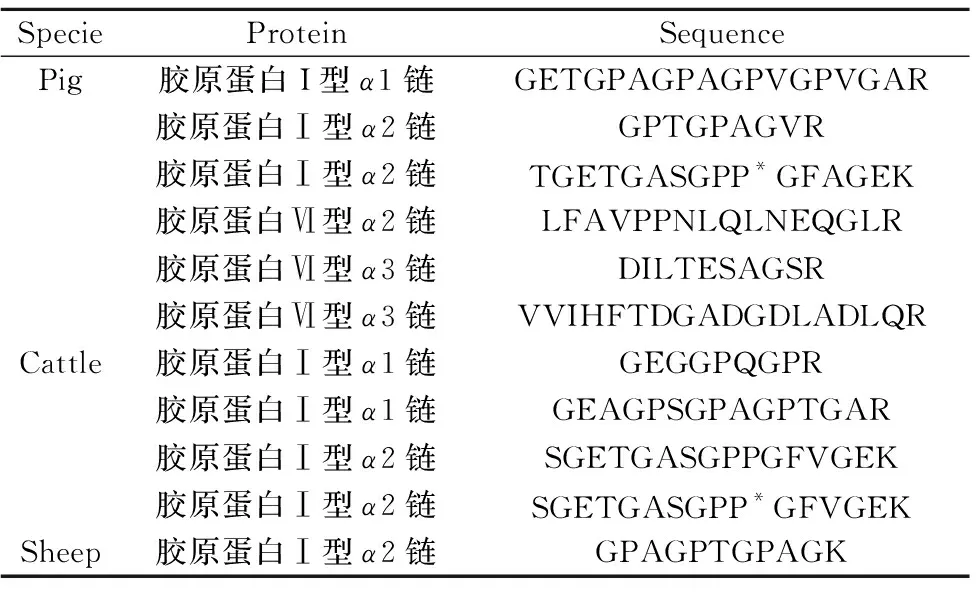
表2 猪、牛和羊的特征肽段Table 2 Marker peptides of pig,cattle and sheep
P*:proline hydroxylation(脯氨酸羟基化)






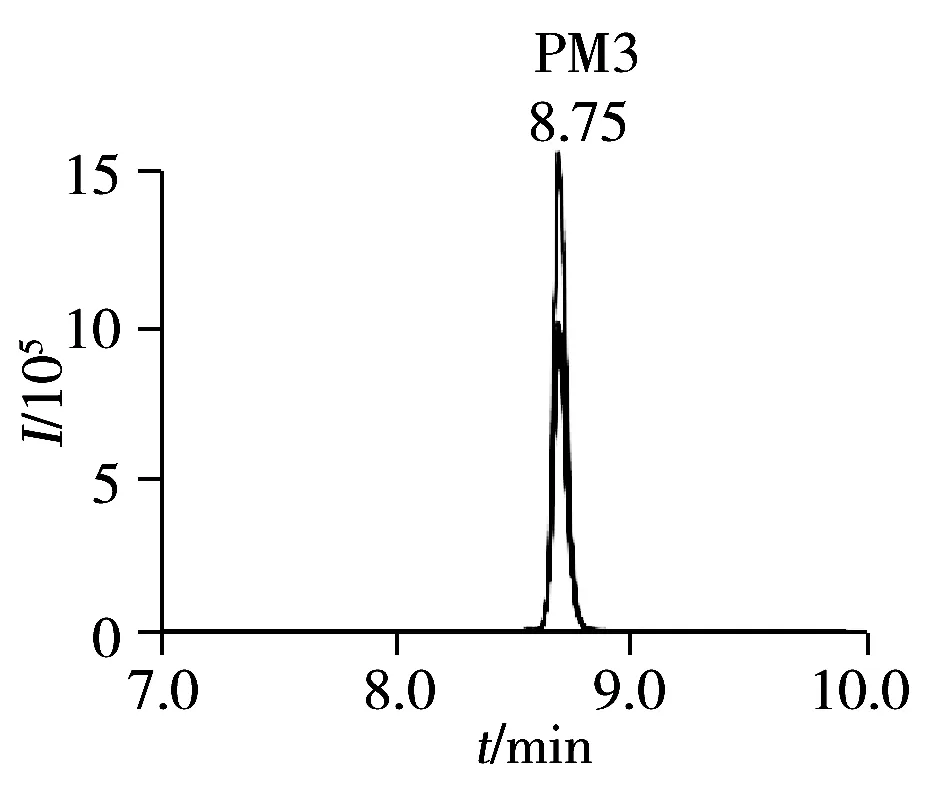

图1 猪牛羊胶原蛋白特征肽段的MRM提取离子流图Fig.1 MRM chromatograms of pig,cattle and sheep collagen marker peptideA:cattle skin,B:pig skin,C:sheep skin,PM:pig collagen marker peptide,CM:cattle collagen marker peptide,SM:sheep collagen marker peptide,ion mass charge ratios shows in Table 1
2.2 猪牛羊胶原蛋白特征肽段的特异性验证
通过高分辨质谱及数据库检索筛选到的特征肽段,必须经质谱MRM检测方法进一步验证其特异性。采用超高效液相色谱四极杆/线性离子阱串联质谱建立了MRM-IDA-EPI检测方法,利用Skyline软件构建猪皮、牛皮和羊皮特征肽段的MRM离子对,优化DP、CE等质谱参数,然后在猪皮、牛皮、羊皮样品中逐一进行筛选和确认。与文献[17-18]方法相比,本方法通过多个MRM离子对、MRM触发EPI扫描方式以及保留时间进一步确认肽段序列,有效消除了假阳性的MRM峰,增加了检测结果的可靠性和准确性。从实际样品中寻找特征肽段,结合UniProt蛋白数据库信息及blast分析,简化了肽段特异性验证工作。研究发现,猪胶原蛋白Ⅵ型的3条特征肽段在猪皮样品中的响应较弱,可能原因是胶原蛋白Ⅰ型约占生物体全部胶原的80%~90%,而胶原蛋白Ⅵ型在猪皮中的含量较低,为保证鉴别结果的重现性及灵敏度,应选择高丰度蛋白对应的肽,因此不选择猪胶原蛋白Ⅵ型的3条特征肽段作为鉴定胶原蛋白物种来源的特征肽段。猪、牛、羊Ⅰ型胶原蛋白特征肽段优化后的MRM质谱参数见表1,根据“1.6”的检测方法,在猪皮、牛皮、羊皮样品中分别筛选确认,猪牛羊胶原蛋白特征肽段的MRM提取离子流图见图1。猪胶原蛋白特征肽段只在猪皮样品中出峰,牛皮和羊皮样品中无明显的色谱峰;羊胶原蛋白特征肽段只在羊皮样品中出峰,猪皮和羊皮样品中无明显的色谱峰;牛胶原蛋白特征肽段CM2、CM3和CM4只在牛皮样品中出峰。其中羊皮样品中保留时间为1.5 min处的色谱峰与牛胶原蛋白特征肽段CM1在牛皮样品中保留时间(tR=1.34 min)接近,将肽段CM1在牛皮样品中的EPI质谱图(tR=1.34 min)和羊皮样品中的EPI质谱图(tR=1.5 min)进行比较(图2),发现肽段CM1在牛皮样品中的EPI质谱图出现明显的y1~y7离子,而在羊皮样品中无y7离子m/z668.2,m/z329.2和m/z554.2,虽然与y3和y5离子有相同质荷比,但各自的同位素峰强度不同,因此通过肽段CM1的保留时间和EPI质谱图可知,羊皮样品中出现的肽段CM1色谱峰为假阳性MRM峰。猪、牛、羊的胶原蛋白特征肽段只分别在猪皮、牛皮、羊皮样品中出峰。结果表明猪、牛、羊的特征肽段具有特异性和专属性。
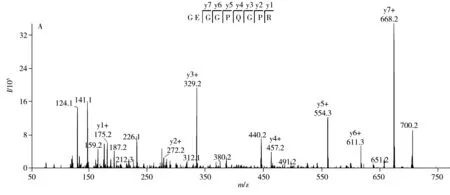

图2 牛胶原蛋白特征肽段在不同样品中的EPI质谱图Fig.2 EPI spectra of cattle collagen marker peptide for different samplesA:cattle skin,tR=1.34 min;B:sheep skin,tR=1.5 min
2.3 方法应用
运用建立的方法检测食用明胶、黄明胶和阿胶中胶原蛋白的动物来源,其MRM提取离子流图如图3所示,由于食用明胶的原料主要来源于猪、牛和羊等动物的皮、骨和筋腱等组织,因此猪、牛、羊的特征肽段均有检出,但由于骨和筋腱中也含有胶原蛋白,且各组织的含量比例不确定,所以食用明胶中猪牛羊胶原蛋白特征肽段的相对强度和对应的皮的强度不一致,肽段SM1、PM2和CM4的响应较低。黄明胶来源于牛科动物黄牛的皮,因此只有牛胶原蛋白特征肽段有检出,且其相对强度与牛皮的强度保持一致。猪和羊胶原蛋白特征肽段的保留时间处未检测到明显的色谱峰。食用明胶和黄明胶的制备工艺中均有长时间蒸煮熬胶的步骤,而本研究筛选的特征肽段在这类样品中均有一定的响应,说明这些肽段具有良好的热稳定性,该检测方法可以鉴别食用明胶和黄明胶胶原蛋白的动物来源。阿胶来源于马科动物驴的皮,2015年版《中国药典》采用高效液相色谱-质谱法,选择肽段“GPP*GAAGPP*GP*R”作为特征肽段鉴别阿胶[22],实验结果显示在阿胶样品中只检测到阿胶的特征肽段,猪牛羊胶原蛋白特征肽段的保留时间处未检测到明显的色谱峰,说明该方法可用于阿胶中掺入猪皮源、牛皮源或羊皮源成分的鉴别检测。
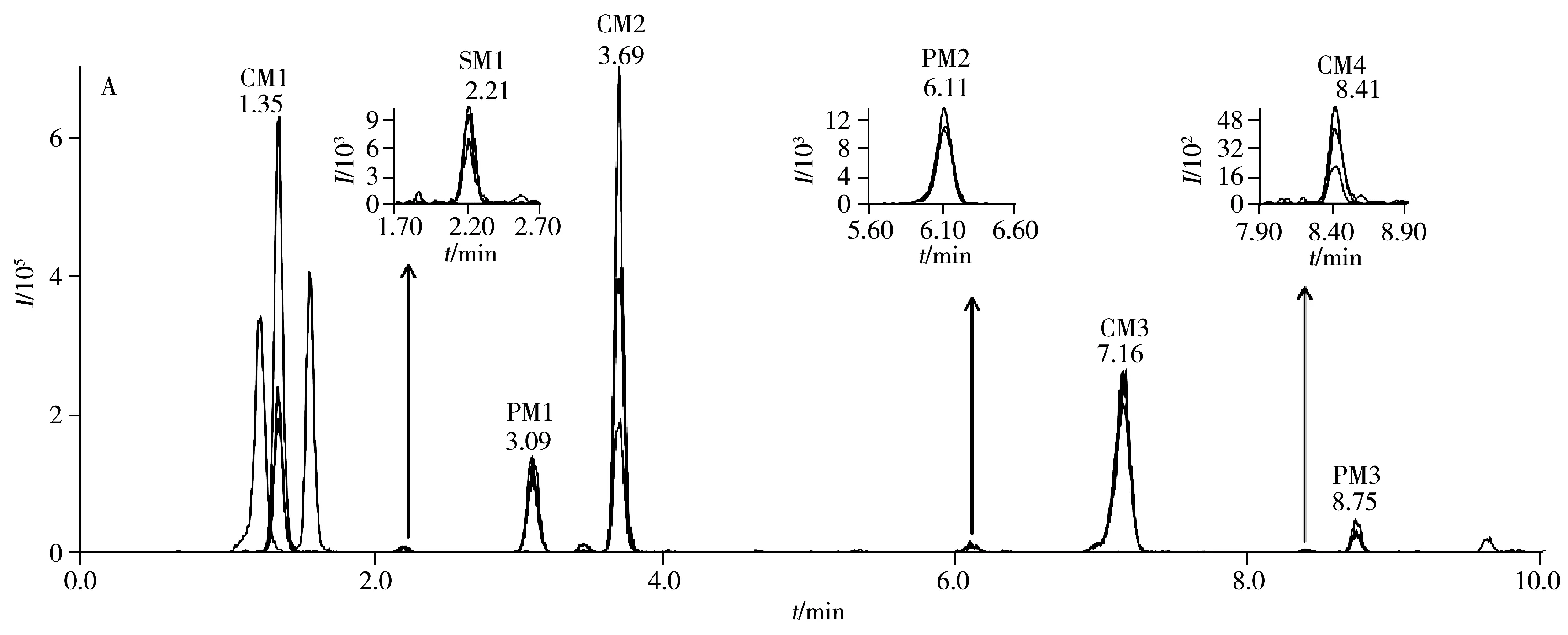
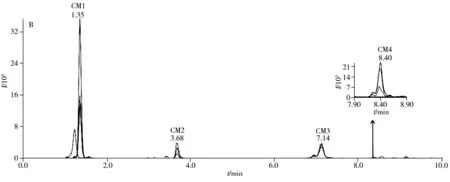
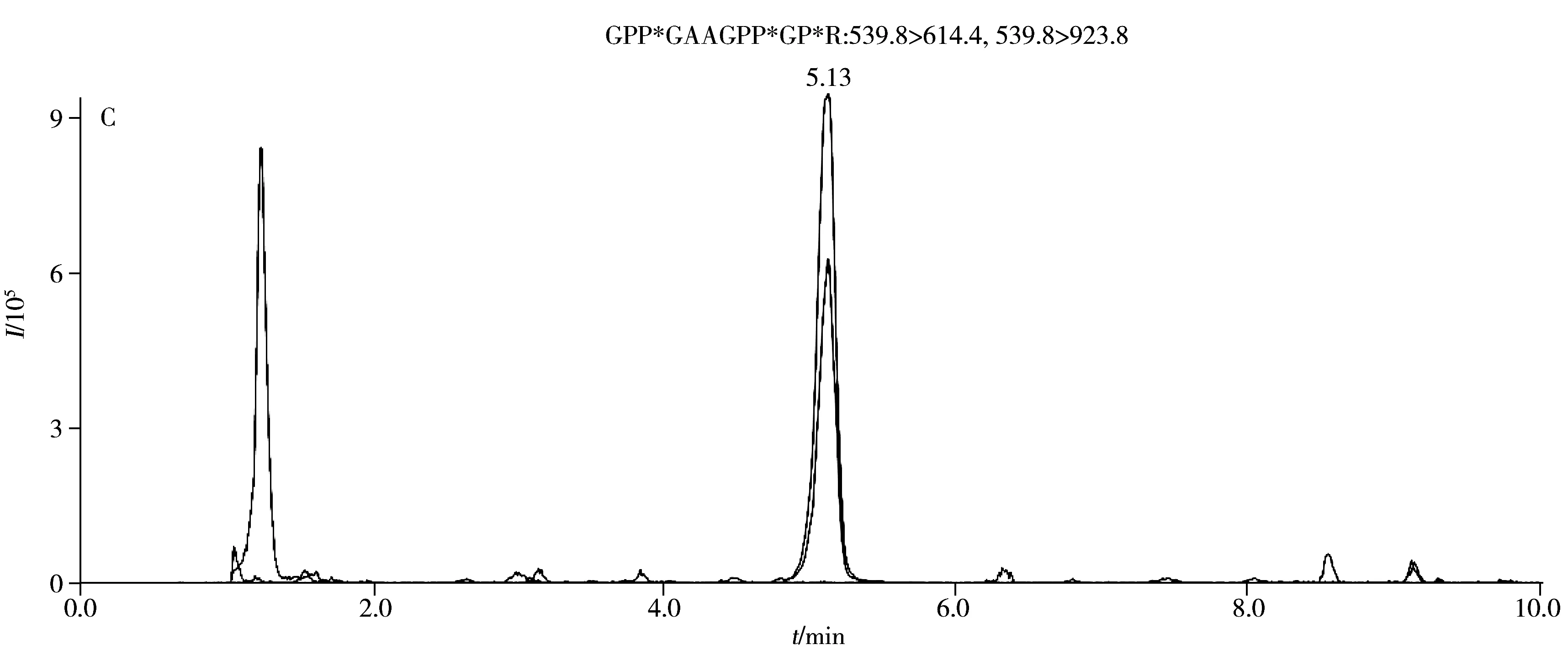
图3 食用明胶(A)、黄明胶(B)和阿胶(C)中猪牛羊胶原蛋白特征肽段的MRM提取离子流图Fig.3 MRM chromatograms of pig,cattle and sheep collagen marker peptide for edible gelatin(A),oxhide gelatin(B) and collacoriiasini(C)PM:pig collagen marker peptide,CM:cattle collagen marker peptide,SM:sheep collagen marker peptide,ion mass charge ratios show in Table 1
3 结 论
本研究采用nanoLC-TOF-MS系统和ProteinPilotTM软件筛选出猪牛羊胶原蛋白的潜在特征肽段;利用QTRAP-MS建立了猪牛羊胶原蛋白特征肽段的MRM-IDA-EPI检测方法,最终确认了3种猪源性胶原蛋白特征肽段,4种牛源性胶原蛋白特征肽段,1种羊源性胶原蛋白特征肽段,其中羊源性胶原蛋白特征肽段“GPAGPTGPAGK”未见文献报道,且筛选的特征肽段能在高温高压处理过程中稳定存在,不受胶原蛋白生产制备工艺的影响。MRM触发的EPI扫描方式可以进一步确认肽段的序列,从而有效避免假阳性,增加检测结果的可靠性和准确性。本方法为追溯胶原蛋白物种来源提供了一种快速、稳定、灵敏、特异的检测技术,可应用于检测阿胶、鹿角胶和龟甲胶等名贵胶类药材中是否掺入牛皮源、猪皮源或羊皮源等原料,也可应用于食用明胶、黄明胶等胶原蛋白的物种来源鉴别,为胶原蛋白的市场监督提供了高效、有力的技术支撑。

