miR-222在藏猪和DLY猪背最长肌和腰大肌中的表达差异研究
郑 婷,甘麦邻,李 强,钟志君,张顺华*,朱 砺*
(1.四川农业大学动物科技学院,四川 成都 611130;2.四川省畜牧总站,四川 成都 610041;3. 四川省畜牧科学研究院,四川 成都 610066)
动物肌肉组织是人类主要的蛋白质来源之一,对于农场动物,尤其是肉用家畜来说,产肉是最重要的经济性状之一,动物骨骼肌的发育情况直接决定了其产肉能力和肉品质。脊椎动物的骨骼肌细胞是一种经过复杂的分化过程形成的具有收缩功能的多核细胞。在动物胚胎发育的过程中,来自中胚层的祖细胞首先进行增殖,随后退出细胞周期在生肌调节因子(myogenic regulatory factors, MRFs)的驱动下分化、融合成肌管,最终形成肌纤维[1-2]。通常根据肌纤维表达的肌球蛋白重链(Muscle heavy chains, MyHC)亚型的差异可将骨骼肌分为慢速氧化型肌纤维(MyHCⅠ)、快速氧化型肌纤维(MyHCⅡa)、快速酵解型肌纤维(MyHCⅡb)和中间型肌纤维(MyHCⅡx),肌纤维类型决定了肌肉的运动能力和代谢类型,同时还与畜产品肉品质密切相关[3]。在猪中背最长肌是典型的快速酵解型肌肉(又称白肌),而腰大肌为典型的慢速氧化型肌肉(又称红肌)[4]。microRNA是近年来发现的一种长度约22nt的非编码RNA,主要在其靶基因的转录后水平发挥调控作用,近年来越来越多的microRNA被报道参与了骨骼肌的发育调控,如miR-1、miR-133、miR-206等[5]。miR-222在此前的研究报道中已被发现可以抑制骨骼肌细胞成肌细胞的分化[6-7]。但miR-222在猪骨骼肌中的表达及其是否调控猪不同骨骼肌肌纤维类型的发育还未见报道。因此本试验以藏猪(地方品种猪)和DLY猪(外种猪)的背最长肌(白肌)和腰大肌(红肌)为试验材料,分析miR-222在背最长肌和腰大肌的表达特性,以期为进一步研究miR-222对猪骨骼肌发育和肌肉品质的影响提供参考。
1 材料与方法
1.1 试验材料
雌性藏猪[体重:(54.60±5.5.56 )kg,样品取自甘孜藏族自治州畜牧业科学研究所农业养殖基地]和雌性DLY猪(样品取自成都市某屠宰场)各6头,分别取背最长肌(LDM)和腰大肌(PMM)。
1.2 试验方法
1.2.1 RNA提取
称取40~50 mg肌肉组织研磨样于1.5 ml离心管中,加入1 mL Trizol(Ambion) 充 分 裂 解 5 min, 随后按照说明书内容进行RNA提取。使用 Nanodrop2000核酸蛋白仪(Thermo Scientific)对RNA质量和浓度进行检测。
1.2.2 实时定量PCR检测
分 别 使 用microRNA和mRNA 反 转 试 剂 盒(TaKaRa)反 转cDNA,qRT-PCR采 用SYBR Premix Ex Taq kit(TaKaRa)试剂在CFX96 实时荧光定量PCR检测系统(Bio-Rad)下使用 2_ΔΔCt法进行检测[8],microRNA和mRNA分别使用U6和GAPDH作内参。相关引物序列见表1。
1.2.3 靶基因预测
miR-222靶基因预测使用TargetScan和miRDB软件,同时结合序列分析比对的方式进行预测。
1.3 统计与分析
所有数值采用平均数±标准差表示,使用SPSS 20.0软件进行单因素方差分析。
2 结果与分析
2.1 miR-222在藏猪和DLY猪背最长肌及腰大肌中的表达
由图1可知,miR-222在藏猪背最长肌中的表达量显著(P<0.05)高于腰大肌,miR-222在背最长肌的表达量是腰大肌的 1.40倍(图 1.A);miR-222在DLY猪背最长肌中的表达量显著(P<0.05)高于腰大肌,miR-222在背最长肌的表达量是腰大肌的 1.51 倍(图 1.B)。

图1 miR-222在藏猪和DLY猪背最长肌(LDM)和腰大肌(PMM)中的表达
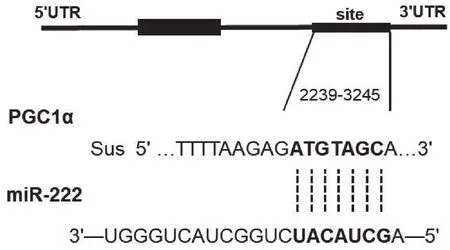
图2 miR-222与PGC1α结合序列图示

表1 引物序列及反应温度
2.2 miR-222靶基因PGC1α的序列分析
如图2所示,miR-222的种子序列与PGC1α的3’UTR区域2239-3245位序列互补配对。
2.3 PGC1α在藏猪和DLY猪背最长肌和腰大肌中的表达
PGC1α在藏猪背最长肌中的表达量显著(P<0.05)低于腰大肌,为腰 大 肌 的 45.4%( 图 3.A);PGC1α在DLY猪背最长肌中的表达量显著(P<0.05)低于腰大肌,为腰大肌的53.7%(图 3.B)。
2.4 miR-222与PGC1α表达量的相关性分析
进一步对所有样本miR-222和PGC1α的表达量进行线性相关性分析,如图4。得相关性方程为:Y=-5458.1X+2.5594(Y :PGC1α ;X :miR-222);R2=0.65;P< 0.05。
3 讨论
骨骼肌的发育受到相关转录因子的严格调控,microRNA参与转录后调控机制也影响着骨骼肌的发育。当前研究表明一些肌源性microRNA(miR-1、miR-133和 miR-206)和非肌源性 microRNA(miR-378、miR-499、miR-152等)均在骨骼肌发育过程中扮演着重要角色[9-10]。此前已有研究发现miR-222可促进成肌细胞增殖,同时抑制其成肌分化[11]。但目前还未见miR-222在猪骨骼肌发育的相关研究报道,本试验发现miR-222在成年猪骨骼肌中存在中等程度(U6表达量的0.2%~0.5%)的表达,提示可进一步对miR-222进行功能性研究。本试验发现在藏猪和DLY猪中背最长肌miR-222表达水平均高于相同猪种的腰大肌,背最长肌是典型的白肌,腰大肌是典型的红肌,miR-222在两个猪种中具有相同的表达模式,暗示miR-222可能参与了猪骨骼肌类型的转换和调控[12]。同时研究还发现DLY猪背最长肌和腰大肌中miR-222表达水平均低于藏猪,藏猪是典型的地方品种猪,生长速度和骨骼肌发达程度均不如DLY猪[13]。miR-222在骨骼肌更发达的DLY猪种中具有更低的表达模式也暗示了其可能参与骨骼肌发育调控,与此前在小鼠上的研究吻合[7,11]。
鉴于miR-222在两个猪种的腰大肌中表达更低,我们猜测miR-222可能参与了骨骼肌肌纤维类型和能量代谢的调控。而microRNA调控是一种经典的表观遗传调控,其功能的发挥必须依靠其靶基因执行。过氧化物酶体增殖激活受体γ辅助激活因子α(PGC1α)是一种转录辅助激活因子,在线粒体含量丰富和氧化代谢活跃的组织中高表达[14-15]。通过软件预测和序列比对我们发现PGC1α的3’UTR区域存在miR-222种子序列的结合位点,暗示PGC1α可能是miR-222的潜在靶基因。进一步我们检测了藏猪和DLY猪背最长肌和腰大肌PGC1α的表达,发现在藏猪和DLY猪背最长肌中PGC1α的表达量均低于相同猪种腰大肌,与miR-222表达模式相反,且与此前相关研究结果相似[16]。进一步对PGC1α和miR-222的表达量进行相关性分析,发现PGC1α与miR-222存在显著强负相关,进一步提示PGC1α和miR-222的靶标关系。
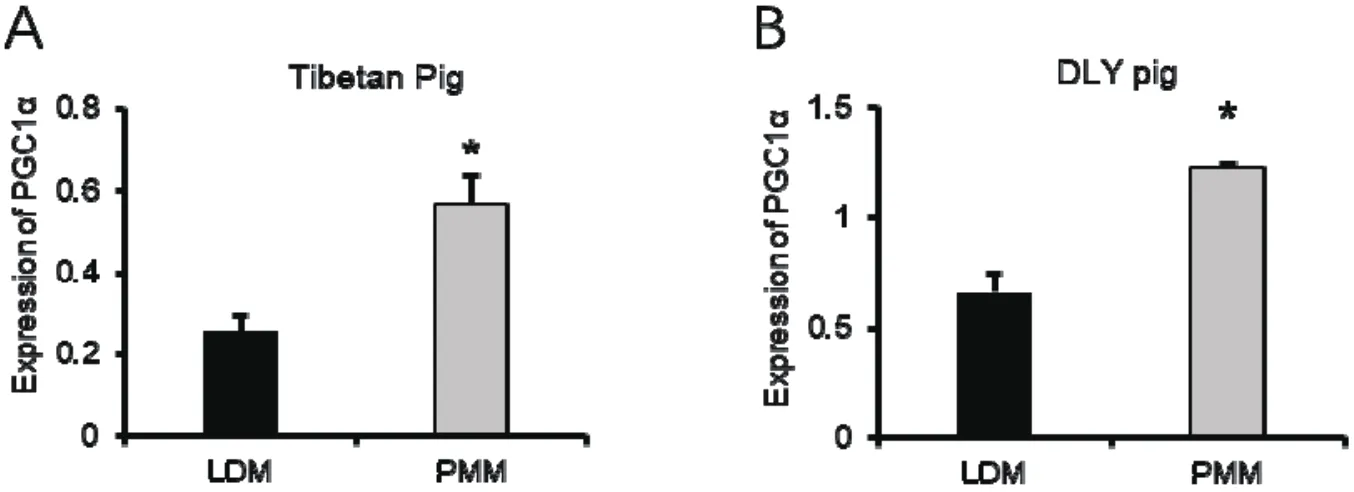
图3 PGC1α在藏猪和DLY猪背最长肌(LDM)和腰大肌(PMM)中的表达
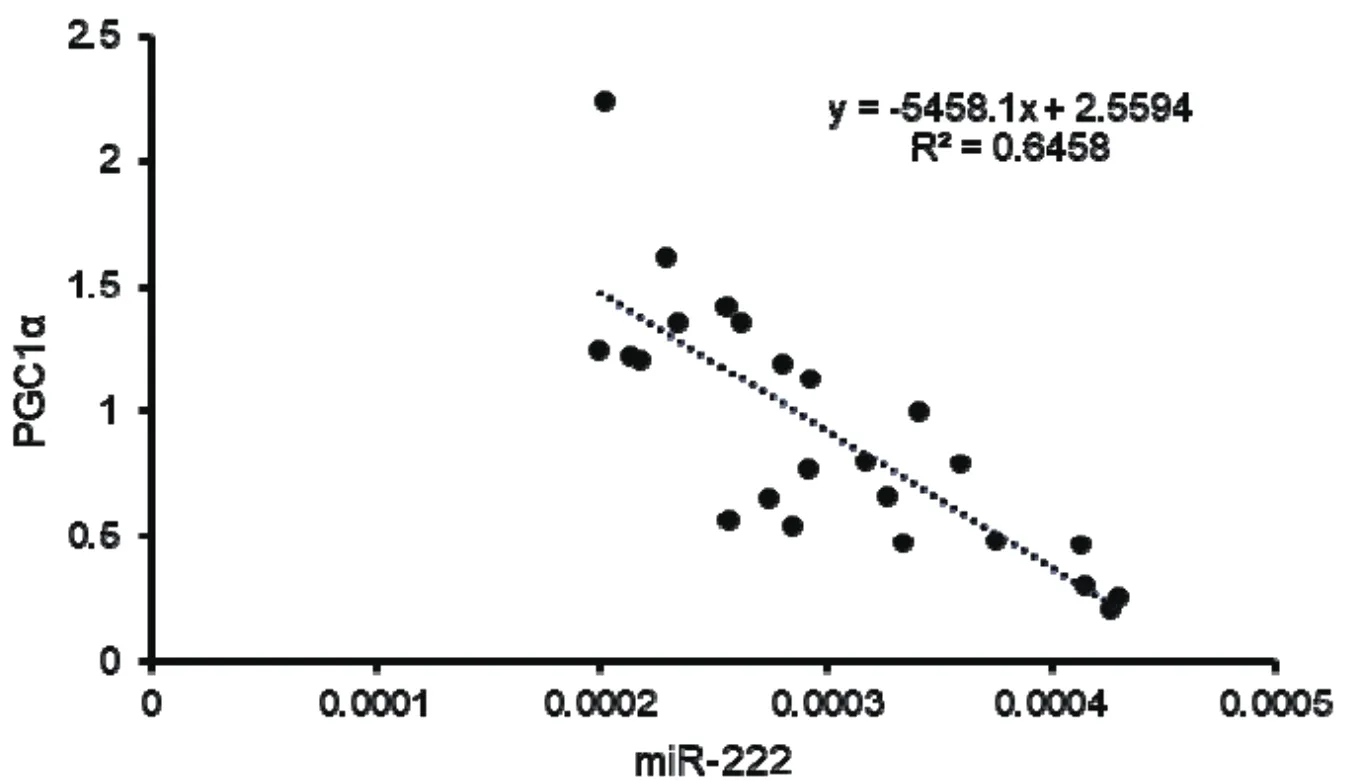
图4 miR-222与PGC1α表达量的相关性分析
4 结论
miR-222在藏猪和DLY猪的背最长肌中表达量高于腰大肌,其潜在靶基因PGC1α在藏猪和DLY猪的背最长肌中表达量则低于腰大肌。暗示miR-222可能通过PGC1α参与了猪不同骨骼肌肌纤维发育的调控,但其靶标关系还有待进一步验证。

