miniSTR基因座及其检测系统在降解检材中的法医学应用
王 鑫 ,陈维忠 ,张 健 ,李景辉 ,孙元鹏 ,石云杰 ,张 雷 ,陈林丽 ,周 翔 ,周如华
(1.苏州市公安局物证鉴定所,江苏 苏州 215131;2.无锡中德美联生物技术有限公司,江苏 无锡 214174)
20世纪90年代,短串联重复(short tandem repeat,STR)序列遗传标记开始应用于法医物证学的研究及鉴定[1]。STR基因座的复合扩增技术以灵敏、准确、快速、信息量大等优点被广泛应用于个体识别和亲子鉴定[2-3]。然而,在法医物证学鉴定过程中,现场生物检材的提取、保存及送检容易受到环境影响,导致DNA分子结构降解、DNA含量降低以及抑制剂浓度增高,从而影响DNA检验及分型[4-7]。如何对降解和微量的生物检材进行DNA检验已成为法医物证学检验的一大难点。使用常规的荧光标记STR试剂盒对降解和微量的生物检材检验,经常会出现长片段的STR基因座丢失或者检验失败。本研究拟采用miniSTR技术,即通过在STR基因座核心重复序列的侧翼序列设计引物,尽可能缩短复合扩增产物的片段,从而提高STR分型成功率[8-10]。
1 材料与方法
1.1 样本
652份实际案件样本(血迹112份,烟蒂135份,精斑30份,肋软骨10份,脱落细胞365份),均来源于苏州市公安局物证鉴定所;种属特异性测试样本——狗、猪、牛、羊、鼠、猫、兔和大肠杆菌购于市场[猪、牛、羊购于当地菜市场,鼠、兔血样采集于温州医科大学实验动物中心,狗、猫DNA采集宠物狗和宠物猫唾液样本,大肠杆菌菌种购买于生工生物工程(上海)股份有限公司]。
1.2 DNA提取和定量
DNA提取采用ReadyAmpTM基因组DNA提纯系统(genomic DNA purification system,美国 Promega公司)、磁珠DNA提取试剂盒(苏州新海生物科技股份有限公司)和AGCU高效硅珠DNA提取纯化试剂盒(无锡中德美联生物技术有限公司)提取,对使用磁珠和硅珠提取的DNA采用Qubit®3.0荧光定量仪(美国Life Technologies公司)进行定量。
1.3 复合PCR扩增体系的建立
1.3.1 STR基因座选择及miniSTR引物设计
本研究最终构成的复合扩增体系包含15个来自AmpFℓSTR®Identifiler®Plus PCR 扩增试剂盒(美国Thermo Fisher Scientific公司)的常染色体STR基因座,1个Y染色体基因座DYS391以及Amelogenin(表1)。使用Primer Premier 5.0和Oligo 7设计引物(表2),复合扩增体系中的各引物满足以下条件:引物碱基分布随机、Tm值相近、GC含量在40%~60%、引物自身及引物之间不应存在互补序列[11]。使用BLAST®(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对设计的引物进行比对分析。

表1 17个遗传标记的相关信息

表2 17个基因座的引物信息及浓度

续表2
1.3.2 PCR扩增条件
PCR反应体系包含:PCR扩增缓冲液Master Mix(无锡中德美联生物技术有限公司)10μL,六色mini引物 5μL,基因组 DNA 0.1~2.0ng,纯水补至 25μL。扩增使用9700型PCR仪(美国AB公司),根据试剂盒说明书推荐的循环条件:95℃ 5min;94℃ 15s,59℃ 50s,65℃ 30s,循环 29次;60℃ 7min。扩增产物于4℃保存。
1.3.3 电泳及STR分型
1 μL的PCR产物与0.5 μL内标(无锡中德美联生物技术有限公司,Marker SIZ-500,SIZ荧光标记)和10μL去离子甲酰胺(美国Thermo Fisher Scientific公司)混合,95℃变性3min后冰浴,电泳检测。使用3500xL基因分析仪(美国AB公司)以1.2kV 24s进行电泳分离,使用GeneMapper®ID-X 1.4软件(美国Thermo Fisher Scientific公司)进行结果分析。
1.3.4 等位基因分型标准物的制备
使用荧光标记引物扩增不同检材,收集17个基因座上不同等位基因的样本。使用非荧光标记引物对收集到的样本进行单基因座扩增,并使用分子克隆技术和碱裂解法制备17个基因座的不同等位基因质粒,以质粒为模板,使用每个基因座对应的荧光标记引物分别使用9700型PCR仪进行PCR扩增,并混合扩增产物,经组合调平,最终制成等位基因分型标准物。
1.4 扩增体系技术指标验证
1.4.1 分型一致、种属特异性及稳定性验证
652份案件样本按本研究方法进行扩增与分型检测,其中常染色体基因座分型结果与AmpFℓSTR®Identifiler®Plus PCR扩增试剂盒分型结果进行比较,DYS391分型结果与YfilerTMPlus PCR扩增试剂盒(美国Thermo Fisher Scientific公司)分型结果进行比较。
种属特异性验证分别采用狗、猪、牛、羊、鼠、猫、兔和大肠杆菌等生物检材,提取DNA后使用上述复合扩增体系进行PCR扩增检验,检测是否出现特异的DNA分型。
将试剂盒中的试剂PCR扩增缓冲液、六色mini引物、等位基因ladder和内标SIZ-500进行反复冻融和复合扩增检验,冻融次数分别为10、15、20次。
1.4.2 灵敏度、混合样本、抗抑制能力及扩增循环次数验证
灵敏度验证选用DNA标准品9948(美国Promega公司),根据浓度进行倍比稀释,取总模板量分别为500、250、125、50、30 pg 的DNA 标准品 9948 进行平行重复检测3次。
混合样本制备选用DNA标准品9947A(美国Promega公司)和9948,根据定量结果及浓度分别按19∶1、9∶1、5∶1、4∶1、2∶1、1∶1、1∶2、1∶4、1∶5、1∶9、1∶19 的比例混合,模板总量为1ng,平行重复检测3次。
抑制剂包括血红素(美国Thermo Fisher Scientific公司)、血红蛋白(美国Sigma-Aldrich公司)、靛蓝(上海阿拉丁生化科技股份有限公司)、腐殖酸(上海阿拉丁生化科技股份有限公司)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA,美国 Sigma-Aldrich 公司)与钙离子(美国Sigma-Aldrich公司)。在含有0.5 ng DNA标准品 9948的 25 μL体系中,加入终浓度为 75~150 μmol/L 血红素、20~50 μmol/L 血红蛋白、14~20 mmol/L 靛蓝、100~175 ng/μL 腐殖酸、800~1600μmol/L EDTA与1~2.5mmol/L钙离子作为抑制剂,进行PCR产物检测,考察试剂盒对不同浓度抑制剂的耐受能力。
根据《法庭科学人类荧光标记STR复合扩增检测试剂质量基本要求》(GA/T 815—2009)选用125pg的DNA标准品9948,按照上述复合扩增体系进行PCR扩增检验,扩增条件中循环次数分别选择26、28、29、30、32,并且平行重复检测 3 次。
1.4.3 stutter比例验证
对652份案件样本检测结果进行分析,统计六色荧光标记 miniSTR系统和AmpFℓSTR®Identifiler®Plus PCR扩增试剂盒每个基因座的stutter峰高比例,并计算标准差(standard deviation,SD)。
1.4.4 DNA提取方法与案件检材适应性验证
对652份样本外的60份血迹、64份烟蒂、30份精斑、10份肋软骨、80份接触性棉签擦拭子采用不同方法提取DNA并定量,进行扩增检测。
分别采用Chelex-100法、磁珠法、硅珠法提取样本DNA进行上述复合扩增检验,根据分型结果比较不同提取方法对分型结果的影响。
1.4.5 降解检材检验能力验证
取实验室陈旧降解血液样本1份(AmpFℓSTR®Identifiler®Plus PCR扩增试剂盒检测分型不完整)使用磁珠法提取DNA、DNaseⅠ(日本TaKaRa公司)处理标准品1份(1 ng标准品9948中加入0.1 U DNaseⅠ酶,15℃反应2 h),使用该六色荧光标记miniSTR系统进行检测。
2 结 果
2.1 分型一致、种属特异性及稳定性验证
652份实际案件样本的DNA提取产物,使用本次研究的六色荧光标记miniSTR系统、AmpFℓSTR®Identifiler®Plus PCR扩增试剂盒和YfilerTMPlus PCR扩增试剂盒进行平行检验,有效DNA检验STR分型结果一致。
对狗、猪、牛、羊、鼠、猫、兔和大肠杆菌等生物检材的DNA进行检测,在分型范围内,均没有出现特异的DNA分型。
对六色荧光标记miniSTR系统中的主要组分进行稳定性测试,试剂经过反复冻融和复合扩增检验,采用标准品9948检测,结果显示,STR分型完整,图谱分布均衡。反复冻融20次仍能获得完整的STR分型。
2.2 灵敏度、混合样本、抗抑制能力及扩增循环次数验证
取总模板量 500、250、125、50、30 pg 的 DNA 标准品9948,使用本研究的复合扩增试剂进行检验,扩增条件中的循环次数分别为29和30次循环,根据分型结果统计基因座的检出率。统计结果发现,总模板量为30pg的DNA标准品9948,循环29次,漏检4个基因座,循环30次,漏检2个基因座。而总模板量为50pg及以上的DNA标准品9948均能获得完整STR分型。因此,本研究的六色miniSTR的检测灵敏度为50pg DNA。
混合样本DNA检验结果显示,分型分布与两者在混合物中的浓度比例相关(图1)。混合物浓度比例相近(在5∶1和1∶5之间),两者的STR分型分布均衡,90%以上的次要基因座能够得到有效分型。随着混合物比例差异的增加,次要成分的STR分型分布出现下降,当混合物浓度比例达到19∶1和1∶19时,浓度低的样本STR基因座分布仅约53%。
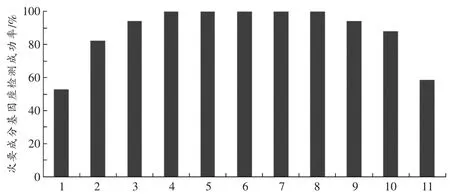
图1 标准品9947A与9948不同混合比例下的次要成分基因座平均检出率
当血红素浓度不大于125μmol/L,各基因座均可获得有效扩增;血红蛋白在40 μmol/L以内,对试剂盒扩增没有影响;靛蓝浓度在16 mmol/L以内,对试剂盒扩增没有影响;腐殖酸浓度不高于150 ng/μL时,各基因座均可获得有效扩增;EDTA浓度不高于1200μmol/L时,各基因座均可有效扩增;钙离子浓度不高于2mmol/L时,各基因座均可有效扩增。
125pg的DNA标准品9948的STR分型的荧光信号与扩增循环次数成正相关。当循环28次以上时,标准品9948的STR分型完整,分布均匀,产物扩增峰值随着扩增循环次数增加,位于500~30 000 RFU,但是循环32次的扩增信号过强,出现荧光渗透峰。当循环26次,标准品9948的STR分型结果出现部分基因座的丢失,因此,根据反复的复合扩增测试,推荐使用循环29次进行案件样本的检测。若样本浓度高于500pg可以相应减少循环数,反之亦然,但不要超过31个循环,避免加重PCR的随机扩增效应。
2.3 stutter峰高比例验证
采用六色荧光标记miniSTR系统及AmpFℓSTR®Identifiler®Plus PCR扩增试剂盒平行扩增652份案件样本,并对stutter峰高比例进行统计分析,两个试剂盒中每个基因座的stutter峰高比例平均百分比均在12%以下,且stutter峰高比例高或低的基因座,在两个试剂盒间不存在明显差异性(表3)。

表3 各基因座stutter峰高比例平均百分比 (n=652)
2.4 实际案件样本检测与检材适应性验证
本研究中的常规检材(血迹、烟蒂、精斑、肋软骨)检出率,采用六色荧光标记miniSTR系统和AmpFℓSTR®Identifiler®Plus PCR扩增试剂盒均为93.73%(269/287),脱落细胞的检出率采用六色荧光标记 miniSTR系统和 AmpFℓSTR®Identifiler®Plus PCR扩增试剂盒分别为26.03%(95/365)和25.75%(94/365)。选取另外60份血迹样本、64份烟蒂样本、30份精斑、10份肋软骨、80份接触性棉签擦拭子分别使用3种DNA提取方法(Chelex-100法、磁珠法、硅珠法)进行DNA提取及六色荧光标记miniSTR系统复合扩增检验,STR分型结果完整,峰值分布均衡。
2.5 降解检材检验能力验证
实验室陈旧降解血液样本和DNaseⅠ处理的标准品经六色荧光标记miniSTR系统检测,均获得完整分型。
3 讨 论
商业化STR试剂盒在扩增降解、含高抑制剂的样本时,大片段扩增效率会明显下降甚至丢失,缩短扩增片段长度可以提高降解检材和含高抑制剂检材的检出率。本研究的检测系统在靠近STR基因座核心重复区设计引物减小扩增子片段长度,将15个常染色体STR基因座、1个Amelogenin基因座和1个DYS391基因座合理排布于300bp(包含了FGA国外人群稀有等位基因42.2~50.2,最长的50.2可达307.8bp以内。引物设计时,避免由于引物3′端序列同源性较高而导致错误。同时考虑引物在不同检材扩增的适用性,保证不同检材扩增时,扩增效率都要满足试剂盒均衡性要求。通过对陈旧降解样本和DNaseⅠ处理标准品检测,六色荧光标记的16个miniSTR可以有效获得完整分型,适用于降解样本检测。与AmpFℓSTR®miniFilerTMPCR扩增试剂盒(美国AB公司)不同,本检测系统的miniSTR基因座包含AmpFℓSTR®Identifiler®Plus PCR扩增试剂盒全部的基因座,与数据库兼容性高,且扩增子小于300bp。另外,在检测系统中新增DYS391基因座,可以在Y等位基因缺失的情况下辅助提供性别信息。针对PCR扩增的抑制剂,筛选高性能的PCR缓冲系统,优化热循环参数,显著提高了体系扩增性能。本研究采用新型的能量转移染料、优化的PCR缓冲体系、以miniSTR理念设计的更小的扩增子,改善了在降解、微量样本中容易出现大片段丢失的情况。同时,合理的位点排布也避免了类似的miniSTR检测系统(如AmpFℓSTR®miniFilerTMPCR扩增试剂盒)仅作为补充试剂盒的作用,本系统可以应用于案件现场样本检测和建库样本检测。经过性能评价实验,六色荧光标记的16个miniSTR试剂盒具有较高的检测灵敏度、抗抑制剂能力强、特异性好、扩增系统试剂组分稳定,适用于混合样本等特殊检材的DNA检验分型。对实际案件样本的检出率达到甚至超过 AmpFℓSTR®Identifiler®Plus PCR扩增试剂盒的水平,可用于实际案件检验,为法庭科学DNA分析提供一种新方法。

