白三烯受体拮抗剂对自身免疫性神经炎大鼠IL-17表达的影响
谷明明,金 善
格林-巴利综合征 (Guillain-Barne syndrome,GBS)是严重影响人类身体健康的一种常见的自身免疫性疾病,是自身免疫性神经肌肉麻痹的主要原因[1]。到目前为止,GBS的治疗主要以对症支持治疗和免疫治疗为主。免疫治疗为血浆置换或静脉注射丙种球蛋白[2],现已证实,血浆置换疗法(PE)和静脉注射大剂量免疫球蛋白对GBS有效,但血浆置换疗法对该病的预后并没有明显帮助,仍有3%~10%的患者死亡,高达20%的患者没有完全恢复健康,伴有不同程度的后遗症,常出现过敏反应、继发性心脑血管疾病等[3]。另外,由于该疗法治疗费用较高,大部分患者难以接受。根据白三烯受体拮抗剂(CysLTs受体拮抗剂)对免疫系统的体内外作用研究推测,CysLTs受体拮抗剂可以影响细胞免疫反应,有望成为自身免疫性疾病治疗的新方法[4]。该研究应用CysLTs受体拮抗剂(普鲁司特)分别干预免疫期间、发病阶段的实验性自身免疫性神经炎(experimental autoimmune neuritis,EAN)模型大鼠,观察普鲁司特对模型大鼠的临床评分、病理变化以及免疫指标的影响,评价CysLTs受体拮抗剂对EAN模型大鼠的作用,从而进一步探讨其可能的免疫机制,为自身免疫性疾病的治疗寻找一种质优价廉、安全、有效的治疗方法。
1 材料与方法
1.1 实验动物SPF级Lewis大鼠40只,雌性,7~8周龄,体质量150~170 g(实验动物许可证编号为SCXK(京)2012-0001)。
1.2 仪器与试药P0180-199(SSKRGRQTPVLYAMLDHSRS)多肽购自安徽瀚海博兴生物技术有限公司;不完全弗氏佐剂(Incomplete Freund's Adjuvant,IFA)购自美国Sigma公司;结核杆菌(H37Ra)购自美国Difco公司;Trizol、反转录试剂盒与Taq DNA酶(美国Fermenats公司);引物(上海生工技术有限公司);大鼠抗兔一抗免疫组化试剂盒购自英国Abd Serotec Co.Oxford公司。抗大鼠二抗PV-6002试剂盒购自北京中杉金桥。普鲁司特、甲泼尼龙琥珀酸钠。AE200电子分析天平(梅特勒-托利多仪器上海有限公司);匀浆机 (中国上海医疗器械厂);Thermo ELECTRON CORPORATION离心机 (型号:HEAREUS FRESCO 17 Centrifuge); 生物组织摊片烤片机(CS-Ⅲ 湖北省医用电子仪器厂制造);病理图像分析(CX41-32rfl OLYMPUS);日本电子JEM-1200EX透射电镜;美国GATAN CCD图像处理系统;PCR 扩增仪(ABI 7300);7300 System SDS Software。
1.3方 法
1.3.1 EAN模型的建立 Lewis大鼠经适应性饲养(SPF级)1 W后,随机分为4组:普鲁司特A组、普鲁司特B组、甲泼尼龙琥珀酸钠组以及正常对照组,每组各10只Lewis大鼠。10%水合氯醛(300 mg/kg) 腹腔注射麻醉。 将 200 μgP0180-199、1 mg 结核杆菌、100 μl生理盐水和100 μl不完全弗氏佐剂混合液充分乳化,作为1只大鼠的注射用量,注入大鼠双侧后肢足垫皮下(每只足底100 μl)。普鲁司特A组:于免疫前第1天,到免疫后第8天,每日给予普鲁司特3 mg/kg皮下注射;普鲁司特B组:于免疫后第5天,到免疫后第16天,每日给予普鲁司特3 mg/kg皮下注射;甲泼尼龙琥珀酸钠组:于免疫前第1天,到免疫后第8天,每日给予甲泼尼龙琥珀酸钠1 mg/kg,皮下注射;空白对照组:取相同体积的生理盐水每日皮下注射。免疫当天记为0天,于免疫前1天及免疫后每日进行临床评分,直至免疫后第16天。
1.3.2 临床评分 每天记录大鼠体重、临床行为学评分。评分标准:正常:0分;尾巴拖地或尾尖上翘:1分;翻正反射受损:2分;中度瘫痪:3分;重度瘫痪:4分;四肢瘫痪或死亡:5分[5]。症状介于中间时评分值±0.5分。
1.3.3 组织病理学检查 于EAN大鼠疾病高峰期(免疫后第16天)处死大鼠,取其坐骨神经近脊髓段并固定于10%中性福尔马林中,石蜡包埋,4 μm纵行切片。HE染色,观察大鼠坐骨神经中浸润的炎性细胞。
1.3.4 免疫组化检查IL-17阳性细胞表达 免疫后第16天从大鼠坐骨神经根部取约1 cm长神经做免疫组化。石蜡切片,常规脱蜡至水,经抗原修复、阻断内源性过氧化物酶活性,滴加一抗(兔抗大鼠和二抗(辣根酶标记羊抗兔IgG多聚体),DAB显色,苏木素复染,脱水,透明,封片。观察大鼠坐骨神经中细胞阳性表达,结果以细胞数/mm2组织表示。
1.3.5 RT-PCR法检测脾脏、淋巴结、坐骨神经中IL-17mRNA的表达 免疫后第16天处死大鼠,取脾脏、淋巴结和坐骨神经,分成约100 mg小块置EP管中,编号置液氮中保存。RT-PCR检测IL-17 mRNA的表达:引物序列见表1。按试剂说明书要求抽提总RNA并测定其浓度。RT反应按Tirozl试剂盒说明书提取RNA,按反转录试剂盒说明书将RNA反转录成cD NA。PCR扩增:(1)反应体系及条件:①IL-1 与 β-actin:10 mmol/L dNTP 1 μl,25 mmol/L MgCl22.5 μl,10×Taq Buffer with(NH4)2SO42.5 μl,50 μmol/L IL-17 上、下游引物各 0.75 μl,1 U/μl Taq 酶 1.25 μl,cDNA 3 μl,去离子双蒸水 13.25 μl,总体积25 μl。反应参数为94℃预变性5 min,94℃变性30 s,62℃退火30 s,72℃延伸 45 s, 共 40循环,72℃终末延伸 10 min。将 PCR扩增产物在7300 System SDS Software扫描分析,检测脾脏、淋巴结、坐骨神经中IL-17mRNA的表达。

表 1 引物序列
1.4 统计学处理运用SPSS 19.0软件进行数据处理,计量资料以(±s)表示,在符合正态分布及方差齐同的条件下,四组间均数以单因素方差分析进行比较,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠临床瘫痪评分与空白对照组相比,普鲁司特A组、普鲁司特B组发病时间明显延迟,高峰期评分明显降低(P<0.05);普鲁司特A组较普鲁司特B组发病时间晚,高峰期评分低(P<0.05)。甲泼尼龙琥珀酸钠组与对照组瘫痪评分比较,差异无统计学意义。见表2。
表 2 各组大鼠临床瘫痪评分比较(±s)

表 2 各组大鼠临床瘫痪评分比较(±s)
注:与空白对照组比较,*P<0.05;与普鲁司特B组比较,#P<0.05。
分组 n 发病时间(d) 高峰期评分(分)普鲁司特A组 10 12.01±0.37*# 1.18±0.11*#普鲁司特B组 10 10.56±0.77* 1.62±0.32*甲泼尼龙琥珀酸钠组 10 8.38±1.02 2.39±0.40空白对照组 10 8.36±1.03 2.41±0.41
2.2 大鼠坐骨神经炎性细胞比较与空白对照组相比,普鲁司特A组、普鲁司特B组炎性细胞浸润数目显著减少(P<0.05);普鲁司特A组较普鲁司特B组炎性细胞浸润数目明显减少(P<0.05)。甲泼尼龙琥珀酸钠组与对照组比较,差异无统计学意义。见表 3,图 1。
表 3 大鼠坐骨神经炎性细胞比较(±s)

表 3 大鼠坐骨神经炎性细胞比较(±s)
注:与空白对照组比较,*P<0.05;与普鲁司特B组比较,#P<0.05。
组别 n 炎性细胞浸润数目(个/mm2)普鲁司特 A 组 10 36.80±3.66*#普鲁司特B组 10 52.36±10.11*甲泼尼龙琥珀酸钠组 10 122.02±35.05空白对照组 10 129.02±34.05
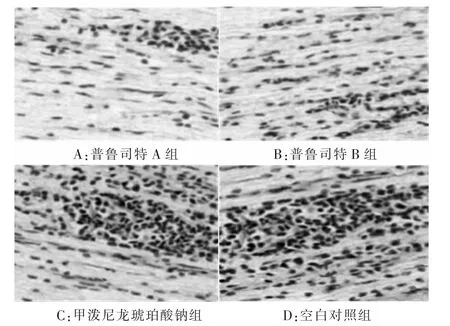
图 1 大鼠坐骨神经炎性细胞浸润(HE,×400)
2.3 坐骨神经IL-17阳性细胞表达比较与空白对照组相比,普鲁司特A组、普鲁司特B组IL-17阳性细胞表达显著降低(P<0.05);普鲁司特A组较普鲁司特B组IL-17阳性细胞数目亦降低明显(P<0.05)。甲泼尼龙琥珀酸钠组与对照组比较,差异无统计学意义。见表4,图2。
表 4 坐骨神经IL-17阳性细胞表达比较(±s)

表 4 坐骨神经IL-17阳性细胞表达比较(±s)
注:与空白对照组比较,*P<0.05;与普鲁司特 B 组比较,#P<0.05。
组别 n IL-17阳性细胞数目(个/mm2)普鲁司特 A 组 10 19.88±8.02*#普鲁司特B组 10 36.97±10.98*甲泼尼龙琥珀酸钠组 10 85.22±17.55空白对照组 10 87.02±16.45

图 2 大鼠坐骨神经IL-17阳性细胞表达(DAB,×400)
2.4 IL-17mRNA在脾脏、淋巴结、坐骨神经中的表达比较与空白对照组相比,普鲁司特A组、普鲁司特B组IL-17mRNA在脾脏、淋巴结、坐骨神经中的表达显著降低(P<0.05);普鲁司特A组较普鲁司特B组IL-17mRNA在脾脏、淋巴结、坐骨神经中的表达亦降低明显(P<0.05)。甲泼尼龙琥珀酸钠组与对照组比较,差异无统计学意义。见表5,图3。
表 5 IL-17mRNA在各组脾脏、淋巴结、坐骨神经中的表达(±s)
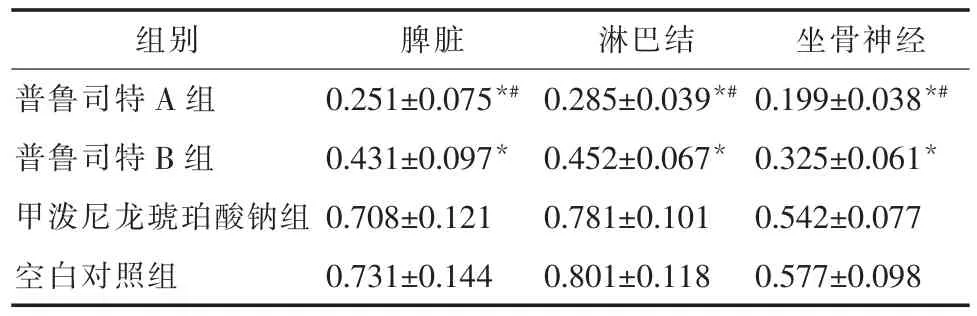
表 5 IL-17mRNA在各组脾脏、淋巴结、坐骨神经中的表达(±s)
注:与空白对照组比较,*P<0.05;与普鲁司特 B 组比较,#P<0.05。
组别 脾脏 淋巴结 坐骨神经普鲁司特 A 组 0.251±0.075*# 0.285±0.039*# 0.199±0.038*#普鲁司特 B 组 0.431±0.097* 0.452±0.067* 0.325±0.061*甲泼尼龙琥珀酸钠组 0.708±0.121 0.781±0.101 0.542±0.077空白对照组 0.731±0.144 0.801±0.118 0.577±0.098
图 3 IL-17mRNA在大鼠脾脏、淋巴结和坐骨神经中的表达
3 讨论
我国每10万人中就有4~15人罹患格林-巴利综合征(GBS)[6],每个年龄段都可发病,其中以学龄前及学龄期儿童居多。格林-巴利综合征具有独特的临床及病理特征,虽然病因目前仍未明确,但其发病机制可能涉及体液免疫与细胞介导免疫反应,病理特点为周围神经、神经根的节段性髓鞘脱失和外周神经的小血管周围淋巴细胞以及巨噬细胞的炎性反应。格林-巴利综合征通常由感染诱发,约2/3的患者发病前有胃肠道或呼吸道感染史[7],遗传和环境因素及个人的敏感性亦参与了疾病的发生。
Adams与Waksaman用完全弗氏佐剂(CFA)的混合液,对啮齿类动物进行免疫,从而获得了EAN的动物模型,EAN无论从神经电生理还是临床病理都与格林-巴利综合征有着惊人的相似,是自身免疫性T细胞和巨噬细胞及相关细胞因子介导的周围神经脱髓鞘病变。GBS患病大鼠是研究GBS的经典动物模型[8,9]。 该研究使用 P0180-199诱导 Lewis 雌性大鼠成功造模,采用六级评分法作为评分标准[10]。大鼠免疫第1天开始出现不同程度的临床症状,包括皮毛不洁、精神萎靡、双后足红肿、体重下降等表现,与GBS发病前的病毒感染前驱症状相似,考虑与免疫原引起全身免疫反应有关;免疫第7天时大鼠均出现尾巴拖地行为,行为学评分1分,提示造模成功。
EAN的发病机制是针对神经髓鞘或轴索中组织成分的自身免疫反应,T细胞、单核-巨噬细胞共同参与了该过程,细胞因子、趋化因子、基质金属蛋白酶也是疾病效应阶段的关键参与因素。活化的巨噬细胞通过直接吞噬作用或分泌炎性介质引起髓鞘脱失,而自身免疫性抗体可通过细胞毒性、激活补体或生物电阻断作用使上述炎性反应进一步加剧[11]。一直以来Th1细胞被认为是EAN的主要致病细胞,但近期研究发现表型特征独特和分泌IL-17的Th17细胞亚群逐渐为人所认识。曾认为以Th1细胞反应为主的自身免疫性疾病如多发性硬化、类风湿性关节炎等,现在发现是Th17或Th17/Th1细胞反应类型。IL-17是Th17细胞分泌的关键性因子之一,具有强促炎症作用,可诱导上皮细胞、内皮细胞或成纤维细胞的分泌,从而产生许多炎症介质,如 GM-CSF、IL-6和 PGE2等。同时,IL-17对TNF-α可产生协同作用,促进一系列黏附分子的表达,增强T细胞的活化,与多种自身免疫性疾病的发生和发展有关[12]。CysLTs受体拮抗剂,因其抑制分泌IL-17,并且抑制淋巴细胞增殖,所以对哮喘模型动物的临床症状起到缓解作用[13]。笔者认为,CysLTs受体拮抗剂可以影响细胞免疫反应,有望成为自身免疫性疾病治疗的新方法。
该研究应用CysLTs受体拮抗剂普鲁司特分别干预免疫阶段、发病阶段的EAN大鼠,观察普鲁司特对模型大鼠的病理变化,结果发现:普鲁司特可减轻EAN病情,减少坐骨神经中炎性细胞浸润,降低坐骨神经促炎性因子的表达,降低IL-17mRNA的表达。
综上所述,CysLTs受体拮抗剂-普鲁斯特应用于免疫性神经炎的经典动物模型,可以明显减轻动物模型的免疫神经炎的症状,提示普鲁司特对EAN有一定治疗作用,且价格易于接受,没有其他不良反应,有希望应用于自身免疫性疾病的治疗。

