胃癌患者手术前后T淋巴细胞亚群的变化及预后分析
党海珍,焦顺昌,吴亮亮,姜忠华
T淋巴细胞亚群是机体免疫监视的一道重要防线,无须预先抗原激活就具备对某些肿瘤细胞的杀伤作用。T细胞是种类繁多、功能复杂的一类免疫细胞。T细胞的调节和活化机制十分复杂,是保持免疫状态、控制肿瘤生长和转移的重要一环。此外,巨噬细胞和T淋巴细胞均可分泌释放TNF,后者是局部免疫的重要组成部分,对抗肿瘤生长和扩散起重要作用。虽然诸多证据表明,机体免疫功能的低下可促使肿瘤发生转移,但也有相反的实验证据存在。在一些实验中有人通过抑制机体免疫,发现无论对原发瘤或转移扩散均有促发效应,有可能与免疫逃逸或免疫耐受机制有关。
有研究发现淋巴细胞亚群的分布与年龄、性别、种族等因素相关[1]。对不同年龄、性别的健康成年人21项淋巴细胞亚群之间的差异进行分析,结果显示, 性别对 CD3-CD16+,CD56+、CD8+CD28+的影响具有统计学意义[2],年龄对 CD3+、CD3+CD8+、CD3-CD16+,CD56+、CD8+CD28+、CD4+CD25+的影响具有统计学意义。笔者通过检测胃癌患者手术前后T淋巴细胞亚群的变化,并与健康人群相对照,分析其与临床病理特征及术后无病生存期(DFS)的关系,探讨胃癌患者手术前后T淋巴细胞亚群在外周血的表达对预后的影响,为建立胃癌术后辅助化疗的个体化模式提供理论依据。
1 资料与方法
1.1 病例资料2010年1月—2011年6月在解放军总医院行手术治疗Ⅰ~Ⅲ期的胃癌病例41例;男34 例,女 7 例;年龄 40~81 岁,平均(59.32±11.41)岁。健康对照组41例,为中国人民解放军总医院2009年10月—2010年01月健康体检的职工;其中男26名,女15名;年龄21~86岁,平均 (43.64±22.08)岁;健康体检者常规体检指标正常,均无肿瘤家族史。
1.2 研究内容将所有病例临床特征如性别、年龄、症状、饮酒史、脉管癌栓、肿瘤大体形态、肿瘤分化、Lauren分型、T分期、N分期、TNM分期列为观察指标,录入Excel表,并对收集病例进行随访,每半年1次统计随访资料,并计算DFS。
1.3 试验方法患者手术当天、术后第10天清晨空腹抽取3 ml静脉血于EDTA-K3抗凝管中,健康体检者清晨空腹抽取3 ml静脉血于EDTA-K3抗凝管中,立即送检。标注清楚样品信息(姓名、性别、年龄、ID号、细胞类型、时间等),样品在送检后进行处理,经细胞计数后,调整细胞的浓度至5×105/ml,最后用1×PBS重悬细胞,用300目的滤网过滤黏连细胞;加入检测抗体及同型对照抗体,分为两种检测组合抗体, 分别为:CD4-FITC、CD8-PE、CD3-PC5;CD16-FITC、CD56-PE、CD3-PC5,加入检测抗体后,分别在另外的试管中加入相应的同型对照抗体 (检测抗体和同型对照抗体的量按照抗体说明书),手持试管轻轻摇匀,室温(16~22 ℃),避光放置20~30 min。 依次向各试管中加入 1 ml 1×PBS,1200R,10 min,弃上清。 加入 500 μl 1×PBS 漩涡震荡5~10 s,待上机检测。试剂:同型对照抗体及测定抗体均为贝克曼库尔特公司;仪器:流式细胞仪等。
1.4 检测及结果分析荧光校准微球:Flow-Check TM Fluorospheres校正仪器,HPCV值<3%确保机器状态良好;在流式细胞仪MXP分析软件上打开淋巴细胞亚群,检测方案严格按试剂盒要求进行:实验完成后检验样品中 CD3+CD4+、CD3+CD8+、CD3+CD16+CD56+(NKT)、CD3 -CD16+CD56+(NK),统计各亚群百分比数。
1.5 统计学处理应用SPSS 17.0软件包,对两个或多个变量元素选用χ2检验,应用Kaplan-Meier生存分析,对某一变量的分析选择Log-rank检验,多因素指数体系选择COX回归,无病生存期以(±s)表示,P<0.05为差异具有统计学意义。
2 结果
2.1 患者临床及病理特点外科手术方式包括腹腔镜辅助胃癌根治术备全胃切除术32例(78.05%),胃癌根治+化疗泵置入术9例(21.95%);病理类型包括低分化腺癌12例(29.27%),中分化腺癌6例(14.63%),高分化腺癌 12 例(29.27%),印戒细胞癌3例(7.32%),黏液腺癌 5例(12.20%),管状腺癌 1例(2.44%),乳头状腺癌 1例(2.44%),低分化癌肉瘤 1例 (2.44%);分化程度包括低分化 13例(31.71%), 中分化 6例 (14.63%), 高分化 12例(29.27%),以及印戒细胞癌及黏液腺癌等未能判断分化程度者10例(24.39%)。
T分期包括T1a期3例 (7.32%),T1b期 2例(4.88%),T2期 2例(4.88%),T3期 7例(17.07%),T4a期 13例(31.71%),T4b期 14例(34.15%);N 分期包括N0期13例(31.71%),N1期7例(17.07%),N2期 7例(17.07%),N3a期 6例(14.63%),N3b期8例(19.51%);临床分期ⅠA 期 5例(12.20%),ⅡA期 1例(2.44%),ⅡB 期 3例(7.32%),ⅢA 期 7例(17.1%), ⅢB期 14例 (34.15%), ⅢC期 11例(26.83%)。
2.2 临床病理与预后相关性对41例胃癌术后患者进行临床病理特点与预后(DFS)相关的单因素分析,年龄、症状、TNM分期、手术切缘与DFS相关。年龄<60岁与≥60岁患者中位DFS分别为18和15个月,DFS生存率分别为81.82%与68.18%,差异具有统计学意义(P<0.01);确诊时有症状和无症状者中位DFS分别为17个月和22个月,DFS生存率分别为77.27%与100%(P<0.05);TNM分期Ⅰ期/Ⅱ期、Ⅲ期中位DFS分别22和16个月,DFS生存率分别为100%与72.73%(P<0.01);患者手术切缘阴性与阳性中位DFS为17和5个月,DFS生存率分别为77.27%与12.20%(P<0.05)。其他如性别、饮酒史、Lauren分型、脉管癌栓、癌细胞分化、合并慢性病、大体形态、术式、混合病理类型、放疗等因素对DFS的影响均无显著性差异(P>0.05)。见表1。
2.3 手术前后外周血T淋巴细胞亚群的变化外周血T细胞CD3+、CD3+CD4+、CD4+/CD8+的表达,胃癌术前组分别与健康对照组、胃癌术后组相比明显降低, 差异具有统计学意义 (P<0.05,P<0.01);CD3+CD8+的表达,胃癌术前组分别与健康对照组、胃癌术后组比较增高,差异具有统计学意义 (P<0.05,P<0.01);CD8+CD28+的表达,胃癌术前组与健康对照组比较降低,差异具有统计学意义(P<0.05);CD4+CD25+的表达,胃癌术前组、术后组分别与健康对照组比较明显升高,差异具有统计学意义(P<0.01)。结果见表2。
2.4 T淋巴细胞亚群各项指标表达对预后影响的分析笔者以健康对照组数据为标准,对T淋巴细胞亚群各项指标与预后(DFS)进行单因素分析,仅胃癌患者术后第10天外周血CD3+CD4+的表达与DFS相关。如表3所示,术后第10天CD3+CD4+低表达与高表达中位DFS分别为16个月和18个月(图1), 差异有统计学意义 (P<0.05); 术前CD3+CD4+低表达与高表达中位DFS分别为16个月和22个月,但差异无统计学意义(P>0.05)。其余各项指标与DFS的差别均无统计学意义(P>0.05)。
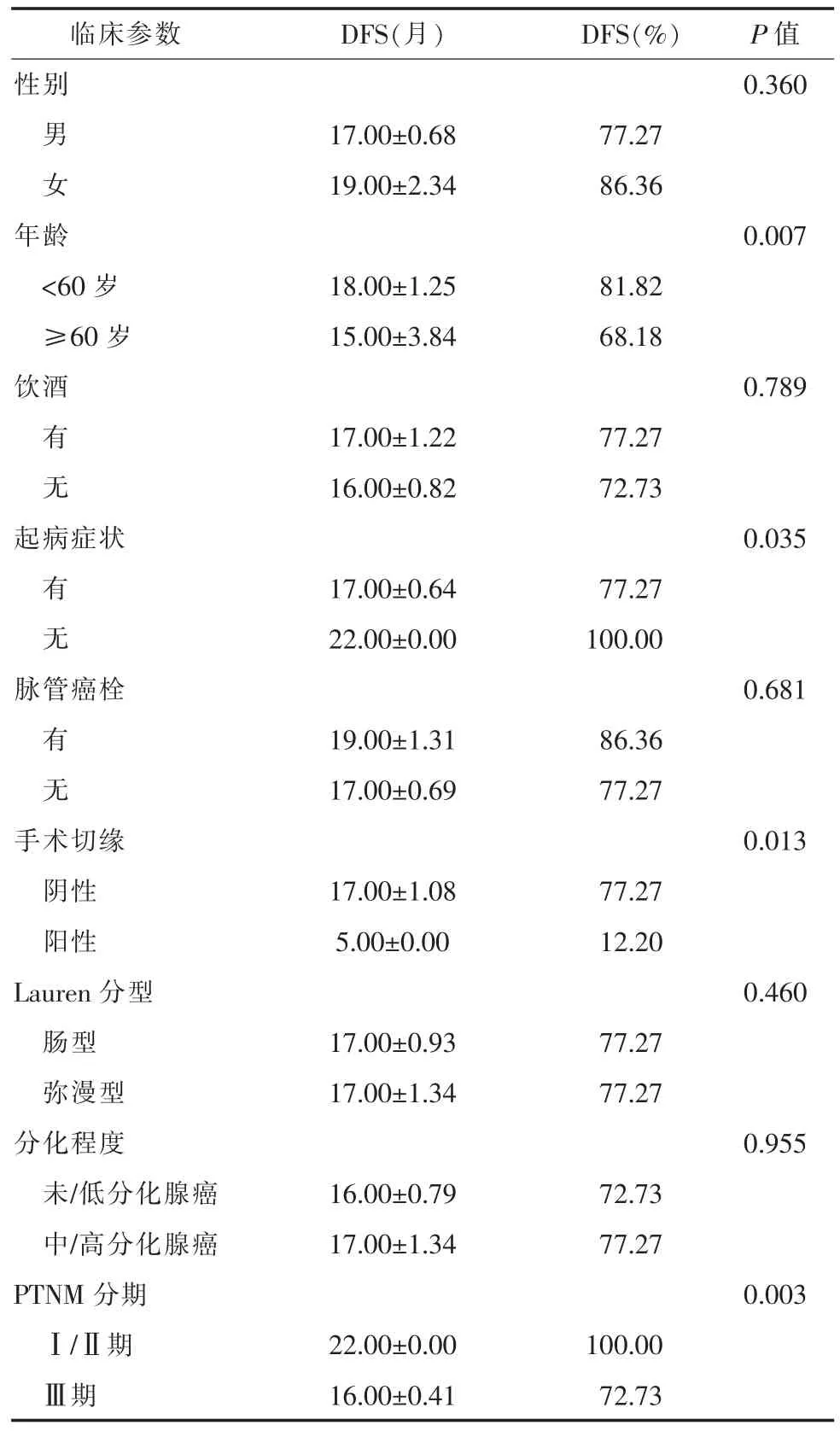
表 1 41例胃癌术后患者临床病理特点与DFS的单因素分析
2.5 T淋巴细胞亚群对DFS影响的COX生存分析选择胃癌患者手术前后CD3+、CD3+CD4+、CD3+CD8+、CD4+/CD8+、CD8+CD28+、CD8+CD28-、CD4+CD25+、CD3-CD16+,CD56+、CD3+CD16+,CD56+等因素进行COX回归分析。结果显示,在该组病例中,胃癌患者术后CD3+、CD3+CD8+和CD3-CD16+,CD56+的表达是DFS的独立预后因素。如表4所示,胃癌患者术后外周血CD3+、CD3-CD16+,CD56+低表达较高表达,CD3+CD8+高表达较低表达,疾病复发转移风险分别为0.273、2.595、5.394倍。见表4。
表 2 胃癌患者手术前后外周血T淋巴细胞亚群的表达(±s,%)

表 2 胃癌患者手术前后外周血T淋巴细胞亚群的表达(±s,%)
注:胃癌术前组与健康对照组比较,*P<0.05,**P<0.01;胃癌术后组与健康对照组比较,▲P<0.05,▲▲P<0.01;胃癌术后组与术前组比较,△P<0.05,△△P<0.01。
组别 CD3+ CD3+CD4+ CD3+CD8+ CD4+/CD8+ CD8+CD28+ CD8+CD28- CD4+CD25+ CD3-CD16+56+健康对照组 69.11±9.25 39.10±7.12 25.69±7.84 1.72±0.74 16.35±5.20 14.50±6.66 7.47±2.98 12.41±7.93胃癌术前组 64.32±10.12* 33.29±7.56** 29.12±7.46* 1.26±0.51** 13.75±5.29* 17.19±7.53 9.32±3.02** 10.15±7.92胃癌术后组 68.22±7.57△ 37.59±9.56△ 25.26±6.05△△ 1.62±0.72△△ 15.12±4.52 16.16±7.09 9.69±3.58▲▲ 12.82±6.00
表 3 T淋巴细胞亚群各项指标表达与DFS的关系(±s)
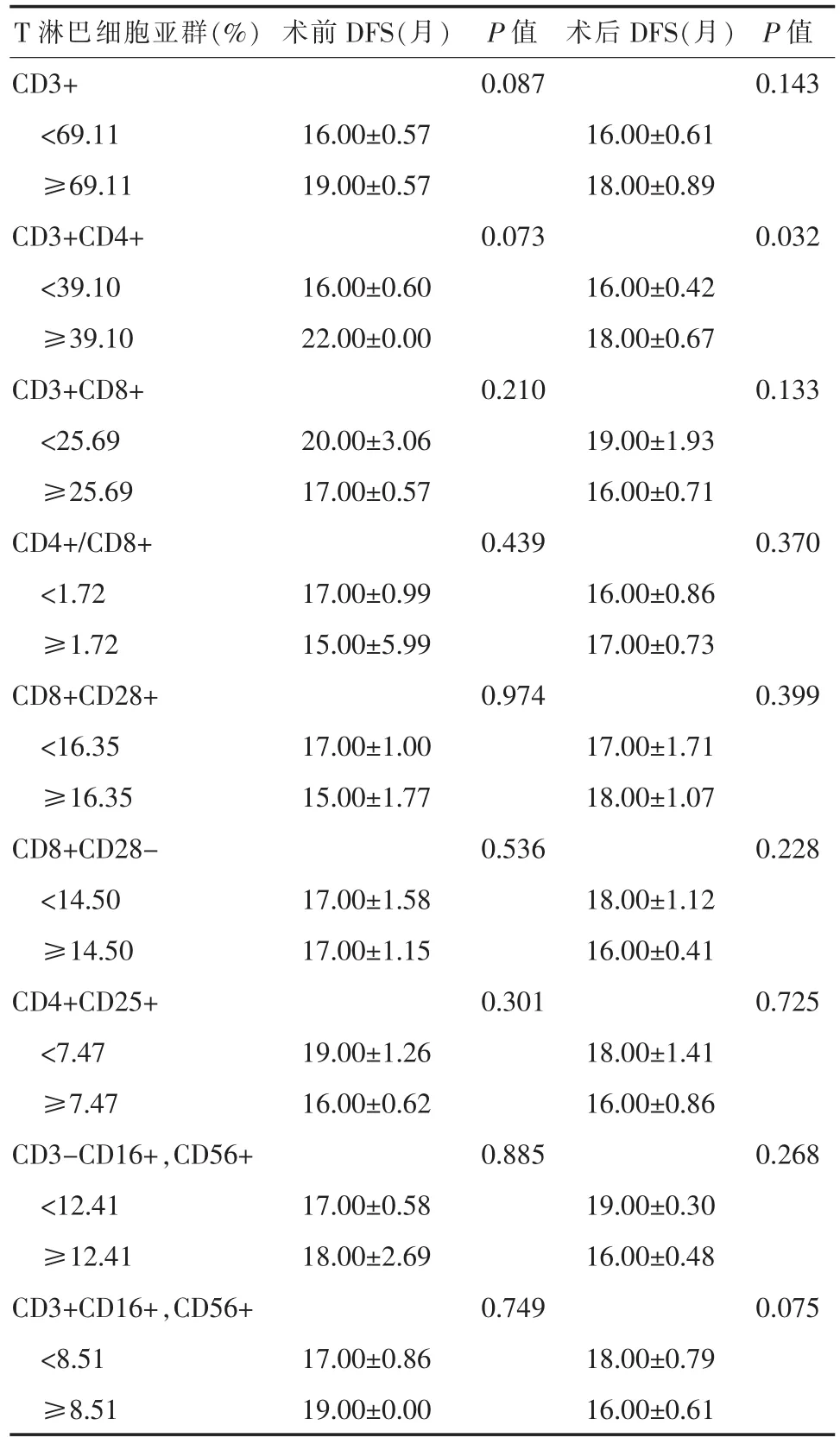
表 3 T淋巴细胞亚群各项指标表达与DFS的关系(±s)
T淋巴细胞亚群(%) 术前DFS(月) P值 术后DFS(月) P值CD3+ 0.087 0.143<69.11 16.00±0.57 16.00±0.61≥69.11 19.00±0.57 18.00±0.89 CD3+CD4+ 0.073 0.032<39.10 16.00±0.60 16.00±0.42≥39.10 22.00±0.00 18.00±0.67 CD3+CD8+ 0.210 0.133<25.69 20.00±3.06 19.00±1.93≥25.69 17.00±0.57 16.00±0.71 CD4+/CD8+ 0.439 0.370<1.72 17.00±0.99 16.00±0.86≥1.72 15.00±5.99 17.00±0.73 CD8+CD28+ 0.974 0.399<16.35 17.00±1.00 17.00±1.71≥16.35 15.00±1.77 18.00±1.07 CD8+CD28- 0.536 0.228<14.50 17.00±1.58 18.00±1.12≥14.50 17.00±1.15 16.00±0.41 CD4+CD25+ 0.301 0.725<7.47 19.00±1.26 18.00±1.41≥7.47 16.00±0.62 16.00±0.86 CD3-CD16+,CD56+ 0.885 0.268<12.41 17.00±0.58 19.00±0.30≥12.41 18.00±2.69 16.00±0.48 CD3+CD16+,CD56+ 0.749 0.075<8.51 17.00±0.86 18.00±0.79≥8.51 19.00±0.00 16.00±0.61
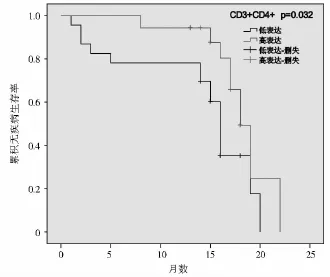
图 1 术后第10天CD3+CD4+表达与DFS关系

表 4 术后T淋巴细胞亚群对DFS影响的COX生存分析
3 讨论
研究资料表明,胃癌发病率及死亡率与性别、地域有相关性。纳入研究的41例胃癌病例,其中男34例(82.9%),女 7例(17.1%);中位年龄为 59岁(40~81 岁);有饮酒史 12 例(29.3%);有肿瘤家族史10例(24.4%);治疗前有其他伴随疾病者25例(60.9%);确诊前有明确症状者37例(90.2%),常见症状依次为:上腹部不适(疼痛、胀闷)、进食时哽噎感、便血、呕血、乏力等。此次入组病例各临床特征分布较均匀,全部病例随访时间为10~256个月,中位随访期为65个月,截至该研究随访终点2017年6月30日,出现疾病复发或转移者27例,其中6例(14.63%)死亡,1例失访,均未达到中位生存期,1年、2年和3年的总生存率分别为95.12%、90.24%和82.93%;有1例死于骨髓抑制引起的肺部感染,2例死于继发的肝转移癌,3例死亡原因不详,14例截至随访终点未监测到肿瘤复发或转移,中位DFS为 17个月,平均(17.00±0.77)个月,1年无病生存期(DFS)生存率为70.6%。由于该研究对象为能手术切除肿瘤的Ⅰ~Ⅲ期胃癌患者,所以选择能准确反映术后辅助治疗的DFS作为主要观察指标。
对41例胃癌术后临床病理特点与预后(DFS)相关性的单因素分析结果显示:年龄、症状、TNM分期、手术切缘与DFS相关。其他如性别、饮酒史、Lauren分型、脉管癌栓、癌细胞分化、合并慢性病、大体形态、术式、混合病理类型等因素对DFS的影响均无显著性差异。有研究显示淋巴细胞亚群的分布与年龄、性别、种族等因素相关[1],还有研究发现[3]胃癌患者外周血CD3+细胞、CD4+细胞、CD4+/CD8+细胞比值均明显低于正常人,而CD8+细胞则明显高于正常人。该研究发现外周血T细胞CD3+、CD3+CD4+、CD4+/CD8+的表达,胃癌术前组低于健康对照组、胃癌术后组(P<0.05,P<0.01);CD3+CD8+的表达,胃癌术前组高于健康对照组、胃癌术后组(P<0.05,P<0.01);研究结果提示胃癌患者均存在免疫功能紊乱,与既往研究结果相一致[4-6]。 该研究结果显示胃癌术后与术前相比,患者外周血中CD3+、CD3+CD4+、CD4+/CD8+水平有所升高,CD3+CD8+表达下降,两组比较差异具有统计学意义(P<0.05,P<0.01);而胃癌术后组与健康对照组相比差异无统计学意义(P>0.05),结果提示手术切除肿瘤对宿主免疫抑制的恢复有所帮助。有研究证实胃癌的进展与 T 细胞免疫反应减弱相关[7,8],该研究显示胃癌术前患者 CD3+CD8+水平增高,与文献报道一致[9-12]。
胃癌浸润、转移中,淋巴细胞的免疫功能是构成机体免疫防御功能的重要因素。该研究结果显示,胃癌术前组外周血T细胞CD8+CD28+的表达低于健康对照组(P<0.05),CD8+CD28-的表达高于健康对照组,但差异无统计学意义(P>0.05)。研究结果显示胃癌患者CD8+CD28+低于正常组,与文献报道相符[13,14]。 CD8+CD28-的表达虽然较健康对照组增高,但无统计学意义,分析可能样本数较少,有待进一步扩大样本量进行研究。该研究显示外周血T细胞CD8+CD28+的表达,胃癌术后组高于胃癌术前组,但差异无统计学意义(P>0.05)。胃癌术前组患者外周血CD8+CD28+T细胞明显降低,提示胃癌患者宿主免疫功能处于抑制状态,与文献报道一致[15]。该研究证实机体的免疫功能与肿瘤的发生及发展有密切的关系。肿瘤免疫学研究显示患者预后可能与免疫状态有关,该研究结果提示增强免疫力可能会达到抗肿瘤的目的。
由于该研究对象为能手术切除的Ⅰ~Ⅲ期胃癌,较OS相比,DFS更能准确反映术后辅助治疗的疗效,因此在该研究中,以健康对照组数据为标准,对T淋巴细胞亚群各项指标与预后(DFS)进行单因素分析,研究发现胃癌患者术后第10天外周血CD3+CD4+的表达与DFS相关,胃癌患者术后第10天CD3+CD4+低表达与高表达中位DFS分别为16个月和18个月,差异有统计学意义(P<0.05),而胃癌患者术前CD3+CD4+低表达与高表达中位DFS分别为16和22个月,但差异无统计学意义 (P>0.05)。研究结果提示胃癌患者术后CD3+CD4+细胞表达正常肿瘤复发转移风险降低。选择胃癌患者手术前后T淋巴细胞亚群 CD3+、CD3+CD4+、CD3+CD8+、CD4+/CD8+、CD8+CD28+、CD8+CD28-、CD4+CD25+、CD3-CD16+,CD56+、CD3+CD16+,CD56+等因素进行COX回归分析,结果显示,在该组病例中,胃癌患者术后CD3+、CD3+CD8+和CD3-CD16+,CD56+的表达是DFS的独立预后因素,胃癌患者术后外周血CD3+低表达疾病复发转移风险是高表达的27.3%,而CD3-CD16+,CD56+低表达较高表达、CD3+CD8+高表达较低表达疾病复发转移风险分别为2.595、5.394倍。研究结果显示胃癌生存时间与机体免疫功能紊乱和低下密切相关。因此,在胃癌患者治疗过程中,定期对机体免疫系统的评价及调整可能为肿瘤的治疗提供新的思路,通过肿瘤患者T淋巴细胞亚群的检测,进一步加大样本量的研究,可能为抗肿瘤治疗提供新的依据及途径。

