储藏期油茶籽霉菌多样性分析
刘 金 张立钊 陈力力 周 玥
(湖南农业大学食品科技学院1,长沙 410128)
(食品科学与生物技术湖南省重点实验室2,长沙 410128)
油茶是生长在我国南方丘陵地区的重要木本经济油料作物,其籽粒营养丰富,不仅含脂肪酸山茶苷、磷脂质和皂苷、维生素E、维生素D、维生素K和胡萝卜素(即维生素A原)和鞣质,更为重要的是还含有角鲨烯成分。油茶籽油是一种油酸含量高于80%[1]的优级烹饪油,含有丰富的维生素 E、茶多酚、角鲨烯、β-谷甾醇等生物活性物质,而且不含胆固醇、芥酸等有害物质[2-3],可以预防血管动脉粥样硬化而引起的多种心脑血管疾病[4]。
油茶籽的采摘在每年秋季进行,一年一收,但是油茶籽油提取加工生产往往要持续一年[5]。油茶籽粒是具有生物活性的有机体,含有微生物生长的各种营养成分,是微生物的良好基质;我国南方冬春阴湿多雨,保存不当时,易造成油茶籽中霉菌生长和代谢产毒,导致对油茶籽品质和食品安全性的危害,并且在大规模储藏的油茶籽中本身有极少数油茶籽已霉变或携带了霉菌,在一定的湿度和温度环境下极易发生大范围霉变。油茶籽霉变的实质就是油茶籽中的有机物质被微生物分解[6-8],油茶籽霉变不仅降低了油茶籽油的营养价值以及油茶籽副产品的综合利用价值,更重要的是霉菌在油茶籽内部和表面大量繁殖、生长,而且有些霉菌还能产生具有毒性的二级代谢产物,即真菌毒素,部分真菌毒素已被证实具有致癌、致畸、致细胞突变的作用,严重影响油茶籽以及油茶籽副产品的安全性。因此,研究油茶籽在储藏过程中微生物种类及其对油茶籽及油茶籽副产品安全性的影响至关重要[9-10]。
高通量测序技术(high-throughput sequencing)具有高通量、高灵敏度、高准确性和低运行成本的特点,该测序技术已被应用于多种生态系统如海洋[11-12]、肠道[13-14]、土壤[15-16]、人类皮肤[17]等生态系统的微生物多样性研究,它可以深入、细致地研究微生物群落结构。采用高通量测序技术对储藏期油茶籽壳、仁污染霉菌进行了菌群多样性分析,为进一步研究储藏期油茶籽主要霉菌对油茶籽油的品质影响提供参考。
1 材料与方法
1.1 主要材料与试剂
油茶籽:广西百色地区。
孟加拉红培养基:北京陆桥生物技术有限公司;琼脂糖生工生物工程(上海)股份有限公司;Plant Genomic DNA Kit试剂盒、凝胶回收试剂盒及PCR扩增试剂盒等:北京康为世纪生物科技有限公司。
1.2 仪器与设备
琼脂糖凝胶电泳仪:Bio-Rad公司;ABI Gene-Amp®9700型PCR仪:爱普拜斯公司;QuantiFluorTM-ST蓝色荧光定量系统:Promega公司;Miseq仪:Illumina公司;HC-1016高速离心机:安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 取样方式
采用棋盘式采样法从已储藏15个月的油茶籽中抽取30袋,每袋100 g,随机分为5组,从每袋上层挑取霉变油茶籽20-25颗制备5个混合样品,备用。
1.3.2 可培养霉菌菌落计数
用无菌剪刀将油茶籽壳仁分离,将油茶籽仁剪切到黄豆大小,油茶籽壳剪切到1 cm2大小,根据GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》方法,将样品10倍梯度稀释,分别取 10-1、10-2、10-3样品稀释液,采用混菌法接种孟加拉红琼脂培养基平板中,于28℃恒温培养5 d,进行平板菌落计数和计算,以lg CFU/g报告结果,并采用Excel 2007进行数据统计分析。
1.3.3 样品霉菌DNA提取及Miseq测序分析
分别收集1.3.2壳、仁10-1样品稀释液制备混合样,按照Plant Genomic DNA Kit试剂盒说明书分别提取样品霉菌基因组DNA,油茶籽壳样品编号为1、油茶籽仁样品编号为2,随后采用 Dy NA Quant 200测定其纯度,并利用1%的琼脂糖凝胶电泳进行DNA完整性检测;提取质量合格的DNA样品,送上海美吉生物医药科技有限公司,采用合成的特异引物ITS1F_ITS2R(ITS1:CTTGGTCATTTAGAGGAAGTAA,ITS2:GCTGCGTTCTTCATCGATGC)对真菌的ITS区PCR扩增,使用Illumina(MiSeq)平台对真菌的ITS区进行核酸序列测序。
对Miseq测序得到的PE reads进行拼接,同时对序列质量进行质控和过滤,选择序列长度200-1 000 bp,用 Qiime软件聚类操作将相似度大于97%的序列称归为同一个操作分类单元[Operational Taxonomic Units(OTU)],基于OTU聚类分析结果,采用 mothur软件及菌群丰度指数计算法对OTU进行群落的物种丰度和多样性指数分析,用于指数评估的OTU相似水平97%(0.97);基于分类学信息,在不同水平上对各样品进行群落结构的统计分析。
2 结果和分析
2.1 可培养霉菌计数
可培养霉菌计数结果见图1,在孟加拉红培养基上培养5 d后,油茶籽壳霉菌数量为(3.25±0.28)lg CFU/g、油茶籽仁为(2.70 ±0.49)lg CFU/g,这说明油茶籽壳可培养霉菌总数大于油茶籽仁。
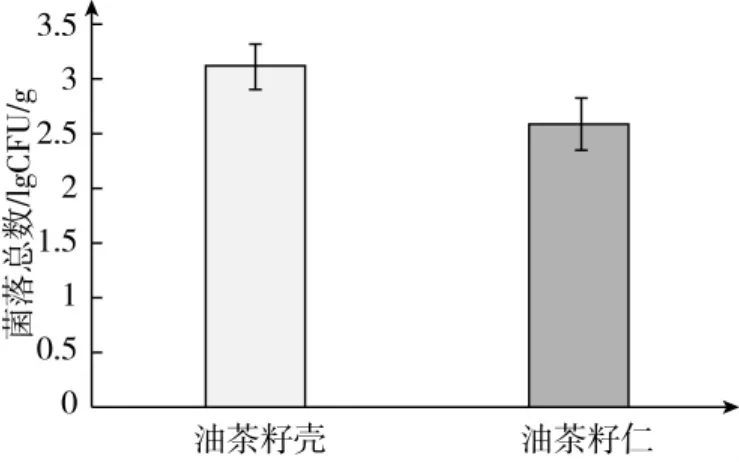
图1 油茶籽壳、仁霉菌总数计数
2.2 样品序列分析及取样深度验证分析
取各样品总DNA 2 μL加样进行1.0% 琼脂糖凝胶电泳检测,并采用分光光度计检测OD260和OD280,如图2a所示,电泳目的条带清晰、260/280为1.55和1.79,浓度和纯度符合进行PCR扩增的要求,用2%琼脂糖凝胶电泳检测PCR产物,如图2b所示目的条带大小合适,浓度合适,满足核酸序列测序要求。

图2 琼脂凝糖胶电泳检测图
经Miseq测序得到两个样品序列信息,2个样本得到真菌有效序列769 57条,油茶籽壳有效序列为423 32,油茶籽仁有效序列为346 25。MiSeq测序得到的是双端序列数据,首先根据PE reads之间的overlap关系,将成对的reads拼接(merge)成一条序列,同时对reads的质量和merge的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,在97%相似度下将其聚类为用于物种分类的OTU,两样品共产生126个OTU,最终得到的测序长度在200-350 bp内,平均长度在255 bp左右,测序长度上下浮动不大,说明得到的序列是能够应用于后续分析的。
以抽到的序列数与它们所能代表的物种数目构建稀释性曲线,2个样品的稀释曲线如图3。曲线趋于平坦,说明更多的数据量对发现新OTU的边际贡献很小,可进行下一步数据分析。
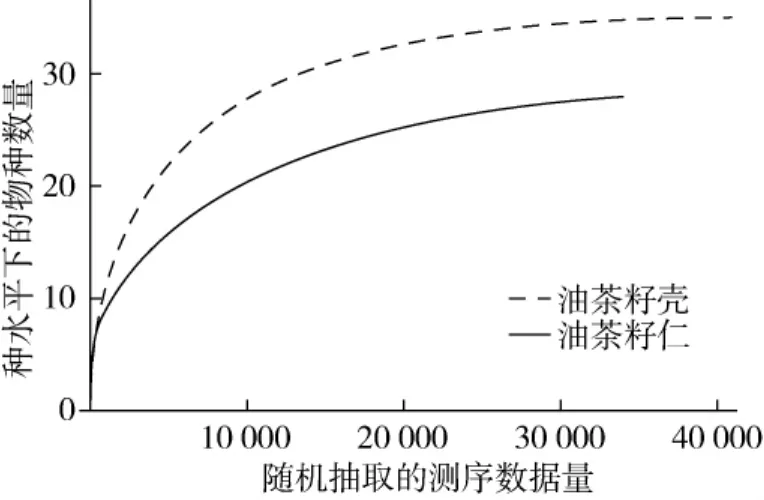
图3 样品稀释性曲线
2.3 样本多样性比较分析
2.3.1 多样性指数分析
表1中两样品的覆盖率均在0.999以上,覆盖率数值越高,样本中序列被测出的概率就越高,由此说明测序结果代表了样本中微生物的真实情况。多样性指数分析表明,油茶籽壳的Chao指数及Ace指数大于油茶籽仁,在生态学中Chao 1指数和ace指数越大表示菌群丰度越高[18-19],因此,油茶籽壳的菌群丰度高于油茶籽仁;另外,表中油茶籽仁的Shannon指数1.219 8弱小于油茶籽壳的1.258 2,而Simpson指数为0.382 5弱大于油茶籽壳的0.361 8,Shannon指数和Simpson指数是估算样品中微生物多样性的指数之一,Shannon值越大,Simpson指数值越小,说明群落多样性越高[20,21],由此可知油茶籽壳的菌群种类比油茶籽仁多。
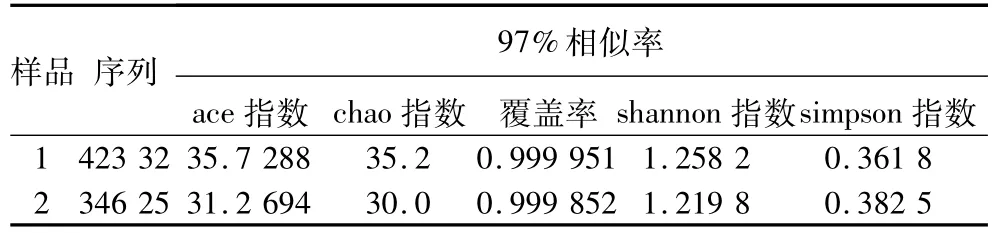
表1 样品多样性指数表
2.3.2 Venn 图分析
Venn图可用于统计多个样本中所共有和独有的物种(如OTU)数目,可以比较直观的表现样本的物种(如OTU)数目组成相似性及重叠情况。由图4可知,1号样品油茶籽壳与2号样品油茶籽分别拥有的OTU数目为69和57,而共有的OTU数为50个,重叠度较高,说明油茶籽壳、仁中的霉菌种类具有较大的相似性。
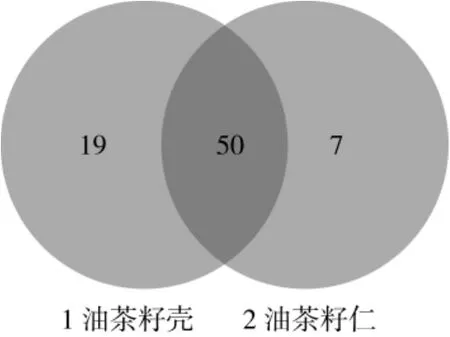
图4 样品OTU水平Venn图
2.4 样本物种比较分析
2.4.1 门水平比较分析
根据Silva的SSUrRNA序列数据库对优化序列进行分类,门水平上两样品均为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)和未分类真菌(unclassified),虽然两样品所含物种门水平相同,但物种丰度存在差异,1号样品油茶籽壳子囊菌门(Ascomycota)相对丰度大于2号样品油茶籽仁,分别为85.06%、76.48%,担子菌门(Basidiomycota)相对丰度小于2号样品油茶籽仁,分别为 10.64%、18.41%。
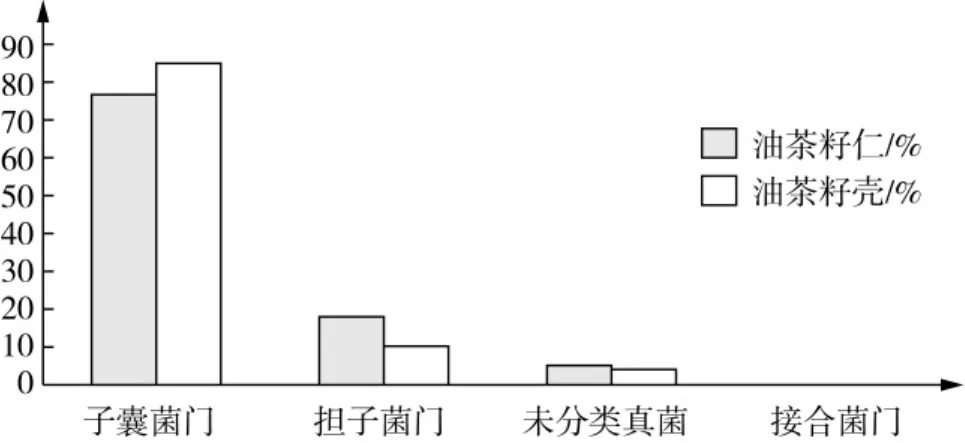
图5 样本门水平比较柱形图
2.4.2 科水平比较分析
在科水平上两样品均覆盖了26个科,主要为子囊菌中的发菌科(Trichocomaceae)、毛壳菌科(Lasiosphaeriaceae)、从赤壳科(Nectriaceae)、麦角菌科(Clavicipitaceae)、毛球壳科(Lasiosphaeriaceae),担子菌中的节担菌科(Wallemiaceae)、粉褶菌科(Entolomataceae)以及接合菌中的被孢霉科(Mortierellaceae)等。如图6(图6a为1号样品油茶籽壳,图6b为2号样品油茶籽仁),对样品物种丰度进行统计并绘制饼状图,图6显示霉菌污染油茶籽壳和仁所含物种种类相似,相对丰度最大的均为发菌科(Trichocomaceae)和节担菌科(Wallemiaceae),将平均丰度低于0.01%的部分合并为others,others相对丰度仅为0.04%,另外,两样品都有在科水平以上的未鉴定类群,分别为油茶籽壳样品6.93%,油茶籽仁样品6.32%。本结果说明样本具有丰富的物种多样性,各物种相对丰度差异明显,同时各样品物种复杂均存在分类不明确的类群。
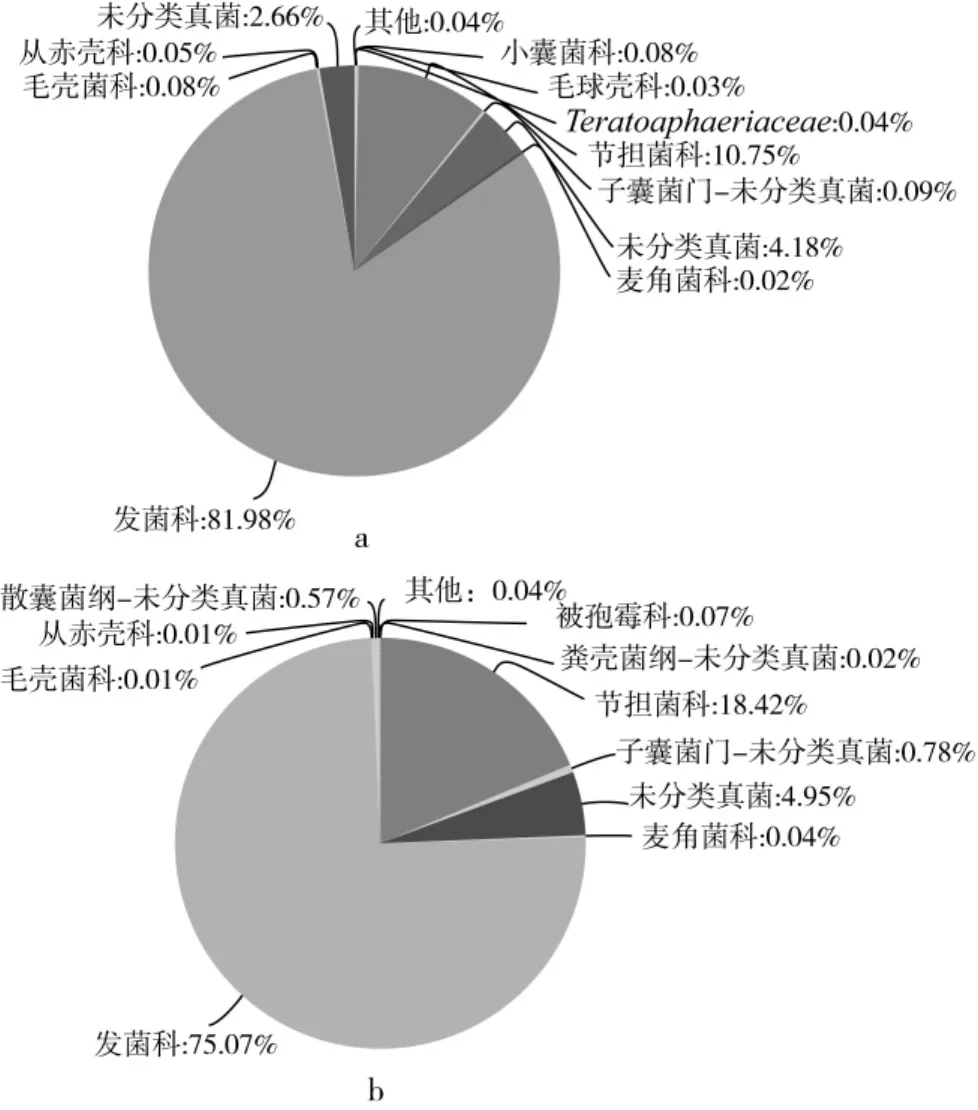
图6 样品科水平群落饼状图
2.4.3 属水平比较分析
样品污染霉菌群落结构在属水平上的组成见图7,图7中黑灰白颜色渐变,表示相对丰度逐渐增大,因此颜色的梯度及相似程度直观地反映了各样品同一菌属所含序列相对丰度的相似性和差异性。由图7可知,储藏期油茶籽曲霉属(Aspergillus)在1号样品油茶籽壳中占81.51%,在2号样品油茶籽仁中占74.50%,为主要菌属,除该属外,节担菌属(Wallemia)在油茶籽壳中占10.75%,在油茶籽仁中占18.42%,未分类真菌(unclassified k Fungi)分别为4.18%、4.95%,unclassified c Eurotiomycetes 在油茶籽壳中占2.66%,在油茶籽仁中占0.57%。而其他属的真菌在油茶籽壳、仁中相对丰度均小于1%。
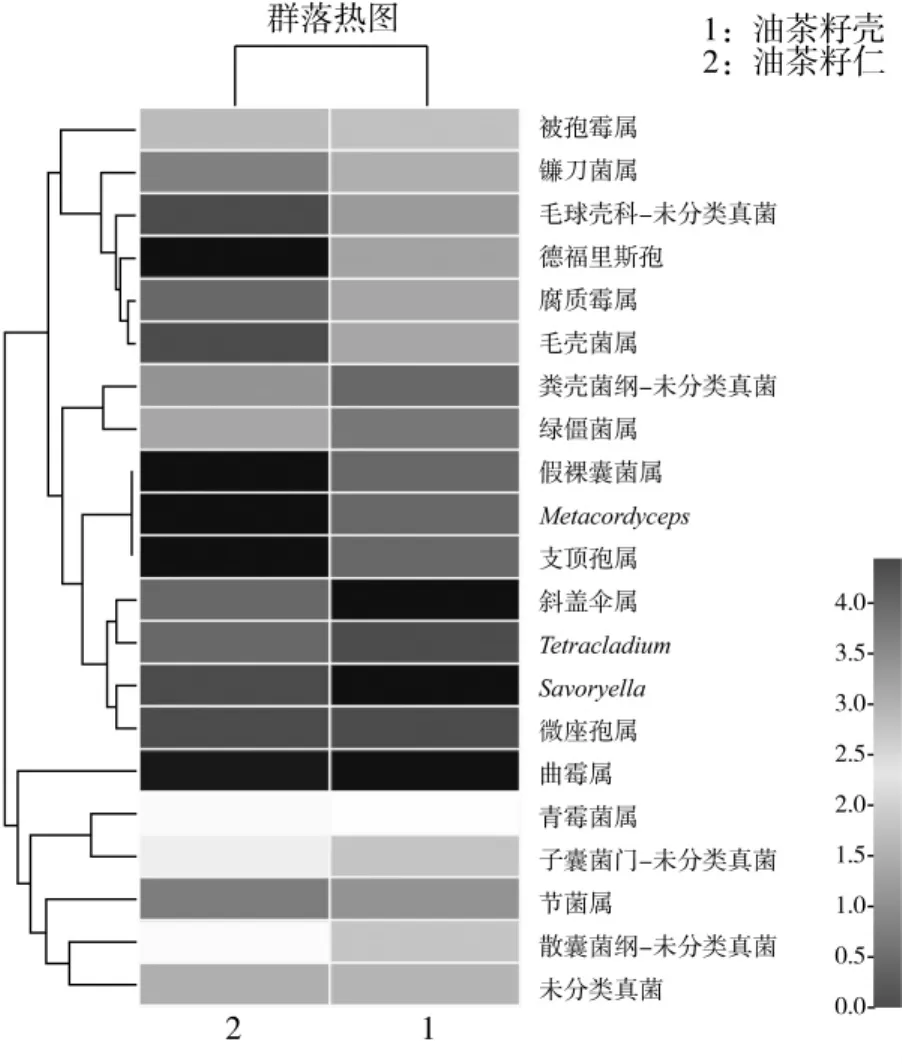
图7 样品属水平群落热图
2.4.4 种水平比较分析
在种水平上两样品均覆盖了37个种,主要为子囊菌中的帚状曲霉(Aspergillus penicillioides)、Aspergillus cibarius、Preussia sp、Devriesia pseudoamericana、黑僵菌(Metarhizium anisopliae),担子菌中的蜜生节担菌(Wallemia mellicola)以及接合菌中的Mortierella alpina等,大部分种的相对丰度均低于1%。如图8对样品物种丰度排在前15位的进行统计并绘制差异检验柱形图,图中显示霉菌污染油茶籽壳和仁所含物种种类相似,相对丰度最大的均为帚状曲霉(Aspergillus penicillioides)、Aspergillus cibarius和蜜生节担菌(Wallemia mellicola),但他们在油茶籽壳、油茶籽仁样品中的相对丰度差异明显。
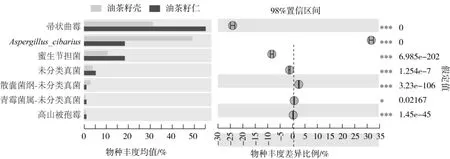
图8 样品种水平差异检验柱形图
3 讨论
3.1 发菌科霉菌对油茶籽安全性的潜在影响
油茶籽中发菌科霉菌主要属于曲霉属(Aspergillus)和青霉属(Penicillium),曲霉属(Aspergillus)被认为是3大类产毒真菌之一,能产黄曲霉毒素(aflatoxins)、赭曲霉毒素(ochratoxins)等毒素。毒性代谢产物大部分具有潜在的致癌、致畸、致突变性,以及肝脏毒性、肾脏毒性、免疫毒性、出血毒性,目前已有研究证明油茶籽在高温、高湿环境或黄曲霉毒素孢子大量存在的条件下仍然有被黄曲霉菌感染和产生黄曲霉毒素的风险[22],对油茶籽、油茶饼粕人为接种黄曲霉菌,虽然油茶籽和油茶饼粕中都有一定量的黄曲霉生长,但均未检出黄曲霉毒素 B1(AFB1)[23]。同时已有研究证明某些脂氧合物可以调控曲霉属真菌的生长、产孢和毒素合成,促进黄曲霉毒素的合成[24]。Burow 等[25]发现高浓度的 9S-HPODE 会延长黄曲霉毒素合成基因表达的时间,从而促进黄曲霉毒素合成。分子生物学和生物化学水平研究揭示了脂类物质及其氧化产物和黄曲霉毒素合成之间的密切关系[26-30]。例如,曲霉属真菌的脂肪酸合成酶基因 fas-1A[26],脂肪酸过氧化物酶基因 ppo A、ppo B、ppo C、ppo D[27],脂氧合酶基因 Aflox1[28]的突变都会影响曲霉属真菌的生长发育以及毒素合成。宿主植物的脂氧合酶基因 Zm LOX3的表达下调也可以影响曲霉属真菌的黄曲霉毒素合成[29]。同时也有研究证明油脂水解生成的游离脂肪酸在青霉和曲霉等微生物产生的酶类催化下能进一步氧化生成酮酸和甲基丽,称为酮型酸败[31],酮型酸败中参与反应的直链饱和脂肪酸的碳原子数大部分为4~5个,且基本都为霉菌产生[32]。
3.2 镰刀菌属霉菌对油茶籽安全性的潜在影响
在分类学上,镰刀菌属(Fusarium)无性时期原属于半知菌亚门,有性时期为子囊菌亚门,镰刀菌属又称镰孢霉属,镰孢菌毒素被认为是影响人类健康的5种真菌毒素之一。镰孢菌一般生活在谷类作物中,它产生的毒素会残留在作物中,有些镰孢菌属霉菌可以分泌单端孢霉烯族毒素,它能抑制蛋白质、PNA、DNA合成,使核糖体的一些肽链被切断,破坏核糖体环;破坏膜的通透性和功能,破坏正常的造血功能,抑制免疫功能;通过血液刺激人类乳腺癌细胞的扩散和繁殖,导致动物细胞基因片段化而造成基因损伤,影响人类和动物的繁殖能力、内分泌系统及免疫力等[33]。
3.3 节担菌属对油茶籽安全性的潜在影响
节担菌属属于担子菌门节担菌纲节担菌目,节担菌属中的细丽外担菌能致使油茶患上一种称作“油茶饼病”的病害,“油茶饼病”主要发生在油茶树的嫩叶和新梢上,但老叶和老枝上一般不发生,患病油茶通常会组织膨大,进而嫩枝叶枯死,严重影响油茶生长及茶果产量[34-35]。
3.4 煤炱目对油茶籽安全性的潜在影响
煤炱目是子囊菌门座囊菌纲座囊菌亚纲之下的一个多元化的目。有研究表明油茶煤污病是由山茶小煤炱菌引起的,一般对油茶不造成重大损失。腐生性的煤炱菌主要以蚧虫、蚜虫、粉虱等昆虫排出的蜜露为营养来源,有时也利用寄主叶片本身的分泌物。症状初期,表面生黑色片状的菌丝霉斑,似粘附一层煤烟,煤烟能抹除,抹除后枝叶表面仍为绿色。后期,霉层上散生许多黑色小粒点或刚毛状突起,常伴生蚜虫、粉虱和介壳虫[36]。病害多发生在枝、叶和果实上,植物受害部位布满黑色的煤粉层抑制植物的光合作用,削弱植物的生长势,降低果实的感官质量,染害林果能损失10%的经济产量[37]。因此,进一步研究储藏期油茶籽污染霉菌所产毒素的种类及其对油茶籽及油茶籽副产品安全性的影响,对提高油茶籽加工企业的效益具有非常积极的意义。
4 结论
本研究初步分析了储藏期油茶籽壳、仁霉菌污染的主要菌群。结果表明油茶籽壳、仁中大部分霉菌种类相同,主要有子囊菌门发菌科的曲霉属(Aspergillus)、青霉属(Penicillium)和镰刀菌属(Fusarium),担子菌节担菌科中的节担菌属(Wallemia),以及接合菌中的被孢菌属(Mortierella)、毛壳菌属(Chaetomium)。油茶籽壳中主要种为子囊菌门发菌科曲霉属的Aspergillus cibarius和帚状曲霉(Aspergillus penicillioides),其次为担子菌门节担菌科节担菌属的蜜生节担菌(wallemia mellicola);油茶籽仁中主要菌种为子囊菌门发菌科曲霉属的帚状曲霉(Aspergil-lus penicillioides)和Aspergillus cibarius,其次为担子菌门节担菌科节担菌属的蜜生节担菌(wallemia mellicola)。储藏期油茶籽的污染霉菌存在种群多样性,油茶籽壳、油茶籽仁污染霉菌的丰度及多样性存在相似性差异,污染霉菌种类及其产生的霉菌毒素对油茶籽及油茶籽副产品安全性的影响有待进一步研究。

