芒柄花黄素对阿尔茨海默病小鼠学习记忆能力及海马毛细血管超微结构的影响
费洪新 李 林 赵 坤 柏青杨 韩丽君 沈 博 明 玥 张英博 兴桂华 李春旭(齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
阿尔茨海默病(AD)是常见的老年性疾病之一,其病理特征为神经元外沉积 β-淀粉样蛋白(Aβ)〔1〕,Aβ积累后诱导脑组织小胶质细胞(MG)活化,促进炎症介质上调〔2〕,一旦Aβ产生和清除平衡破坏会引起血管毒性〔3〕,Aβ 清除异常可导致学习记忆障碍〔4〕,伴有海马血管内皮细胞超微结构变化〔5〕。已经证实Aβ由低密度脂蛋白受体相关蛋白(LRP)1与晚期糖基化终产物(RAGE)受体介导清除〔6,7〕,RAGE/Aβ 参与调节从机体周边到脑运输〔8〕,脑内RAGE可增加核转录因子(NF)-κB、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-1β 表达〔9,10〕,最终促进 AD 的发生发展。前期研究显示,补阳还五汤有效成分黄芪多糖可保护AD模型海马组织〔11〕。现代药理学研究显示,补阳还五汤有效成分芒柄花黄素(FMN)可减弱 Aβ诱导HT22 细胞毒性〔12〕、调控新生血管形成〔13,14〕、降低糖尿病小鼠高血糖〔15〕等。目前尚未见文献报道FMN用于AD小鼠,本实验分析FMN对AD小鼠学习记忆能力及海马毛细血管超微结构的影响。
1 材料与方法
1.1 动物 健康雄性C57小鼠,鼠龄2周龄,体重(20±2)g,42只,由黑龙江中医药大学李宝龙副教授、副主任提供〔动物许可证号:SCXK(黑)2013-012〕。
1.2 仪器和试剂 透射电镜(荷兰公司),Morris水迷宫(MWM)(安徽淮北正华公司),RT-雷杜酶标仪(美国RT公司),脑立体定位仪(成都仪器厂),FMN(成都曼思特生物公司,16031005),多奈哌齐(中国重庆植恩药业公司,20141201),LRP1(Santa Cruz公司,sc-25469),RAGE(Boster公司,ba-1789),酶联免疫试剂盒IL-1β、TNF-α、IL-6细胞因子(南京建成生物工程研究所),Aβ1~42(Sigma公司)。
1.3 AD模型的建立 除对照组外,参考文献〔16,17〕方法造模,麻醉、固定、定位后,小鼠双侧脑室海马区一次性注入 Aβ1~42(80 pmol/μl,10 μg);对照组双侧脑室内无菌条件下注射10 μl生理盐水。
1.4 分组与给药 按照随机数字表随机分为FMN高剂量组(30.0mg/kg灌胃)、FMN 中剂量组(15.0 mg/kg灌胃)、FMN低剂量组(7.5 mg/kg灌胃)、多奈哌齐组(1 mg/kg灌胃)、模型组(生理盐水灌胃)、对照组(生理盐水灌胃),每组7只,持续给药30 d。
1.5 检测学习能力 各组实验小鼠经过灌胃结束后,采用MWM系统测定小鼠学习能力,该仪器水深20 cm,水温(23±2)℃,平台放于第Ⅳ象限,训练时间为第1~4天,60 s/次,若60 s未找到平台,将小鼠放平台15 s潜伏期计为60 s,第5天测定小鼠学习能力。
1.6 测定记忆能力 过程同1.5,第5天撤去MWM平台,经过MWM记录轨迹并分析60 s小鼠找到平台的游泳距离。
1.7 测定学习记忆保持能力 过程同1.5,第5天撤去MWM平台,经过MWM记录轨迹并观察60 s内小鼠的目标停留时间和跨平台次数。
1.8 观察海马CA3区毛细血管结构 实验结束后,经心脏灌注器灌注后,取材海马,经过常规固定、脱水、包埋、切片等进行观察。
1.9 检测海马LRP1、RAGE表达 按照免疫组织化学法(IHC)常规制备石蜡切片,经过脱蜡、灭活、封闭、加抗、显色、复染、脱水、透明、封片等,计数海马平均光密度值(MOD)。
1.10 检测海马 IL-1β、IL-6、TNF-α含量 实验结束后断头处死小鼠,取材海马,经匀浆、静置、离心、分装等,于450 nm波长检测吸光度(A),按照常规酶联免疫吸附分析方法求得炎症介质含量。
1.11 统计学处理 采用SPSS19.0软件进行正态性和方差齐性检验、单因素方差分析。
2 结果
2.1 学习能力 小鼠潜伏期在1~5 d呈逐渐下降趋势,与对照组第5天比较,模型组潜伏期明显延长(P<0.05);与模型组第5天比较,多奈哌齐组、FMN高剂量组、FMN高剂量组、FMN高、中剂量组潜伏期明显缩短(P<0.05)。见表1。
2.2 记忆能力 小鼠游泳距离在1~5 d呈逐渐下降趋势,与对照组第5天比较,模型组游泳距离明显增加(P<0.05);与模型组第5天比较,多奈哌齐组、FMN高、中剂量组游泳距离明显减少(P<0.05)。见表2。
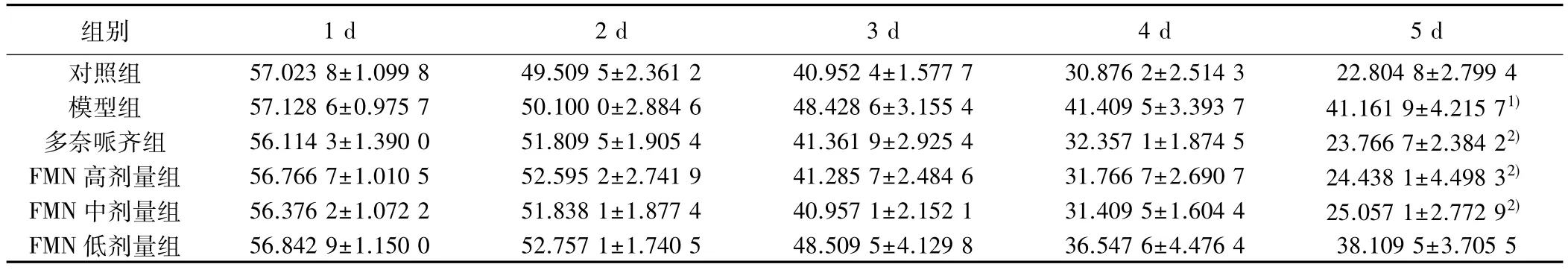
组别 1 d 2 d 3 d 4 d 5 d对照组 57.023 8±1.099 8 49.509 5±2.361 2 40.952 4±1.577 7 30.876 2±2.514 3 22.804 8±2.799 4模型组 57.128 6±0.975 7 50.100 0±2.884 6 48.428 6±3.155 4 41.409 5±3.393 7 41.161 9±4.215 71)多奈哌齐组 56.114 3±1.390 0 51.809 5±1.905 4 41.361 9±2.925 4 32.357 1±1.874 5 23.766 7±2.384 22)FMN 高剂量组 56.766 7±1.010 5 52.595 2±2.741 9 41.285 7±2.484 6 31.766 7±2.690 7 24.438 1±4.498 32)FMN 中剂量组 56.376 2±1.072 2 51.838 1±1.877 4 40.957 1±2.152 1 31.409 5±1.604 4 25.057 1±2.772 92)FMN 低剂量组 56.842 9±1.150 0 52.757 1±1.740 5 48.509 5±4.129 8 36.547 6±4.476 4 38.109 5±3.705 5
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05,下表同
表2 各组撤去平台后不同时间点记忆能力比较(,n=7,游泳距离,cm)
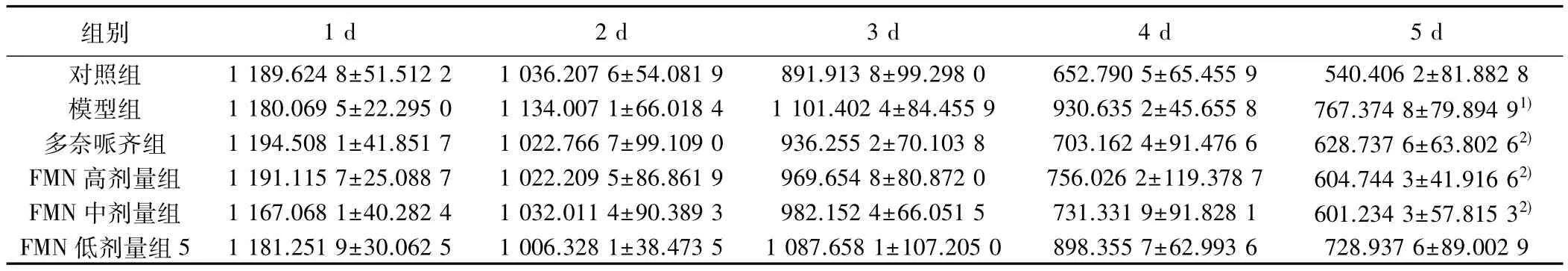
表2 各组撤去平台后不同时间点记忆能力比较(,n=7,游泳距离,cm)
组别 1 d 2 d 3 d 4 d 5 d对照组 1 189.624 8±51.512 2 1 036.207 6±54.081 9 891.913 8±99.298 0 652.790 5±65.455 9 540.406 2±81.882 8模型组 1 180.069 5±22.295 0 1 134.007 1±66.018 4 1 101.402 4±84.455 9 930.635 2±45.655 8 767.374 8±79.894 91)多奈哌齐组 1 194.508 1±41.851 7 1 022.766 7±99.109 0 936.255 2±70.103 8 703.162 4±91.476 6 628.737 6±63.802 62)FMN 高剂量组 1 191.115 7±25.088 7 1 022.209 5±86.861 9 969.654 8±80.872 0 756.026 2±119.378 7 604.744 3±41.916 62)FMN 中剂量组 1 167.068 1±40.282 4 1 032.011 4±90.389 3 982.152 4±66.051 5 731.331 9±91.828 1 601.234 3±57.815 32)FMN 低剂量组 5 1 181.251 9±30.062 5 1 006.328 1±38.473 5 1 087.658 1±107.205 0 898.355 7±62.993 6 728.937 6±89.002 9
2.3 学习记忆保持能力 与对照组比较,模型组目标停留时间明显缩短且跨平台次数明显减少(P<0.05);与模型组比较,多奈哌齐组,FMN高、中剂量组目标停留时间明显延长且跨平台次数明显增加(P<0.05)。见表3。
2.4 海马CA3区毛细血管超微结构 对照组海马毛细血管管壁较厚,细胞核清晰,细胞质丰富;模型组海马CA3区毛细血管管壁薄,核固缩,细胞质不丰富;多奈哌齐组,FMN高、中剂量组细胞核正常,细胞质丰富;FMN低剂量组海马CA3区毛细血管结构欠佳。见图1。
表3 各组目标停留时间和跨平台次数比较(,n=7)
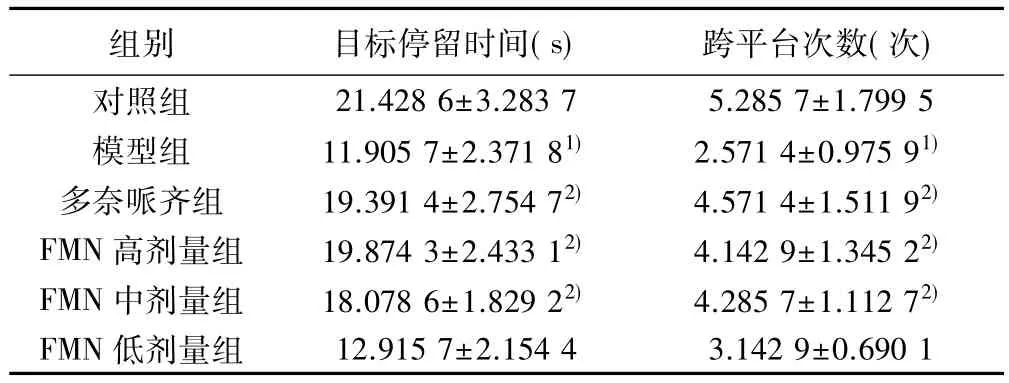
表3 各组目标停留时间和跨平台次数比较(,n=7)
组别 目标停留时间(s) 跨平台次数(次)对照组 21.428 6±3.283 7 5.285 7±1.799 5模型组 11.905 7±2.371 81) 2.571 4±0.975 91)多奈哌齐组 19.391 4±2.754 72) 4.571 4±1.511 92)FMN 高剂量组 19.874 3±2.433 12) 4.142 9±1.345 22)FMN 中剂量组 18.078 6±1.829 22) 4.285 7±1.112 72)FMN 低剂量组 12.915 7±2.154 4 3.142 9±0.690 1
2.5 海马 LRP1、RAGE、IL-1β、IL-6、TNF-α 水平 与对照组比较,模型组海马LRP1表达量明显降低(P<0.05),RAGE、IL-1β、IL-6、TNF-α 明显升高 (P <0.05);与模型组比较,多奈哌齐组,FMN高、中剂量组小鼠海马 LRP1明显升高(P<0.05),RAGE、IL-1β、IL-6、TNF-α 明显降低(P<0.05)。见表 4。
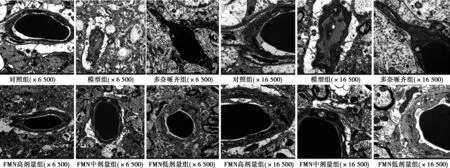
图1 各组海马CA3区毛细血管超微结构(透射电镜)
表 4 各组海马 LRP1、RAGE、IL-1β、IL-6、TNF-α水平(,n=7)
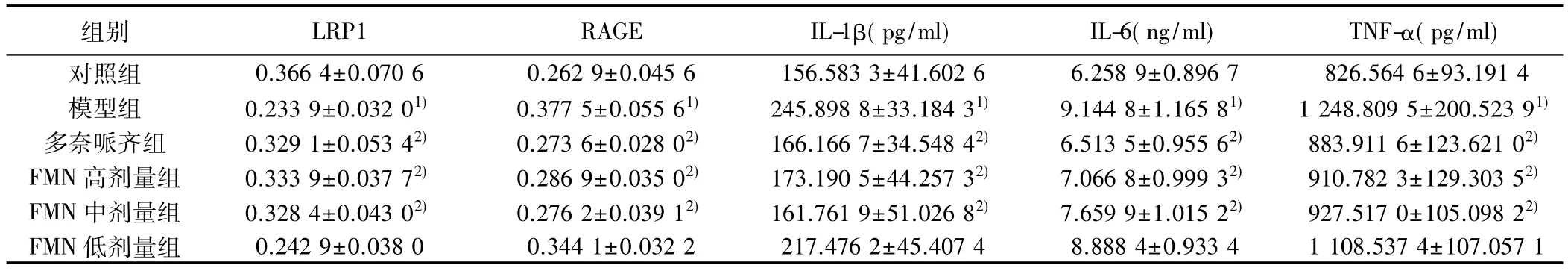
表 4 各组海马 LRP1、RAGE、IL-1β、IL-6、TNF-α水平(,n=7)
组别 LRP1 RAGE IL-1β(pg/ml) IL-6(ng/ml) TNF-α(pg/ml)对照组 0.366 4±0.070 6 0.262 9±0.045 6 156.583 3±41.602 6 6.258 9±0.896 7 826.564 6±93.191 4模型组 0.233 9±0.032 01) 0.377 5±0.055 61) 245.898 8±33.184 31) 9.144 8±1.165 81) 1 248.809 5±200.523 91)多奈哌齐组 0.329 1±0.053 42) 0.273 6±0.028 02) 166.166 7±34.548 42) 6.513 5±0.955 62) 883.911 6±123.621 02)FMN 高剂量组 0.333 9±0.037 72) 0.286 9±0.035 02) 173.190 5±44.257 32) 7.066 8±0.999 32) 910.782 3±129.303 52)FMN 中剂量组 0.328 4±0.043 02) 0.276 2±0.039 12) 161.761 9±51.026 82) 7.659 9±1.015 22) 927.517 0±105.098 22)FMN 低剂量组 0.242 9±0.038 0 0.344 1±0.032 2 217.476 2±45.407 4 8.888 4±0.933 4 1 108.537 4±107.057 1
3 讨论
本文结果表明AD小鼠学习记忆能力减退,FMN高、中剂量有效改善AD小鼠学习能力、记忆能力。FMN高、中剂量可改善AD小鼠海马学习记忆的关键区域——CA3区毛细血管超微结构,以此减弱小鼠海马的损伤。FMN高、中剂量可改善小鼠学习记忆和毛细血管超微结构,这与小鼠海马LRP1、RAGE、IL-1β、IL-6、TNF-α水平改善有关。综上,FMN通过改善AD小鼠海马Aβ转运蛋白和炎症介质水平来改善学习记忆能力和海马毛细血管超微结构。

