中枢nesfatin-1表达下调对大鼠胰岛素敏感性的影响
肖 蓉 令狐昌敏 唐 亮 熊 娜 郭耘菘 贾彦军 周泽华(重庆市涪陵中心医院内分泌科,重庆 408000)
nesfatin-1是一种新发现的下丘脑摄食抑制因子,由核组蛋白(NUCB)2N端水解产生〔1〕。研究表明,nesfatin-1不仅仅作为摄食调控因子在能量代谢方面起到作用,并且在胰岛素抵抗及糖尿病的发生、发展中发挥着重要的作用〔2~4〕。然而,中枢性 nesfatin-1调节胰岛素敏感性及糖代谢的具体作用及分子机制尚不完全清楚。本研究拟利用已成功构建的针对nesfatin-1的RNAi干扰腺病毒Ad-shNUCB2下调nesfatin-1基因表达,行第三脑室微量输注,建立下丘脑 nesfatin-1低表达模型。通过3-3H葡萄糖和2-脱氧-3H葡萄糖(3H-2DG)为示踪剂的扩展高胰岛素正葡萄糖钳夹技术评价中枢nesfatin-1下调对大鼠糖、脂代谢及胰岛素敏感性的影响,旨在进一步探索中枢nesfatin-1在胰岛素抵抗和糖尿病发生发展中所发挥的作用。
1 材料与方法
1.1 材料与试剂 人工脑脊液购自BioPanda公司,每升里面包含氯化钠6.279 g,氯化钾0.216 g,氯化钙0.353 g,氯化镁 0.488 g,碳酸氢钠 1.932 g,葡萄糖0.6 g,磷酸氢二钠0.358 g,pH7.3~7.4;大鼠源性 nesfatin-1腺病毒高效率干扰重组载体(Ad-shNUCB2)由本研究组前期构建,并且本研究组前期已经证明Ad-shNUCB2具有非常高的抑制率,其有效序列:5'-GATCCCCGGTGGAAAGTGCAAGGATATTCAAGAGATA TCCTTGCACTTTCCACCTTTTTGGAAA-3';重组绿色荧光蛋白腺病毒载体(Ad-shGFP)作为空载对照病毒,由重庆医科大学检验医学院临床检验诊断学重点实验室提供。
1.2 实验动物 健康雄性4周龄SD大鼠60只,体重100~120 g,均购自第三军医大学大坪医院的野战外科研究所实验动物中心。适应性喂养1 w后,根据随机表法完全随机分为6组,分别为普食+人工脑脊液组(NCA组,n=10);普食+Ad-shGFP组(NCG组,n=10);普食喂养+Ad-shNUCB2组(NCN组,n=10);高脂喂养+人工脑脊液组(HFA组,n=10);高脂喂养+Ad-shGFP组(HFG组,n=10);高脂喂养+AdshNUCB2组(HFN组,n=10)。喂养10 w,普通饲料(热卡百分比:脂肪7.39%,蛋白质18.81%,碳水化合物51.96%,其他21.94%),高脂饲料(热卡百分比:脂肪26.98%,蛋白质14.83%,碳水化合物40.97%,其他17.5%)。两种饲料均由第三军医大学大坪医院的野战外科研究所实验动物中心提供。
1.3 大鼠脑室内微量给药系统的建立 大鼠脑室内微量给药系统的建立操作方法均同本课题组前期研究〔5〕。大鼠禁食5 h后,测量其体质量并氯安酮腹腔麻醉(87 mg/kg)备皮后,将其俯卧位头部固定于大鼠脑立体定位仪,常规皮肤消毒,沿颅顶中线皮肤切开,暴颅骨及前囟,参照脑立体定位图谱定位第三脑室〔5〕,利用螺丝钉及玻璃离子水门汀固定套管并缝合皮肤。术后单笼喂养,并预防性使用青霉素。第三脑室置管术后第5天,套管内输注血管紧张素Ⅱ10 ng(10 ng稀释到10 μl生理盐水中),监测大鼠饮水量,15 min饮水<5 ml者予以剔除。
1.4 扩展高胰岛素-正葡萄糖钳夹技术 钳夹术前2 d,空白对照组(NCA和HFA组)每只大鼠第三脑室内输注人工脑脊液10 μl,阴性对照组(NCG和 HFG组)输注 Ad-shGFP(109PFU/只),干预组(NCN和HFN组)输注大鼠nesfaitn-1干扰重组腺病毒载体AdshNUCB2(109PFU/只)。扩展钳夹术操作同前〔6〕:钳夹开始前1 h(0 min)由动脉导管给予3-〔3H〕标记葡萄糖6 μCi,随后以0.2 μCi/min的速度输注直至钳夹结束。t=120 min 时开始钳夹,以 6 mU·kg-1·min-1的速度输注胰岛素及25%葡萄糖溶液,根据血糖调整葡萄糖输注率(GIR),使血糖维持在 4.5~5.5 mmol/L。于钳夹 0、60、140、160、170、180 min分别取血液样品分离血浆,置于-80℃用于测定代谢指标。1.5 摄食测定 在普食喂养及高脂喂养的大鼠第三脑室分别注入人工脑脊液(10 μl/只)、Ad-shGFP(109PFU/只)、Ad-shNUCB2(109PFU/只)后,每隔24 h连续7 d检测大鼠摄食量及体重变化。
1.6 组织葡萄糖摄取率测定 在钳夹术的基础上,通过课题组已经建立的方法采用3H-2DG(Amersham公司)作为示踪剂测定各组织葡萄糖摄取率(GU)〔5〕。钳夹结束前45 min,由静脉导管注入3H-2DG 30 μCi,并于注入3H-2DG 后的 2、5、10、15、20、30 min 和45 min 7个时间点留取血液标本,并记录各点血糖浓度。实验结束后,立即处死大鼠,快速剥离附睾脂肪、棕色脂肪、比目鱼肌和腓肠肌组织,置于生理盐水洗涤3次,滤纸吸尽水分,立即置于液氮;检测前于液氮中快速取出组织,称取约100 mg组织,置于0.2 mmol/L NaOH中孵育裂解,0.4 mol/L HCl中和后,加入闪烁杯,室温过夜,LS6500液闪仪检测每分钟衰变率。
1.7 各项参数计算 根据Steel公式〔7〕计算葡萄糖利用率:即在钳夹稳态时,外源性葡萄糖的输注率(GIR)反映了整个机体对胰岛素的敏感性。机体对葡萄糖利用率等于葡萄糖清除率(GRd),GRd=〔3H〕标记GIR(dpm/min)/血浆〔3H〕标记葡萄糖比活性(dpm/mg);肝糖生成(HGP)=GRd-GIR;基础状态下HGP=GRd。
1.8 血浆生化指标测定 血糖测定采用葡萄糖氧化酶法;血浆胰岛素采用放射免疫法测定(美国Linco公司);血浆三酰甘油(TG)、总胆固醇(TC)、游离脂肪酸(FFA)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)均用酶法测定;血浆3-〔3H〕葡萄糖比活性、3H-2DG血浆及组织比活性均采用液体闪烁计数法测定(美国Amersham公司产品)。
1.9 脑组织nesfatin-1 mRNA水平测定 在普食喂养及高脂喂养的大鼠第三脑室分别注入人工脑脊液(10 μl/只)、Ad-shGFP(109PFU/只)、Ad-shNUCB2(109PFU/只),7 d后,留取各组大鼠中枢组织,利用Trizol提取组织总RNA,逆转录为 cDNA,采用SYBR GreenⅡ荧光染料(Takara公司,日本)通过实时荧光定量PCR法检测脑组织nesfatin-1 mRNA表达水平。结果以 Ct值表示,以 β-actin基因作为内参,用 2-△△Ct计算脑组织目的基因nesfatin-1 mRNA相对表达水平。其中引物序列如下:nesfatin-1:上游引物:5'-TTTGAACACCTGAACCACCA-3';下游引物:5'-TGCAAACTTG GCTTCTTCCT-3';β-actin上游引物:5'-CCCTGAACCCTAAGGCCAACCGTGAAAA-3';下游引物:5'-TCTCCG GAGTCCATCACAATGCCTGTG-3'。
1.10 免疫组化检测脑组织nesfatin-1蛋白水平 4%多聚甲醛固定、石蜡包埋的大鼠脑组织进行切片、脱蜡,3%过氧化氢孵育 15 min,5%胎牛血清白蛋白(BSA)室温封闭25 min,兔抗大鼠nesfatin-1单克隆抗体(Abcam,英国)4℃孵育过夜,利用磷酸盐缓冲液(PBS)轻缓洗涤3次,进行辣根过氧化物酶标记的羊抗兔二抗室温孵育1 h,之后按照说明说进行二氨基联苯胺(DAB)显色。
1.11 统计学方法 采用SPSS19.0软件包进行t检验及单因素方差分析。
2 结果
2.1 各组大鼠基础生化指标及摄食比较 大鼠禁食12 h后,NCA组、NCG组和 NCN组大鼠空腹血糖(FBG)、空腹胰岛素(FIns)、FFA、TG、TC、LDL-C 及HDL-C无显著差异,同样,以上所测指标在HFA组、HFG组和HFN组间也无显著差异(均P>0.05)。而与NCA组相比,HFA组、HFG组及HFN组FIns、FFA、TG、TC及LDL-C显著增加(均P<0.05),HDL-C显著降低(均P<0.05)。FBG在各组间均无显著性差异(表1)。与NCA组相比,中枢输注Ad-shNUCB2能够显著抑制大鼠脑组织nesfatin-1的mRNA及蛋白表达(图1,表2);此外,在普食喂养下或者高脂喂养下,中枢输注Ad-shNUCB2能够显著增加大鼠摄食,于第3天达至高峰;然而,体重变化无统计学差异(表2)。
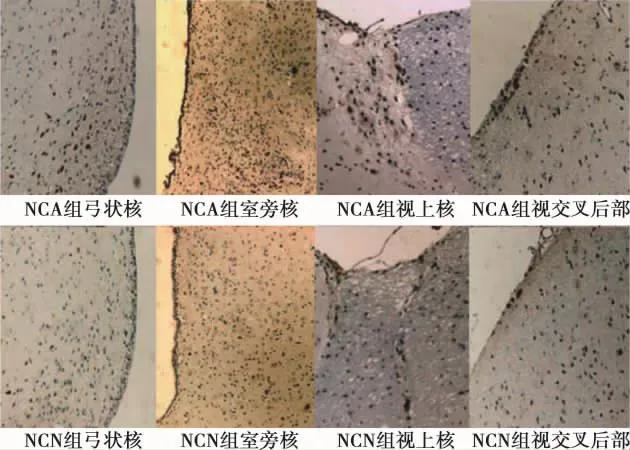
图1 各组脑组织不同区域nesfatin-1蛋白表达(DAB,×100)
表1 各组大鼠基础生化指标比较(,n=10)
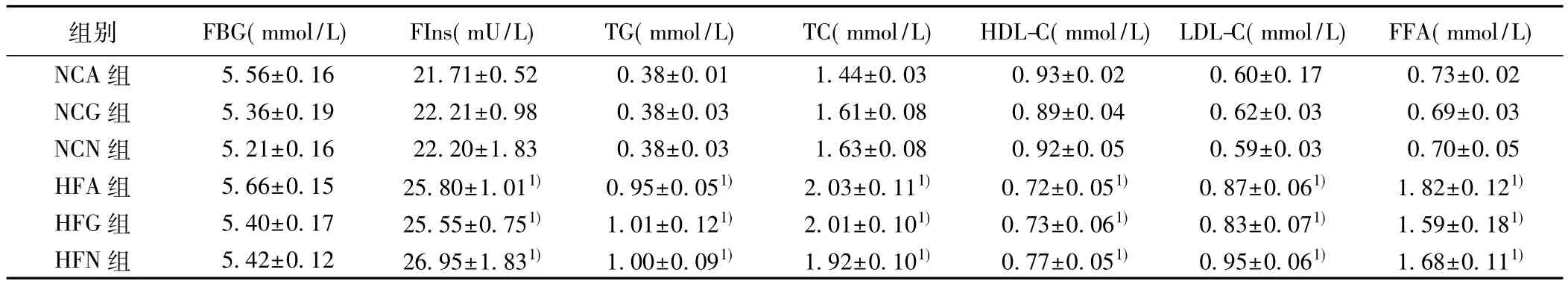
表1 各组大鼠基础生化指标比较(,n=10)
与NCA组比较:1)P<0.01,下表同
组别 FBG(mmol/L) FIns(mU/L) TG(mmol/L) TC(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L) FFA(mmol/L)NCA 组 5.56±0.16 21.71±0.52 0.38±0.01 1.44±0.03 0.93±0.02 0.60±0.17 0.73±0.02 NCG 组 5.36±0.19 22.21±0.98 0.38±0.03 1.61±0.08 0.89±0.04 0.62±0.03 0.69±0.03 NCN 组 5.21±0.16 22.20±1.83 0.38±0.03 1.63±0.08 0.92±0.05 0.59±0.03 0.70±0.05 HFA 组 5.66±0.15 25.80±1.011) 0.95±0.051) 2.03±0.111) 0.72±0.051) 0.87±0.061) 1.82±0.121)HFG 组 5.40±0.17 25.55±0.751) 1.01±0.121) 2.01±0.101) 0.73±0.061) 0.83±0.071) 1.59±0.181)HFN 组 5.42±0.12 26.95±1.831) 1.00±0.091) 1.92±0.101) 0.77±0.051) 0.95±0.061) 1.68±0.111)
表2 各组中枢输注Ad-shNUCB2后nesfatin-1 mRNA、体重和摄食比较(,n=10)
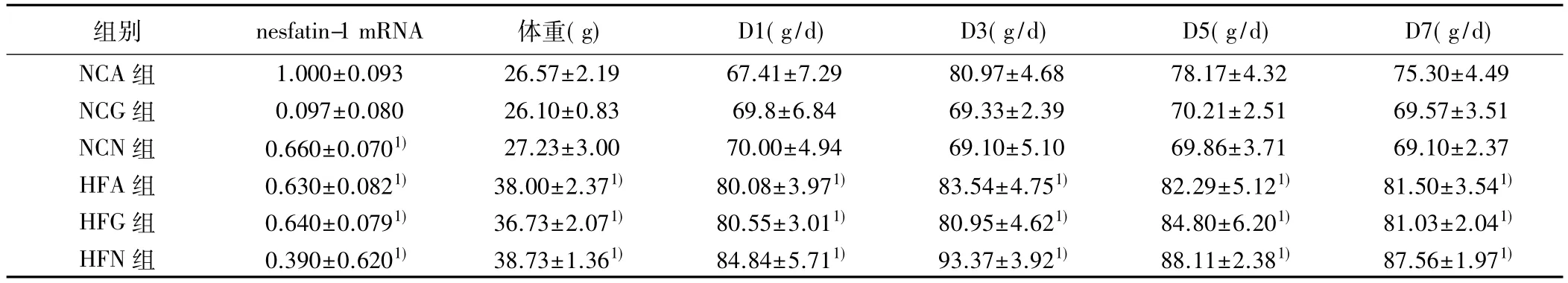
表2 各组中枢输注Ad-shNUCB2后nesfatin-1 mRNA、体重和摄食比较(,n=10)
组别 nesfatin-1 mRNA 体重(g) D1(g/d) D3(g/d) D5(g/d) D7(g/d)NCA 组 1.000±0.093 26.57±2.19 67.41±7.29 80.97±4.68 78.17±4.32 75.30±4.49 NCG 组 0.097±0.080 26.10±0.83 69.8±6.84 69.33±2.39 70.21±2.51 69.57±3.51 NCN 组 0.660±0.0701) 27.23±3.00 70.00±4.94 69.10±5.10 69.86±3.71 69.10±2.37 HFA 组 0.630±0.0821) 38.00±2.371) 80.08±3.971) 83.54±4.751) 82.29±5.121) 81.50±3.541)HFG 组 0.640±0.0791) 36.73±2.071) 80.55±3.011) 80.95±4.621) 84.80±6.201) 81.03±2.041)HFN 组 0.390±0.6201) 38.73±1.361) 84.84±5.711) 93.37±3.921) 88.11±2.381) 87.56±1.971)
2.2 正葡萄糖高胰岛素钳夹术中各生化指标的变化
钳夹稳态期,各组FBG均维持在4.5~5.5 mmol/L。外源性给予同样的胰岛素输注率,血浆FIns升高到基础值的4~6倍。与NCA组相比,HFA组、HFG组和HFN组血浆FIns水平显著增高(P<0.01),而NCA、NCG和NCN组之间,HFA组、HFG组及HFN组之间血浆FIns水平没有显著差异(P>0.05)。钳夹稳态中,各组 TG、TC、FFA、LDL-C水平均受到明显抑制(P<0.01)。但HFA组、HFG组及HFN组上述指标仍显著高于NCA组(均P<0.01),而NCA和NCN组之间,HFA组、HFG组及HFN组之间血脂水平没有显著差异(均 P>0.05),见表 3。
表3 高胰岛素钳夹术稳态期各组大鼠生化指标比较(,n=10)
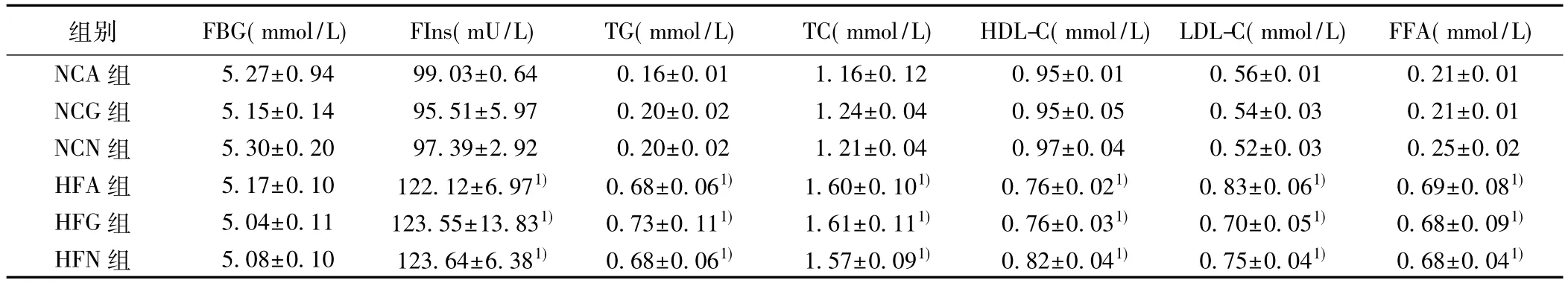
表3 高胰岛素钳夹术稳态期各组大鼠生化指标比较(,n=10)
组别 FBG(mmol/L) FIns(mU/L) TG(mmol/L) TC(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L) FFA(mmol/L)NCA 组 5.27±0.94 99.03±0.64 0.16±0.01 1.16±0.12 0.95±0.01 0.56±0.01 0.21±0.01 NCG 组 5.15±0.14 95.51±5.97 0.20±0.02 1.24±0.04 0.95±0.05 0.54±0.03 0.21±0.01 NCN 组 5.30±0.20 97.39±2.92 0.20±0.02 1.21±0.04 0.97±0.04 0.52±0.03 0.25±0.02 HFA 组 5.17±0.10 122.12±6.971) 0.68±0.061) 1.60±0.101) 0.76±0.021) 0.83±0.061) 0.69±0.081)HFG 组 5.04±0.11 123.55±13.831) 0.73±0.111) 1.61±0.111) 0.76±0.031) 0.70±0.051) 0.68±0.091)HFN 组 5.08±0.10 123.64±6.381) 0.68±0.061) 1.57±0.091) 0.82±0.041) 0.75±0.041) 0.68±0.041)
2.3 稳态时糖代谢各指标比较 钳夹稳态时,与NCA组相比,HFA组 GIR及 GRd明显下降(P<0.05),与NCA、NCG组分别相比,NCN 组GIR、GRd明显下降(均P<0.05);同样与HFA、HFG组分别相比,HFN组 GIR、GRd显著下降(均 P<0.05)。AdshNUCB2中枢干预显著增加大鼠肝糖生成(HGP),与NCA、NCG组分别相比,NCN组HGP明显升高(均P<0.05);同样,与HFA、HFG组分别相比,HFN组 HGP增高(均P<0.05)。在钳夹稳态时,与NCA或NCG组相比,NCN组HGP抑制率明显降低;与HFA、HFG组分别相比,HFN组HGP抑制率也明显下降(均P<0.05),见表 4。
表4 钳夹稳态时各组胰岛素敏感性指标比较(,n=10)
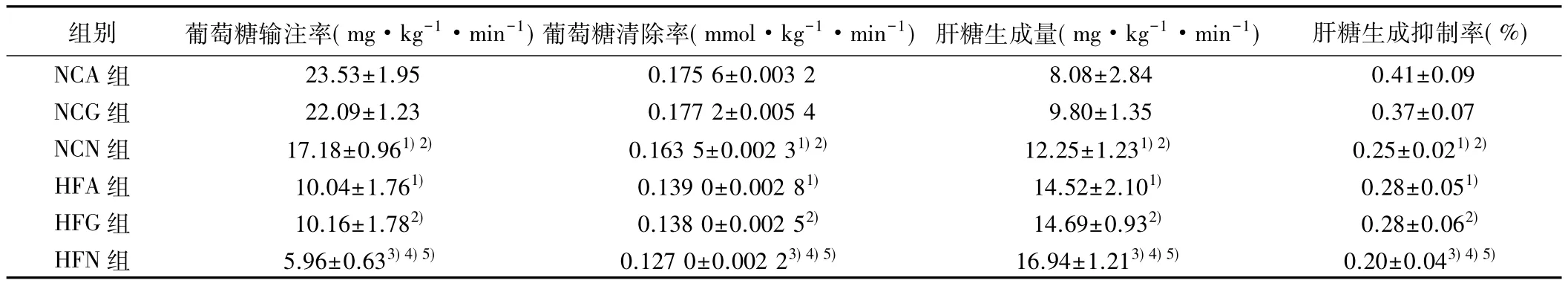
表4 钳夹稳态时各组胰岛素敏感性指标比较(,n=10)
与 NCA 组比较:1)P<0.01;与 NCG 组比较:2)P<0.01;与 HFG 组比较:3)P<0.01;与 HFG 组比较:4)P<0.01;与 NCN 组比较:5)P<0.01; 下表同
组别 葡萄糖输注率(mg·kg-1·min-1)葡萄糖清除率(mmol·kg-1·min-1) 肝糖生成量(mg·kg-1·min-1) 肝糖生成抑制率(%)NCA 组 23.53±1.95 0.175 6±0.003 2 8.08±2.84 0.41±0.09 NCG 组 22.09±1.23 0.177 2±0.005 4 9.80±1.35 0.37±0.07 NCN 组 17.18±0.961)2) 0.163 5±0.002 31)2) 12.25±1.231)2) 0.25±0.021)2)HFA 组 10.04±1.761) 0.139 0±0.002 81) 14.52±2.101) 0.28±0.051)HFG 组 10.16±1.782) 0.138 0±0.002 52) 14.69±0.932) 0.28±0.062)HFN 组 5.96±0.633)4)5) 0.127 0±0.002 23)4)5) 16.94±1.213)4)5) 0.20±0.043)4)5)
2.4 各组织葡萄糖摄取率比较 经10 w高脂喂养后,HFA组附睾脂肪、棕色脂肪、比目鱼肌和腓肠肌的GU均显著低于NCA组(均P<0.05)。而中枢nesfatin-1表达下调能显著降低大鼠肌肉及脂肪组织GU,与NCA、NCG组分别相比,NCN组附睾脂肪组织、棕色脂肪组织、比目鱼肌和腓肠肌GU均显著降低(均P<0.05);同样,与HFA、HFG组分别相比,HFA组各组织中GU均明显降低(均P<0.05)。见表5。
表5 各组葡萄糖摄取率比较(,n=10,%)
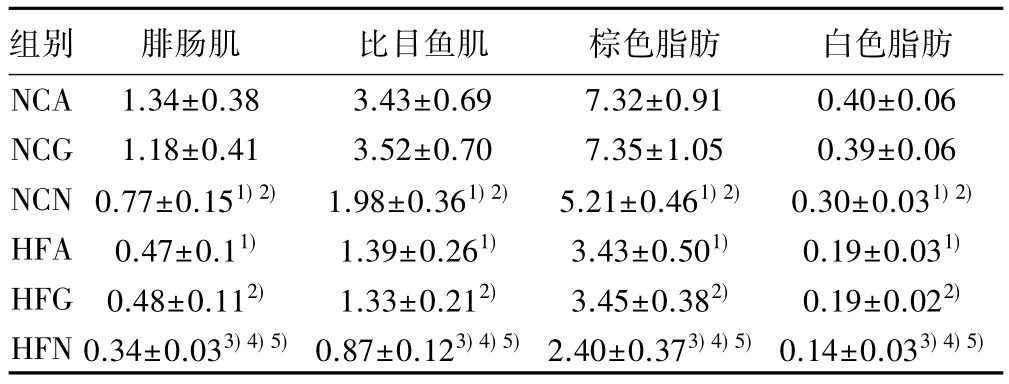
表5 各组葡萄糖摄取率比较(,n=10,%)
组别 腓肠肌 比目鱼肌 棕色脂肪 白色脂肪NCA 1.34±0.38 3.43±0.69 7.32±0.91 0.40±0.06 NCG 1.18±0.41 3.52±0.70 7.35±1.05 0.39±0.06 NCN 0.77±0.151)2) 1.98±0.361)2) 5.21±0.461)2) 0.30±0.031)2)HFA 0.47±0.11) 1.39±0.261) 3.43±0.501) 0.19±0.031)HFG 0.48±0.112) 1.33±0.212) 3.45±0.382) 0.19±0.022)HFN 0.34±0.033)4)5)0.87±0.123)4)5)2.40±0.373)4)5)0.14±0.033)4)5)
3 讨论
nesfatin-1是新发现由NUCB2 N端水解产生的82个氨基酸所组成的肽段,分子量为9.7×103。NUCB2由一组高度保守的蛋白质组成,包括24个氨基酸组成的氨基末端信号肽和396个氨基酸序列〔1〕。nesfatin-1广泛分布于下丘脑、胰岛β细胞、脂肪组织等〔8〕。下丘脑作为生命活动的中枢。下丘脑的一系列核团,例如室旁核、弓状核、腹内侧核、视上核等形成复杂和相互影响的网络,分泌相关细胞因子和蛋白调节营养摄入及能量代谢〔9,10〕。然而,作为中枢作用因子,中枢nesfatin-1调节机体胰岛素敏感性及葡萄糖代谢的具体机制尚不完全清楚。本研究首次证实中枢nesfatin-1表达抑制能够明显抑制外周组织对机体葡萄糖的摄取与利用,促进肝糖产生,加重机体胰岛素抵抗程度。
研究显示,大鼠第三脑室、第四脑室内输注nesfatin-1可抑制大鼠夜间摄食行为,而长期输注nesfatin-1可导致大鼠体质量下降,尤其是脂肪组织明显减少〔1,3,11,12〕。与正常人群相比,2 型糖尿病患者及糖调节受损者空腹血浆nesfatin-1水平显著降低,表明nesfatin-1可能与胰岛素敏感性及糖代谢有关〔13〕。本课题组前期通过向高脂大鼠第三脑室内短期输注nesfatin-1重组蛋白,研究发现大鼠肝脏糖异生明显被抑制,同时肝脏胰岛素敏感性显著提高〔4〕,此外中枢nesfatin-1表达下调能够明显促进肝糖异生调控基因表达,抑制机体胰岛素作用信号通路〔14〕,然而,对于中枢nesfatin-1表达下调对机体肝糖产生及系统胰岛素敏感性的影响尚未有报道。
本研究提示高脂喂养大鼠出现肥胖、胰岛素抵抗和脂代谢紊乱,扩展胰岛素钳夹术中发现,在相同的外源胰岛素输注下,为维持稳定的血糖水平,机体外源性葡萄糖的需要量明显减少,即机体胰岛素的敏感性降低;且胰岛素对肝糖的抑制作用显著降低,说明肝胰岛素敏感性同样降低,中枢nesfatin-1低表达显著降低机体外周组织葡萄糖摄取率。这些结果充分说明,中枢nesfatin-1表达下调能同时降低肝和外周组织胰岛素敏感性。然而,长期的中枢nesfatin-1信号改变对机体胰岛素敏感性的影响尚需进一步研究。研究发现大鼠脑室内长期输注nesfatin-1,能够在减少夜间摄食行为的同时降低大鼠体质量,并导致机体脂肪含量减少〔1〕,本研究结果与文献报道一致,向SD大鼠脑室内输注Ad-shNUCB2后,中枢nesfatin-1表达下调能够增加摄食,然而,大鼠体重没有明显变化,这可能与本研究干预时间较短相关。FFA、TG、TC、LDL-C及HDL-C与对照组相比无显著差异,提示短期下丘脑nesfatin-1表达下调对脂代谢影响不大。然而,nesfatin-1是否对脂代谢产生影响仍需进一步研究。

