高糖对人视网膜微血管内皮细胞炎症因子和线粒体功能的影响及津力达联合通心络的保护作用
位 庚 邢玉微 申瑞霞 郭会敏 梁俊清 姚 兵 郭志方(石家庄市第二医院,河北 石家庄 05005)
糖尿病视网膜病变(DR)为糖尿病初期最为严重的微血管并发症之一,主要病理改变是眼底血管结构发生改变,出现微动脉瘤、渗出或新生血管形成;患者视力、视野明显减退,甚者失明。非增殖期DR通过积极的药物治疗是可以逆转的,而到出现新生血管等增殖期病变时则无法逆转。中医药治疗DR非增殖期疗效明显〔1,2〕。本课题组前期的临床研究已显示津力达联合通心络对非增殖期DR有较好的疗效,但其作用机制尚不明确〔3〕。视网膜微血管由单层内皮细胞组成,本研究分析人视网膜微血管内皮细胞(HRCECs)高糖诱导损伤及津力达(JLD)联合通心络(TXL)对该损伤的干预作用及其作用机制。
1 材料与方法
1.1 材料 HRCECs购自美国Sciencell公司。JLD及TXL药粉由石家庄以岭药业股份有限公司提供;内皮细胞培养基(ECM)(美国Sciencell公司);细胞计数试剂盒(CCK-8,日本同仁化学研究所);白细胞介素(IL)-6及细胞间黏附分子(ICAM)-1试剂盒(南京建成生物工程研究所);JC-1线粒体膜电位分析试剂盒(美国Cayman公司);细胞色素(Cyt)C抗体(美国Santa Cruz公司);核转录因子(NF)-κB p65抗体(美国Abcam公司)。Primo Vert倒置显微镜(德国Zeiss公司);Forma371细胞培养箱(美国Thermo Electron公司);SW-CJ-ZFD生物洁净工作台(苏州安泰空气技术有限公司);多功能酶标仪(美国Bio Tek公司);UVP凝胶扫描系统(美国UVP公司);电转膜仪、半干转膜仪、垂直电泳仪(美国Bio-Rad公司)。
1.2 药物配制 配制JLD及TXL工作液〔4〕。
1.3 细胞分组及处理 取对数生长期HRCECs,胰蛋白酶消化后将细胞接种于直径为6 cm的细胞培养皿或96孔细胞培养板中,使细胞密度为1.0×105个/ml,培养箱中培养细胞融合至80%用于实验。细胞被随机分为以下5组(每组平行设置3~4个复孔),(1)正常对照组:正常培养的HRCECs弃去原培养基,换为无血清ECM培养基;(2)模型组:正常培养的HRCECs弃去原培养基,换为含30 mmol/L葡萄糖的ECM无血清培养基;(3)JLD组:正常培养的HRCECs弃去原培养基,换为含JLD 200 μg/ml无血清ECM培养基预孵育4 h后,换为含葡萄糖30 mmol/L加 JLD 200 μg/ml的无血清 ECM培养基;(4)TXL组:正常培养的HRCECs弃去原培养基,换为含 TXL 100 μg/ml的无血清 ECM培养基预孵育4 h后,换为含葡萄糖30 mmol/L加TXL 100 μg/ml的无血清 ECM 培养基;(5)JLD+TXL组:正常培养的HRCECs弃去原培养基,换为含 JLD 200 μg/ml加 TXL 100 μg/ml预孵育 4 h,换为含葡萄糖 30 mmol/L加 JLD 200 μg/ml加 TXL 100 μg/ml的无血清ECM培养基。以上5组细胞处理完毕后置于37℃、5%CO2的培养箱中培养48 h后待检测。
1.4 CCK-8检测HRCECs生存活性 接种于96孔细胞培养板的HRCECs按照1.3处理后,吸弃原培养基,每孔加入含CCK-8的无血清ECM培养基100 μl,放入细胞培养箱中继续孵育1 h后酶标仪检测450 nm波长处OD值。以各组OD值与正常对照组的比值行统计分析。
1.5 ELISA检测HRCECs上清液中IL-6和ICAM-1含量 接种于96孔细胞培养板的HRCECs按1.3处理后,收集各组细胞上清液,1.5 ml无菌 EP管中1 000 r/min离心2 min取上清液。ELISA检测各组细胞上清液中IL-6和ICAM-1含量,操作严格按照说明书。
1.6 JC-1试剂盒测定细胞中线粒体膜电位(MMP)接种于96孔细胞培养板的RCMECs按1.3处理后,JC-1 MMP分析试剂盒测定,操作步骤严格按照试剂盒说明书进行。
1.7 Western印迹法检测NF-κB、CytC蛋白表达 接种于直径为6 cm细胞皿的HRCECs按1.3处理后,生理盐水冲洗2次,吸弃生理盐水,培养皿内加入40 μl细胞裂解液于冰上充分裂解20 min,超声破碎后放入4℃离心机内,以12 000 r/min离心20 min,收集上清液,取2 μl进行蛋白定量后,取等量蛋白样品进行聚丙烯酰胺凝胶电泳,约5 h后电泳结束,取下凝胶进行半干转膜,约1 h后转膜完成,于封闭液中封闭2 h,一抗孵育,至于摇床上4℃过夜,洗膜后与二抗结合1 h,洗膜后用化学发光法检测抗体结合区带,以GAPDH作为内参,将各目的蛋白吸光度值与GAPDH吸光度值的比值进行统计学分析。
1.8 统计学处理 采用SPSS19.0统计软件进行单因素方差分析,若方差齐时采用最小显著差法(LSD),若方差不齐采用Dunnett T3法。
2 结果
2.1 生存活性 与正常对照组比较,模型组细胞生存活性明显降低(P<0.01);与模型组比较,JLD组、TXL组及JLD+TXL组细胞生存活性均明显升高(P<0.01);与JLD组、TXL组比较,JLD+TXL组细胞生存活性明显升高(P<0.05)。见表1。
2.2 高糖损伤HRCECs上清液IL-6和ICAM-1含量与正常对照组比较,模型组细胞上清液中IL-6和ICAM-1含量明显升高(P<0.01);与模型组比较,JLD组、TXL组及JLD+TXL组细胞上清液中IL-6和ICAM-1含量明显降低(P<0.01);与JLD组比较,JLD+TXL组细胞上清液中IL-6含量明显降低(P<0.05),TXL组及JLD+TXL组ICAM-1含量明显降低(P<0.01)。见表1。
2.3 高糖损伤HRCECs MMP 与正常对照组比较,模型组细胞MMP明显降低(P<0.01);与模型组比较,TXL组及JLD+TXL组细胞MMP明显升高(P<0.01);与JLD组比较,TXL组、JLD+TXL组细胞MMP明显升高(P<0.01),与TXL组比较,JLD+TXL组细胞MMP明显升高(P<0.05)。见表1。
2.4 高糖损伤HRCECs NF-κB、CytC蛋白表达 与正常对照组比较,模型组细胞NF-κB、CytC蛋白表达明显上调(P<0.01);与模型组比较,JLD组、TXL组及JLD+TXL组细胞NF-κB、CytC蛋白表达明显下调(P<0.01);与 JLD 组比较,JLD+TXL 组细胞 NF-κB、CytC蛋白表达明显下调(P<0.01)。见表1,图1。
表1 各组HRCECs生存活性、细胞上清液IL-6、ICAM-1含量、MMP、NF-κB及CytC蛋白表达比较(,n=4)

表1 各组HRCECs生存活性、细胞上清液IL-6、ICAM-1含量、MMP、NF-κB及CytC蛋白表达比较(,n=4)
与正常对照组比较:1)P<0.01;与模型组比较:2)P<0.01;与JLD组比较:3)P<0.01,4)P<0.05;与TXL组比较:5)P<0.05
组别 生存活性(%) IL-6(pg/ml) ICAM-1(pg/ml) MMP NF-κB CytC正常对照组 100.00±2.19 21.49±2.31 140.27±8.59 3.17±0.12 0.14±0.02 0.10±0.05模型组 42.71±9.761) 56.78±5.821) 211.36±11.711) 1.56±0.181) 0.58±0.041) 0.31±0.071)JLD 组 63.99±4.322) 46.98±2.542) 187.13±6.272) 1.80±0.08 0.38±0.052) 0.23±0.062)TXL 组 65.68±4.452) 42.98±5.462) 163.67±10.032)3) 2.07±0.202)3) 0.32±0.052) 0.16±0.042)JLD+TXL 组 74.33±3.722)4)5) 39.55±3.792)4) 157.12±12.022)3) 2.53±0.192)3)5) 0.26±0.032)3) 0.12±0.042)3)
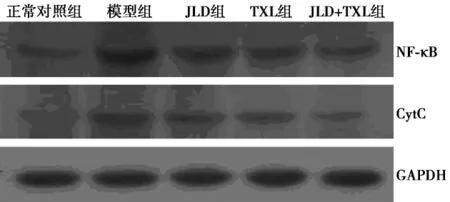
图1 各组HRCECs NF-κB、CytC蛋白表达
3 讨论
吴以岭院士创建的脉络学说指导从“脾”论治消渴(糖尿病),提出“运脾津、通脾络”的消渴新治法,其治疗的代表药物为JLD颗粒和TXL胶囊〔5〕。已有实验研究将JLD联合TXL用于保护胰岛微血管内皮细胞,结果显示其保护机制与减轻氧化应激反应有关〔4〕。亦有临床研究显示JLD颗粒联合TXL胶囊能有效降低糖尿病肾病患者尿蛋白、改善肾功能〔6〕。视网膜血管属于微血管范畴,属中医学“络脉”,而视网膜微血管的病变则属“络病”范畴。胰岛微血管、肾脏微血管与视网膜微血管同为微血管。
DR为糖尿病的常见并发症,已成为主要致盲眼病之一。近年实验研究发现,DR的发生发展过程中炎症起到了重要的作用,该观点的提出为治疗DR提供了新方向〔7〕。NF-κB是细胞内调节炎症信号转导的关键因子之一,能够调控包括IL-6和ICAM-1在内的多种炎症细胞因子的基因转录表达〔8〕。IL-6作为前炎症因子,在炎症反应中起着重要的作用〔9〕。IL-6可上调内皮细胞ICAM-1等的表达〔10〕。生存活性的提高是保证血管内皮细胞发挥正常功能的基础条件。本文中高糖诱导的HRCECs中NF-κB蛋白表达明显上调,表明细胞内炎症调节因子被激活,产生了炎症反应。被NF-κB蛋白调控的炎症因子IL-6和ICAM-1,经高糖损伤后其细胞上清液中同样表现出含量增加的趋势,JLD和TXL均能提高高糖损伤的HRCECs生存活性、抑制高糖引起的炎症反应,二者联合使用其效果更优。线粒体存在于大多数细胞中,细胞的有氧呼吸主要在此进行,对细胞受到的损伤较为敏感。已有研究显示,高糖可损伤内皮细胞的线粒体,是细胞凋亡的机制之一。高糖等损伤因素可使线粒体通透性转换孔保持持续开放,通透性增加,MMP下降,导致跨膜的氢离子浓度梯度消失,引起呼吸链脱耦联,此时线粒体发生渗透性水肿,外膜破裂,使存在于线粒体内的CytC释放入胞质〔11〕,导致线粒体内的CytC减少,直接造成了线粒体内呼吸链电子传递的中断,抑制氧化磷酸化,促进了氧自由基的生成,继而ATP含量减少,可最终导致细胞损伤乃至坏死〔12〕。本研究说明JLD联合TXL可有效逆转线粒体的损伤状态。综上,高糖可诱导HRCECs产生炎症反应及损伤线粒体功能,JLD联合TXL可抑制该过程,其作用机制可能与减轻NF-κB的活化,进而减少炎症因子的释放及保护线粒体功能有关。

