持续性心房颤动模型犬左心房肌HCN2和HCN4通道表达变化
张 健 李发鹏 何 卫 李耀东 甘天翊 汤宝鹏 (新疆医科大学第一附属医院心脏中心,新疆 乌鲁木齐 830054)
心房颤动也称心房纤颤,简称房颤,其发病率会随着年龄的增长逐渐增长〔1〕,尤其在老年人群中发病率较中青年人群明显增高〔2,3〕。房颤危害程度很高,极容易形成血栓导致脏器受损或致残。因此,迫切需要研究其发病机制,进而从分子生物学水平为临床提供有力的证据支持。
无论是阵发性房颤还是持续性房颤,最终均有可能发展成永久性房颤。阵发性房颤如果持续发生,也会变为持续性房颤,即所谓“房颤诱发房颤 ”机制〔4〕,并且这一发展过程往往会呈一种进行性发展趋势。因此,笔者认为房颤发生的本质是心房电重构〔4〕。既往研究显示〔5〕,房颤发生过程中,由于心房电生理和结构发生了一系列改变,进而使得房颤波发生或复发,进而形成心房重构。电重构指的是心房肌的心肌细胞由于动作电位的时程变化进而导致的离子通道改变,由于离子通道改变进而导致心房肌细胞结构发生改变〔4〕,这一特征为电重构的早期表现。Lubitz等〔5,6〕曾先后提出心房电重构的概念,奠定了房颤心房电重构的理论。研究证实〔6〕,电重构的基础是离子通道的重构,而超极化激活环核苷酸门控(HCN)通道能使心房肌或心室肌的自律性增高,并且HCN通道与心律失常的发生和维持有着密切联系。HCN通道的研究目前逐渐成为预防心律失常的一个新热点。本研究分析持续性房颤形成过程中心房肌HCN2和HCN4通道表达的改变,进而从分子生物学水平阐释持续性房颤的发生与HCN2和HCN4通道之间的关系。
1 材料和方法
1.1 实验动物 健康雌雄各半比格犬12只,体重12~15.5 kg,平均(15.1±2.4)kg,平均年龄(1.4±0.6)岁。分为持续性房颤模型犬(实验组)6只,平均年龄(1.48±0.45)岁,平均体重(14.3±2.6)kg;窦性心律模型犬(对照组)6只,平均年龄(1.46±0.36)岁,平均体重(14.7±2.1)kg。新疆医科大学第一附属医院动物实验中心已经通过AAALAC认证,全部实验犬由新疆医科大学第一附属医院动物实验中心提供。
1.2 实验方法
1.2.1 动物的准备和麻醉 健康比格犬禁食水12 h,使用盐酸氯胺酮注射液行基础麻醉,然后将比格犬背部朝下,肚皮朝上,用绷带将四肢固定在大动物手术台上。调整好呼吸机参数,麻醉后的比格犬行气管插管,外接呼吸机辅助呼吸,同时持续使用麻醉药及肌松药维持麻醉状态并使其处于肌松状态〔7〕。胸部剃毛后贴电极片,采心电图,四肢接自制医用银针,将银针刺入四肢皮下组织,外接监护仪。实验过程需密切监测比格犬的生命体征。
1.2.2 持续性房颤犬模型的制作 犬四肢固定、消毒、铺洞巾。从胸骨右侧第4~5肋间隙进行切口,用开胸器沿肋骨间隙将肋骨撑开。将心包剪开,在右心耳底部固定起搏电极,测试起搏的电压阈值及电极阻抗,电压阈值应该小于 1 mV,阻抗应该在 500~1 000 Ω。分离囊袋后将动物用高频心脏起搏器与已经测试合格的起搏器电极相连,用磁铁在体外开启起搏器,心电图证实起搏器开启正常,然后予600次/min的频率连续起搏8 w〔8〕。窦性心律组仅作开胸手术植入起搏器,不开启起搏器。
1.2.3 诱发房颤 模型犬在该院动物养育中心认真喂养,8 w后关闭起搏器。如果关闭起搏器后有房颤则为自发性房颤,这种模型犬可以立刻用于实验。如果8 w后关闭起搏器无法诱发房颤,则需要诱发房颤。心脏电生理检查基本技术和方法中程序刺激分三种:①分级递增刺激;②短阵快速刺激(Burst刺激);③程序期前刺激。本文诱发房颤的方法为Burst刺激法。首先分别使用400 ms和300 ms的驱动周长作为诱发的期前程序刺激,这种刺激也被称为S1S1。之后需要心房有效不应期加上30 ms的S1S2反扫,心脏电生理检查反扫步长的时间为10 ms。如果以上方法仍旧无法诱发房颤,则需要引用S3,引用的S3与S2一起构成S2S3,同样以10 ms的步长进行反扫,但是需要注意,在组成S2S3时,它的间期应该从S1S2的80%开始。以此方法,如果仍旧不能诱发房颤,需要引入S4,反扫方法同前所述。如果通过以上方法仍无房颤发生,应加大舒张期阈值,强度可以设置为正常值的2倍,只有持续时间大于15 min的房颤才能定义为持续性房颤,诱发时间不足15 min的房颤只能定义为阵发性房颤〔9〕。本实验的模型犬需要诱发时间大于15 min以上的房颤,即持续性房颤。
1.2.4 采集标本 实验结束后迅速开胸,本着人道主义方法获取犬心脏标本。将实验组及对照组犬的心脏固定,用止血钳夹住心脏大血管,快速使用手术剪紧靠止血钳剪下心脏,分别将左右心房和左右心室分离。本实验使用犬的心房组织,将左心耳从心房组织中分离,迅速放入冻存管中标注清楚,之后快速投入液氮中速冻,-80℃超低温冰箱冻存备用。
1.2.5 实时荧光定量PCR检测左心房肌HCN2和HCN4通道的表达 (1)-80℃超低温冰箱中取去除血液及脂肪组织的左心耳标本共100 mg,由Invitrogen公司提供的Trizol提取总RNA。取2 μg总RNA逆转录成cDNA,逆转录试剂盒由Promega公司A3500提供。(2)引物设计与合成:由TaKaRa公司合成引物,其中引物的设计和合成详见文献〔10〕。(3)进行Real-time PCR反应,反应体系由上海睿安生物提供:cDNA 2 μl,SybrGreen qPCR Master Mix 12.5 μl,上、下游引物各 0.5 μl,ddH2O 9.5 μl。(4) 反应条件:预变性95℃,2 min;变性 95℃ 10 s,进入 PCR 循环,共 40个循环〔10〕。退火温度在 HCN2,61℃;HCN4,56℃;β-actin,60℃;30 s;40 s的延伸。HCN2、HCN4 作为目标基因,它们的mRNA相对表达含量依据Ct值计算得出。HCN2 产物 片段 141 bp;HCN4,208 bp;β-actin,186 bp。(5)配制双层聚丙烯酰胺凝胶,通过BIO-RAD凝胶成像获得电泳图:使用5 μl用2%琼脂糖凝胶,将目标基因PCR产物进行电泳成像,之后再行扫描成像,获得的电泳图便是目标基因产物的电泳图。
1.2.6 Western印迹检测左心房肌HCN通道各蛋白的表达 首先浸膜,之后将带有膜的封闭液置于摇床上1 h,最佳温度20~25℃。组织总蛋白提取试剂盒,北京索来宝公司提供。将膜与HCN2和HCN4通道蛋白特异性一抗即兔抗IgG混合,一抗由英国Abcam公司生产,稀释比例1∶2 000;之后需要孵育,孵育后洗膜3次,将洗好的膜与辣根过氧化物酶(HRP)标记的特异性二抗(即山羊抗兔-IgG,由武汉博士德公司提供)结合进行孵育特异对照产物β-actin通道蛋白特异性一抗是兔抗IgG,由武汉博士德公司提供,其他反应及孵育条件相同。
组织总蛋白提取试剂盒和一抗及二抗均严格按照操作说明书进行,按照聚氰基丙烯酸正丁酯(BCA)法测定总蛋白含量。十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离总蛋白,然后将胶上的蛋白通过电转印迹到硝酸纤维素膜(NC)膜上。5%脱脂奶粉/Tris缓冲盐溶液(TBS)液封闭、洗脱后,分别加入特异性一抗进行杂交,4℃孵育过夜,经特异性二抗(山羊抗兔-IgG,武汉博士德公司)孵育1 h,进行二氨基联苯胺(DBA)显色,BIO-RAD凝胶成像系统进行扫描定量。每张膜需要依据内参值测定目标值表达含量,目标基因HCN2(或HCN4)的蛋白相对表达含量为HCN2吸光度值/β-actin吸光度值。
1.3 统计学分析 采用SPSS16.0软件行t检验。
2 结果
2.1 模型完成情况 12只犬全部顺利完成实验。模型组在快速起搏8 w后3只出现自发性房颤,5只诱发出持续性房颤,Burst刺激全部(100%)诱发持续性房颤,平均房颤持续时间(51±13)min。
2.2 HCN通道各亚单位的PCR产物 扩增出的产物未发现HCN1表达,而β-actin、HCN2、HCN4的PCR产物的电泳带位置分别位于152 bp、143 bp、132 bp,与理论值相符。见图1。

图1 目标基因电泳图
2.3 HCN通道各亚单位的mRNA表达 与对照组相比,实验组心房肌中HCN2、HCN4 mRNA表达增高,差异有统计学意义(P<0.05),见表1。
表1 两组心房肌HCN2 HCN4 mRNA表达水平比较(,n=6)
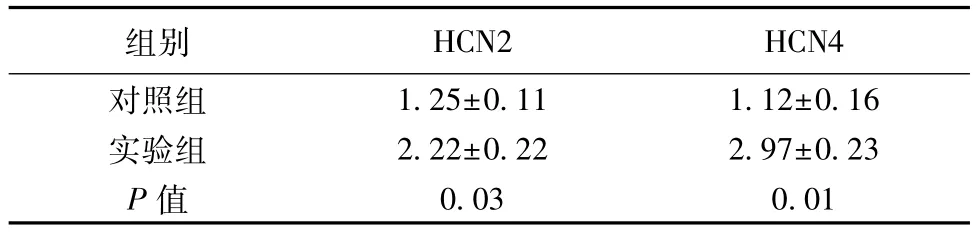
表1 两组心房肌HCN2 HCN4 mRNA表达水平比较(,n=6)
组别 HCN2 HCN4对照组 1.25±0.11 1.12±0.16实验组 2.22±0.22 2.97±0.23 P值 0.03 0.01
2.4 两组心房肌HCN2和HCN4通道蛋白表达 实验组心房肌组织中HCN2、HCN4蛋白含量明显高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组心房肌HCN2和HCN4通道蛋白表达水平比较(,n=6)

表2 两组心房肌HCN2和HCN4通道蛋白表达水平比较(,n=6)
组别 HCN2 HCN4对照组 0.27±0.04 0.42±0.06实验组 0.51±0.06 0.68±0.11 P值 0.03 0.01
3 讨论
HCN通道又称超级化激活环核苷酸门控阳离子通道,与环核苷酸门控(CNG)通道具有高度的同源性;两者均为细胞膜上的一种特殊结合蛋白,前者可以控制Na+和K+通道,即钠-钾通道,后者可以控制钾通道。该通道各亚基具有高度选择的亲水性,通过控制钠、钾通道闸门的开启和关闭过程进而控制HCN通道的开放和关闭。HCN通道目前有4个亚基(HCN1、HCN2、HCN3、HCN4),6个跨膜片段,其中 S4 为电压感受器〔11〕,通过控制离子流还可以掌控通道的激活、失活和关闭状态。在每个亚基的6个跨膜片段中有2个跨膜片段是离子通透孔道,C端的环核苷酸结合区域CNBD可以与环磷酸腺苷(cAMP)结合,通过结合cAMP反过来进一步调节HCN通道,达到一种共同作用的效果。
虽然HCN通道是电压依赖性门控通道,具有其独特的电生理特性〔12〕,但HCN通道的所有亚基均具有4个基本的共同特征:超极化激活特征,能被铯离子阻断的特征,电流均可以通过K+和Na+离子共同携带的特征,可受(cAMP)反向调控的特征〔13~16〕。If电流是心脏起搏电流的重要组成部分〔10〕,HCN通道和野生型If离子通道有相似的分子生物学结构和通道动力学特征。既往研究发现,在心房增大的动物模型及人的心房组织中随着If电流增大,HCN通道表达增多,由于If离子流的增大或减少,最终会导致各种心律失常。通过影响If电流进而使HCN2和HCN4 mRNA表达明显上调〔10,16〕。
本实验结果提示快速心房起搏导致了心房内的HCN通道发生重构,之后通过影响HCN2和HCN4的转录和翻译水平,使得二者的表达上调,局部心房肌的自律性增高,从而导致房颤的易发生和维持。
本实验的局限性是仅测定持续性房颤时目标基因的mRNA及蛋白水平,后期会针对房颤的离子通道电流进行研究。

