宫颈小细胞神经内分泌癌的影像学特征
李璞宸,黄 波,罗娅红,董 越,于 韬,张 毅
1.中国医科大学肿瘤医院,辽宁省肿瘤医院医学影像科,辽宁 沈阳 110042;2.中国医科大学肿瘤医院,辽宁省肿瘤医院病理科,辽宁 沈阳 110042
神经内分泌癌是一类能够摄取胺的前体并通过脱羧作用合成和分泌胺及多肽类激素的恶性肿瘤。此类肿瘤可发生于全身各部位,包括肺、胃肠道、肝、子宫颈、甲状腺、前列腺及卵巢等。1958年,Wentz和Reagan首次报道了宫颈小细胞神经内分泌癌(small cell neuroendocrine carcinoma of uterine cervix,SCNECC)。2014年世界卫生组织(World Health Organization,WHO)子宫颈肿瘤组织学分类中将SCNECC归类为高级别神经内分泌癌[1]。SCNECC是女性生殖系统肿瘤中的少见类型,属于高度恶性肿瘤[2]。SCNECC占宫颈恶性肿瘤不到5%,5年生存率仅为14%~39%,易发生淋巴结转移和脉管瘤栓,晚期治疗效果差,且易复发,预后差[3-6]。
本研究收集辽宁省肿瘤医院2005年6月—2016年11月期间经术后病理证实为SCNECC的患者临床及影像学资料,并复习文献,探讨SCNECC的影像学特征,以提高对该病的影像学认识。
1 资料和方法
1.1 一般资料
收集辽宁省肿瘤医院2005年6月—2016年11月经术后病理证实为SCNECC的患者22例,按国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)分期标准,5例为ⅠB1期,16例为ⅠB2期,1例为ⅡA1期。患者年龄29~55岁,中位年龄41岁。其中5例行超声检查,7例行CT检查,7例行磁共振成像(magnetic resonance imaging,MRI)检查。另入组宫颈鳞癌30例、宫颈腺癌20例,分别行MRI检查,作为对照。宫颈鳞癌组中ⅠA2期1例,ⅠB1期21例,ⅠB2期2例,ⅡA1期6例;宫颈腺癌组中ⅠB1期10例,ⅠB2期4例,ⅡA1期4例,ⅡA2期2例。
1.2 检查方法
1.2.1 MRI检查
采用3.0 T磁共振设备(德国Siemens公司),8通道相控阵体部线圈,采用呼吸门控技术,依次行常规MRI平扫、扩散加权成像(diffusion-weighted imaging,DWI)和动态增强扫描。部分带环者预先取下节育环,于检查前嘱咐患者饮水以适度充盈膀胱,静息15~30 min后行检查,保持呼吸平稳,以尽可能减少呼吸运动造成的干扰。扫描范围从髂骨翼上缘到耻骨联合下缘水平。平扫:横轴位T1WI,重复时间(repetition time,TR)/回波时间(echo time,TE)为550 ms/13 ms,层厚为4 mm,扫描间距为1 mm,视野(field of view,FOV)为400×400,激励次数(number of excitation,NEX)为2;横轴位、矢状位FSE T2WI加脂肪抑制序列,TR/TE为550 ms/13 ms,层厚为4 mm,扫描间距为1 mm,FOV为400×400,NEX为2。DWI扫描:横轴位SE-EPI序列(TR/TE=4 500 ms/93 ms,层厚为4 mm,FOV为400×400,扫描间距为1 mm),选取3个方向的弥散敏感梯度,弥散敏感系数b值分别取0和1 000 s/mm2。
1.2.2 CT检查
采用美国GE公司Lightspeed 16层螺旋CT,管电压120 kV,管电流300 mA,层厚5 mm,层间距5 mm,重建层厚1 mm。对比剂为碘海醇100 mL,注射速率为2.5~3.0 mL/s。扫描范围至少包括从膈肌下方至耻骨联合。平扫后经肘静脉注入对比剂约30 s后进行动脉期扫描,主要扫描肝脏;注入对比剂65~75 s后行门静脉期增强扫描,包括全腹部或胸腹部及盆腔;根据病变显示情况及诊断需要,必要时可加扫平衡期。
1.2.3 超声检查
采用美国GE公司Logiq 9、Logiq 7超声诊断仪或意大利百胜公司DU8超声诊断仪。患者均避开月经期,且检查前24 h内无宫颈操作。患者无需特殊准备,减轻憋尿痛苦。患者仰卧于检查床,检查时使膀胱保持适当充盈状态,将探头从耻骨联合之上行纵向、横向多方位扫查盆腔及宫颈,观察宫颈大小、宫颈内外口、宫颈管回声及其与周围组织器官的关系,以及病灶区域血流分布和宫颈血流分布情况,测量相关数据,记录收缩期峰值血流速度、阻力指数及相关影像资料,以供统计分析。
1.3 图像数据分析
将MRI数据传输至USiemens工作站,使用MeanCurve软件测量感兴趣区(region of interest,ROI)的表观扩散系数(apparent diあusion coeきcient,ADC)。在ADC图上分别对正常宫颈和宫颈癌病灶手动勾画ROI,ROI尽可能大,且位于病灶内。ROI大小由病灶决定,在较大范围选取病灶的同时要避开周边区域,以防止容积效应。每例患者测量3次,取平均值作为最终ADC值。本研究中MRI与CT检查结果均由2名中级职称以上并精通妇科放射影像诊断的医师解读,超声检查结果由2名有中级职称或以上并专攻妇科疾病诊断的超声科医师解读。
1.4 统计学处理
采用SPSS 17.0软件对数据进行统计分析,所有数据以表示。由于3组宫颈癌的ADC值数据不符合正态分布,所以采用Kruskal-Wallis检验进行组间两两比较,使用χ2检验对3组是否伴淋巴结转移进行分类变量资料的统计学分析,P<0.05为差异有统计学意义。
1.5 病理学方法
新鲜标本在离体30 min内切取,常规4%甲醛溶液固定,石蜡包埋,5 μm连续切片,进行H-E染色及免疫组织化学染色。
2 结 果
2.1 SCNECC的影像学表现
SCNECC组中共有7例行MRI检查。如表1所示,肿瘤体积最大值为26 250 mm3,最小值为6 409 mm3,平均体积为(18 023±7 426.07) mm3。3例表现为肿块型。按2009版FIGO分期标准,7例中1例为ⅠB1期,5例为ⅠB2期,1例为ⅡA1期。4例表现为盆腔淋巴结多发肿大。T1WI中2例表现为等信号,1例表现为低信号;T2WI中3例表现为稍高信号。DWI均表现为扩散受限明显,呈高信号。除7例未做MRI增强检查外,其余均表现为不均匀强化(图1)。
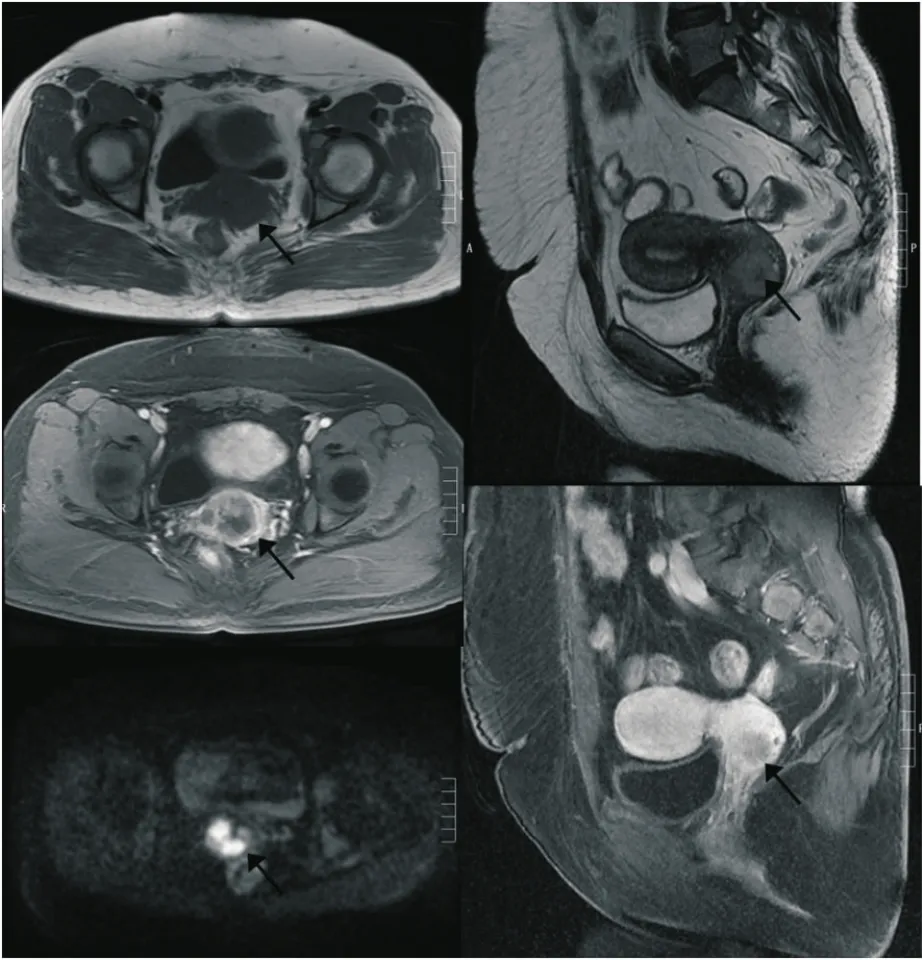
图1 宫颈小细胞神经内分泌癌MRI表现
SCNECC组ADC值最大值为0.968×10-3mm2/s,最小值为0.536×10-3mm2/s,平均值为(0.715±0.157)×10-3mm2/s。宫颈鳞癌组ADC值最大值为1.577×10-3mm2/s,最小值为0.796×10-3mm2/s,平均值为(1.026±0.216)×10-3mm2/s。宫颈腺癌组ADC值最大值为1.638×10-3mm2/s,最小值为0.656×10-3mm2/s,平均值为(1.079±0.295)×10-3mm2/s。
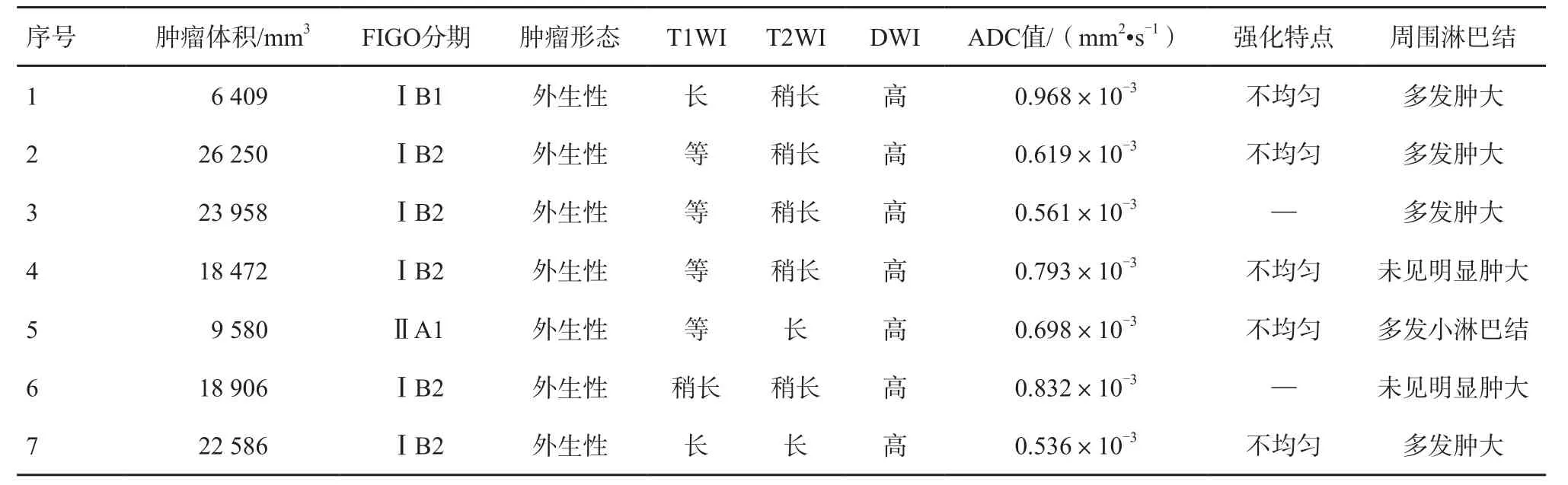
表1 7例SCNECC患者的MRI表现
3组之间ADC值差异有统计学意义(P=0.003);SCNECC组ADC值明显低于宫颈鳞癌组,差异有统计学意义(P=0.001);SCNECC组ADC值明显低于宫颈腺癌组,差异有统计学意义(P=0.003);宫颈鳞癌组与宫颈腺癌组差异无统计学意义(P=0.533)。
共7例SCNECC患者行CT检查。CT平扫示SCNECC的宫颈均表现为不规则增大,最大值为3 135 mm2,最小值为1 736 mm2,平均值为(2 421.14±576.68) mm2。CT值最大值为39 HU,最小值为31 HU,平均值为(34.57±2.88) HU。其中有4例行CT增强检查,均表现为不均匀持续强化(图2)。
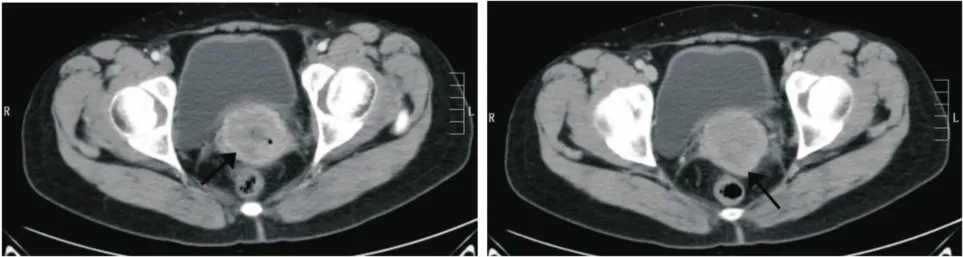
图2 宫颈小细胞神经内分泌癌增强CT检查
5例SCNECC患者行超声检查,4例表现为肿块型,且形态不规则;1例表现为非肿块型。4例肿块型SCNECC中,肿块面积最大值为2 296 mm2,最小值为1 372.47 mm2,平均值为(1 697.89±409.29)mm2;2例边界清晰,2例欠清。2例内部回声表现为低回声,3例表现为不均质回声;3例表现为少量血流信号,2例表现为明显血流信号(图3)。
2.2 病理结果
14例SCNECC患者的病理表现如图4所示,免疫组织化学分析显示神经内分泌标记阳性,如CgA阳性,证实为小细胞癌。
术后病理证实,SCNECC组有14例发生淋巴结转移,其中3例为ⅠB1期,9例为ⅠB2期,2例为ⅡA1期。宫颈鳞癌组有9例发生淋巴结转移,其中ⅠB1期7例,ⅠB2期1例,ⅡA1期1例。腺癌组有5例发生淋巴结转移,其中ⅠB1期2例,ⅠB2期1例,ⅡA1期2例。
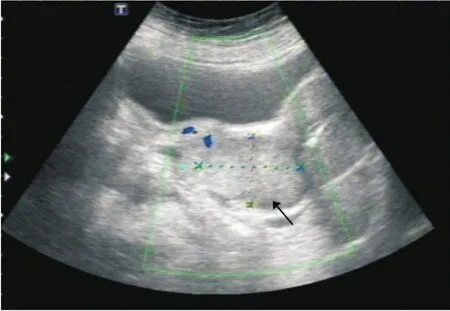
图3 宫颈小细胞神经内分泌癌的超声表现
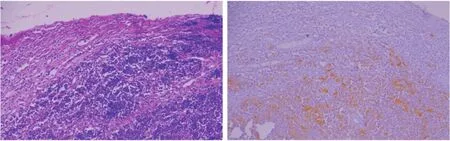
图4 SCNEC的病理表现
SCNECC组与宫颈鳞癌组之间淋巴结转移率差异有统计学意义(P<0.05)。SCNECC组与宫颈腺癌组之间淋巴结转移率差异有统计学意义(P<0.05)(表2~3)。
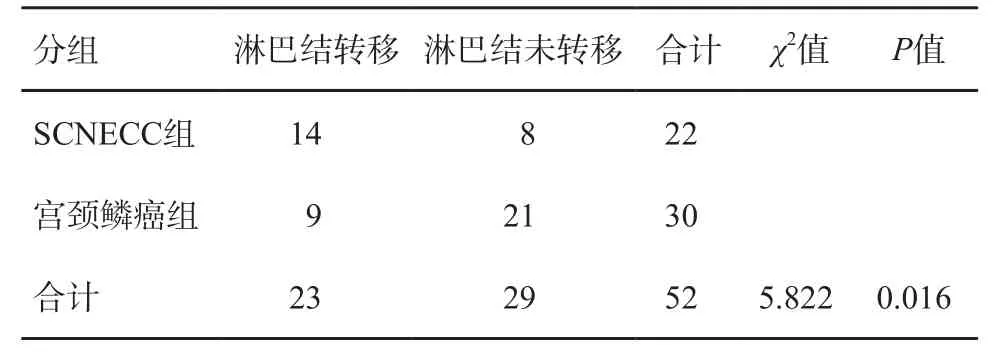
表2 SCNECC组与宫颈鳞癌组之间淋巴结转移的比较
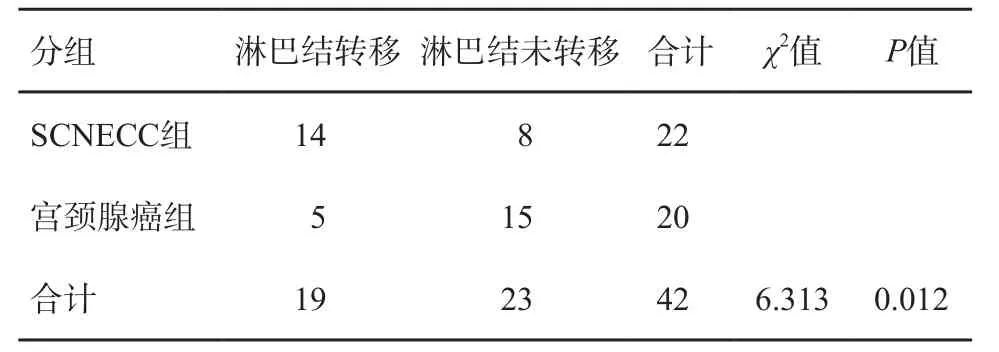
表3 SCNECC组与宫颈腺癌组之间淋巴结转移的比较
3 讨 论
SCNECC发病率较低,且临床工作中越来越需要应用病理活检等方法直接获得诊断信息,因此影像学上对其认识存在很多不足。SCNECC最常见的临床表现为不规则阴道流血或排液增多,偶可见神经内分泌症状。其发病与高危型人乳头瘤病毒(human papillomavirus,HPV)感染关系密切。SCNECC好发年龄为40~45岁,呈弥漫浸润性生长,早期可发生周围侵犯、淋巴结转移及脉管瘤栓等,尤其是淋巴结转移率极高,达40%~60%,并且有学者认为这是SCNECC有别于子宫颈鳞状细胞癌的重要病理学特征[7-8]。本研究中22例SCNECC患者年龄分布在29~55岁,中位年龄41岁,共14例经术后病理学检查证实为淋巴结转移,淋巴结转移率为63%,明显高于宫颈鳞癌组和宫颈腺癌组,与相关文献报道相符。笔者认为,SCNECC比宫颈鳞癌和宫颈腺癌更易发生淋巴结转移。
MRI能多方位、多序列显示宫颈病变,在显示相邻结构侵犯方面,准确率为95%,灵敏度为95%,特异度为93%,可作为宫颈癌分期的一种常规手段。MRI功能成像可提供更多关于肿瘤的信息,提高诊断效能。DWI是目前惟一能检测活体组织内水分子扩散运动的无创方法。与常规TlWI和T2WI不同,DWI能使MRI更微观地显示人体组织病理生理状态下组织间水分子交换状态。有文献报道,宫颈鳞癌和宫颈腺癌的MRI特征均表现为T1WI低或等信号,T2WI高信号。本组行MRI检查的7例SCNECC在T1WI上通常表现为低或等信号,在T2WI上大部分表现为稍高信号。MRI增强检查发现,SCNECC呈不均匀强化。DWI上扩散明显受限,表现为高信号,ADC值偏低,平均值为(0.715±0.157)×10-3mm2/s,明显低于宫颈鳞癌组和宫颈腺癌组,差异有统计学意义,与相关文献报道基本一致[9-10]。SCNECC的ADC值较其他类型宫颈癌低,可能与其病理特点有关。ADC值通常受水分子扩散和微循环的影响。笔者认为SCNECC的ADC值偏低的原因有以下几点:① SCNECC肿瘤中心常伴广泛坏死,影响水分子扩散,从而使ADC值减低;② 在行超声多普勒检查的11例SCNECC中,7例表现为少量血流信号,这可能是因为SCNECC的微血管较其他类型宫颈恶性肿瘤少,从而使其ADC值相对减低。因此,应用DWI不仅可帮助诊断SCNECC,还可能观察到SCNECC的某些生物学行为特征。
CT平扫结合增强检查应用于宫颈癌诊断不仅可观察肿瘤的大小、形态、生长方式及周围组织关系,还可观察肿瘤的强化方式等,直接反映肿瘤的血供特点,从而判断肿瘤的良恶性。CT上宫颈癌分为外生性和内生性两种。目前,尚未见有关CT检查与宫颈癌病理学分型的研究报道。本组7例SCNECC患者行CT检查,表现为宫颈不规则增大,呈不均匀软组织密度,增强扫描为持续型不均匀强化。超声检查通常用作宫颈癌的初步诊断方法。B超结合多普勒血流成像,可实时动态地观察病灶血供情况。相关研究结果显示,宫颈腺癌常表现为等回声肿块,宫颈鳞癌常表现为低密度肿块,且腺癌和鳞癌均为富血供肿瘤,在多普勒血流成像上均表现为强血流信号[11-13]。本组5例SCNECC患者行超声检查,多表现为不规则肿块,内部多呈不均质低回声,多普勒超声可见少量血流信号。因此,本研究中SCNECC的CT及超声表现与其他类型宫颈恶性肿瘤相比,未见明显特征性表现。
综上所述,SCNECC在CT上仅能显示为宫颈不规则增大和持续型不均匀强化;超声检查仅显示为内有少量血流信号的不均质低回声肿块。SCNECC的MRI有以下特征性表现,即T1WI低或等信号,T2WI稍高信号,DWI高信号,ADC值偏低,并伴有多发周围淋巴结肿大。虽然超声和CT对SCNECC的鉴别缺乏一定的特异性,但结合MRI检查可提高诊断率,MRI在宫颈癌筛查工作中更有意义。

