CT引导下直肠癌根治术后局部复发冷冻消融治疗的单臂单中心临床研究
孙小飞,何新红,李文涛
复旦大学附属肿瘤医院介入治疗科,复旦大学上海医学院肿瘤学系,上海200032
结直肠癌是欧美发达国家常见的恶性肿瘤之一,发病率达50/10万~60/10万。我国结直肠癌的发病率呈现快速上升趋势,2010年在全国恶性肿瘤发病率中上升为第6位,5年患病率已跃居第2位[1]。直肠癌的局部复发是接受根治性手术切除患者治疗失败的主要原因之一,10%~25%的患者最终将出现局部复发[2],直肠癌局部复发的治疗是结直肠癌治疗的难点,治疗效果相对较差,手术治疗风险高、并发症多及死亡率高。放疗对出血和疼痛症状有一定改善,但对其他症状的控制效果非常有限;而化疗主要作为一种姑息性治疗手段或放疗增敏剂。本研究为直肠癌根治术后局部复发冷冻消融治疗的前瞻性研究,目前已完成较长时间的随访,可以为直肠癌根治术后局部复发的治疗提供有价值的信息与参考。
1 资料和方法
1.1 患者选择
本研究经每位患者知情同意。入组标准:①直肠癌术后复发病理学诊断明确;② 术后二线化疗及放疗失败的患者;③ 年龄18~75岁。排除标准:① 病灶紧邻膀胱或肠道等空腔脏器,病灶位于皮下或已侵犯皮肤;② 血小板<75×109/L或国际标准化比值(international normalized ratio,INR)>1.5;③ 重要脏器功能衰竭。
1.2 治疗过程
患者直肠癌术后复发于门诊或住院经CT(Philips,64排)引导下穿刺活检明确病理学诊断,完善相关检查并排除手术禁忌证后,行CT引导下冷冻消融术。冷冻针型号(Cryo-HIT,Galil Medical,17G),术中采用氩气制冷,冷冻中心区域温度可达- 140 ℃,单针的制冷范围为长4 cm、最大径2.5 cm的椭球形,均经历2次冻-融循环。若盆腔病灶靠近膀胱,术前插导尿管排空膀胱;若盆腔病灶与邻近肠道难分辨,术前4 h口服复方泛影葡胺针6支(76%,20 mL)显示肠道。保证冰球覆盖范围超过病灶边缘0.5 cm或完全覆盖病灶。
1.3 随访与评估
统计技术成功率、并发症发生率,记录术前及术后患者疼痛评分[采用数字评分法(numerical rating scale,NRS)进行疼痛评分]。治疗后影像学随访采用盆腔增强CT或磁共振成像(magnetic resonance imaging,MRI),术后前3个月至少1次,之后每3个月1次。术后疗效评估采用修订的实体瘤疗效评价标准(Modified Response Evaluation Criteria in Solid Tumors,mRECIST),局部疗效评价采用靶病灶局部控制率、局部病灶无进展生存期两个指标。
1.4 统计学处理
2 结 果
2.1 患者资料
2013年10月—2016年8月共入组31例直肠癌根治术后局部复发患者,其中男性18例,女性13例,年龄34~78岁,平均(57.8±9.7)岁。病灶最大径2.0~7.0 cm,平均(4.2±1.3) cm。均经CT引导下穿刺活检明确病理学诊断。31例患者中,骶前复发22例,侧方复发7例,会阴复发2例。25例(80.6%)患者有明显的自觉症状,包括骶前疼痛、会阴部坠胀或疼痛、下肢疼痛或麻木感、里急后重感及排尿困难或血尿等。
2.2 治疗及并发症情况
31例直肠癌根治术后局部复发患者共行36次冷冻消融,5例患者行2次盆腔冷冻消融术。本研究技术成功率为100%,主要并发症发生率为16.7%(6/36),包括小便困难、患侧肌力下降、骶前脓肿及重度组织冻伤。3例小便困难膀胱区热敷无效后予以导尿,导尿管均于术后3 d内拔除。1例术后患侧下肢肌力由4级降为2级,予以甘露醇脱水、弥可保口服营养神经,术后1个月随访肌力基本恢复。1例骶前脓肿予以脓肿引流、每天两次甲硝唑溶液冲洗及抗生素静脉滴注,术后2周脓腔消失。1例Ⅳ度局部冻伤,予以清创、切除坏死组织及创面冲洗,后分次臀大肌填充、植皮予以修复(图1)。
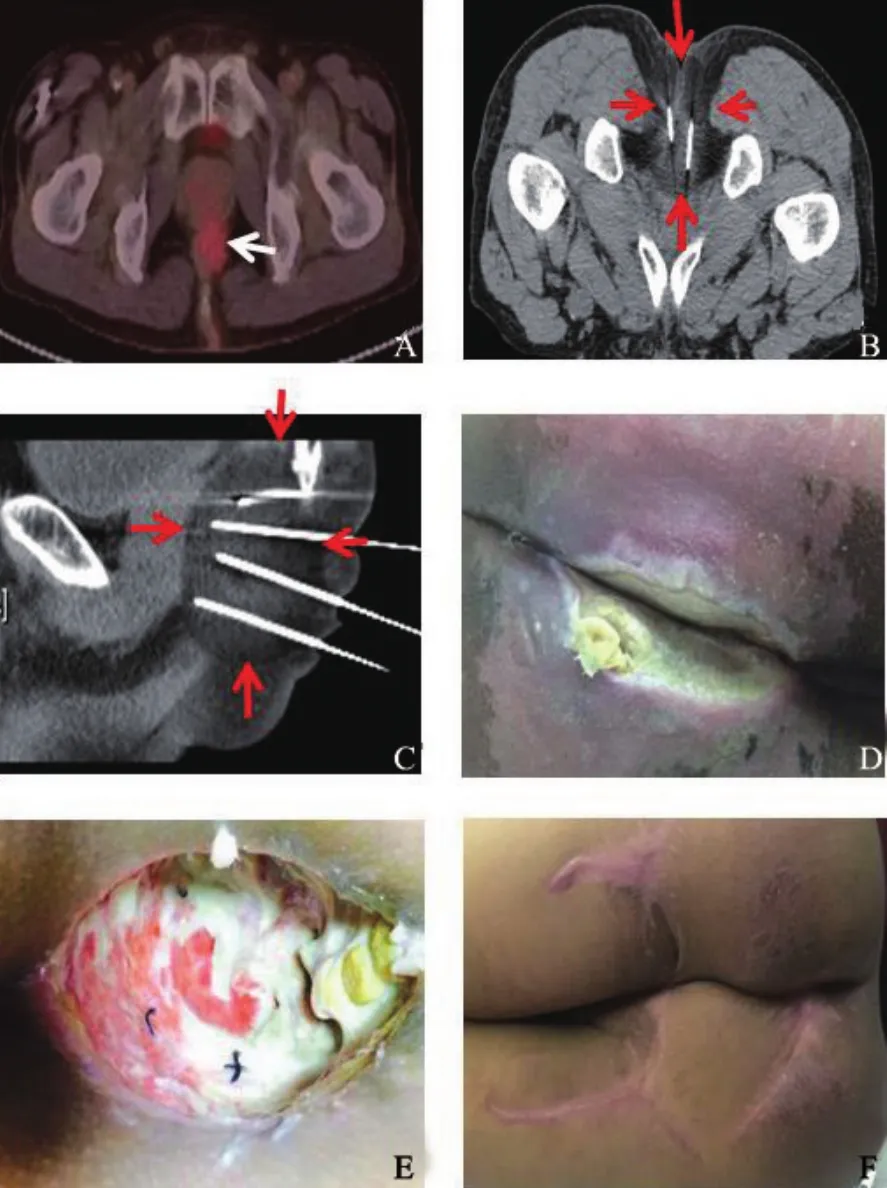
图1 Ⅳ度局部冻伤及其处理
2.3 随访评估
患者随访时间为从末次盆腔肿瘤冷冻消融术后第1天至患者死亡或最后一次随访,共16~50个月。术前、术后第3天和术后12个月NRS疼痛评分分别为(4.3±2.4)分、(1.4±1.2)分和(4.5±2.7)分。患者术前与术后第3天NRS疼痛评分差异有统计学意义(P=0.001);术前与术后12个月NRS疼痛评分差异无统计学意义(P=0.854)。术后1年内靶病灶局部控制率为61.3%,局部病灶无进展生存期为(15.1±1.8)个月(图2)。31例患者中,死亡20例,存活9例,失访2例。20例死亡患者中,19例为肿瘤相关原因死亡,1例患者家属拒绝告知死亡原因。总生存期(overall survival,OS)为(17.9±2.3)个月(图3)。
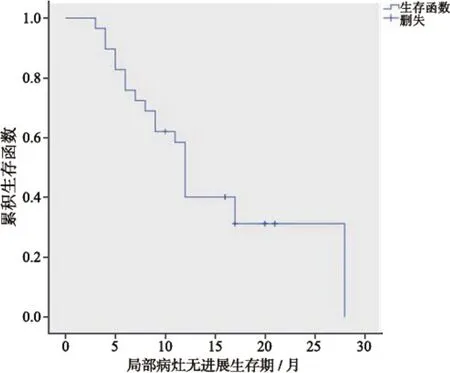
图2 局部病灶无进展生存期
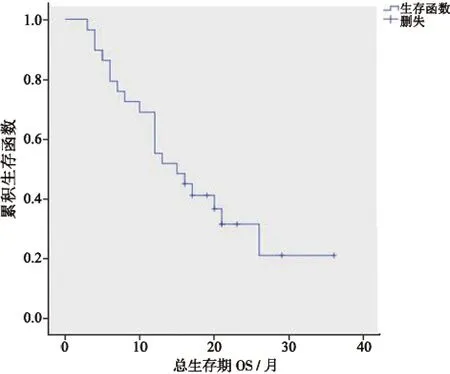
图3 总生存期
3 讨 论
直肠癌的局部复发定义为发生在小骨盆内的任何直肠癌的复发。目前,直肠癌术后局部复发的分类尚未有准确的定义及界定,仅有荷兰的一项前瞻性后续随访分析对局部复发进行了较为明确的分类[3],这也是目前应用最广泛的分类方法。该研究根据随访影像学复发位置,将局部复发分为5种类型:骶前复发、前方复发、吻合口复发、侧方复发及会阴复发。直肠癌术后局部复发初期缺乏特异性症状,多数无明显不适。局部复发的诊断强调规律的定期随访。一项671例患者的随访研究发现,70%的局部复发是在术后常规随访过程中发现的[4]。局部复发严重影响直肠癌患者的生活质量和生存期。
冷冻消融又称冷冻疗法(cryotherapy)或冷冻外科(cryosurgery)。其原理为探针穿刺肿瘤后迅速降温(核心温度可达-160~-196 ℃)形成冰球,维持一段时间后再快速升温,此一降一升为1个循环,如此几个循环,反复冻融使肿瘤区域坏死。降温后细胞内和细胞外迅速形成冰晶,导致肿瘤细胞脱水、破裂;同时,冷冻使微血管收缩、血流减慢及微血栓形成,阻断血流,导致肿瘤细胞缺血坏死。
目前,应用较为广泛的冷冻系统多基于氩气制冷,主要有Cryo-HIT及CryoCare两种系统,可允许放置1~15个直径1.5~2.4 mm的冷冻探针。每个探针通过冷冻-融化-冷冻模式达到所在区域的肿瘤坏死,治疗过程中通过B超、CT或MRI介导,肿瘤组织内形成的冰球清晰可见,使消融区域与周围组织之间形成鲜明的边界[5]。当肿瘤靠近重要组织脏器,由于冰球对周围组织结构的损伤可限制在其最外侧边界的3~7 mm内[6],操作者可据此最大限度地灭活肿瘤病灶,同时不损及周围重要组织脏器。冷冻治疗中,冰球明确可见大大增加了操作安全性及术者信心,其应用日益广泛。2000年冷冻消融首先应用于前列腺癌的治疗[7],后来逐渐扩展到肝、肺、肾、乳腺、子宫、卵巢、骨及皮肤与各种软组织的良恶性肿瘤。直肠癌术后复发冷冻消融治疗的研究报道很少,可能有以下原因:① 盆腔结构复杂,肠管、输尿管、膀胱、子宫及神经等组织脏器的干扰使得治疗风险相对较高;② 即使有少量报道,但缺乏长期随访及有效分析,疗效不能肯定,使治疗者信心不足。根据文献报道,盆腔肿瘤冷冻消融的并发症有疼痛、出血、血小板降低、肠穿孔、肠梗阻、膀胱损伤、神经损伤、组织冻伤及冷休克等,其中冷休克为最严重的并发症,主要由于肿瘤溶解、大量炎症因子释放入血造成[8]。
在前期临床工作中,本中心对部分直肠癌术后复发患者进行了射频消融治疗,发现患者的耐受性较差,可能是相对于冷刺激,神经对热刺激更为敏感;此外,由于缺乏明确的消融边界,为避免累及周围重要组织器官,治疗过程较为保守。而CT引导下冷冻消融可明确低密度边界,通过逐渐增大冷冻功率、降低神经敏感性而提高患者的耐受性。为此,笔者进行了本前瞻性研究,探索直肠癌根治术后局部复发冷冻消融治疗的可行性、安全性及有效性,以期提供一种新的治疗方法。本研究技术成功率为100%,主要并发症发生率为16.7%,无围手术期死亡发生。本研究最严重的并发症为1例Ⅳ度局部冻伤,通过清创、创面冲洗、切除坏死组织、分次臀大肌填充和植皮完成修复。分析原因如下:尽管按照一般标准即冷冻范围超过肿瘤10 mm操作,但病灶较靠近皮肤,缺乏肌肉组织的保护,而脂肪组织对低温的耐受性较差,易发生脂肪溶解。本研究中,术后患者短期内疼痛缓解明显,患者口服镇痛剂的剂量明显减少。冷冻消融对疼痛的缓解作用在骨肿瘤中报道较多[9]。术后1年内靶病灶局部控制率为61.3%,局部病灶无进展生存期为(15.1±1.8)个月。目前,直肠癌根治术后局部复发冷冻消融治疗的长期随访数据极少,仅有徐克成等[10]报道6例复发性Ⅲ期直肠肛管癌冷冻-125I粒子治疗,近期疗效较好,其中3例生存2年以上,1例已无病生存41个月。在前期研究[11]的基础上,本研究随访16~50个月,获得了较长期的随访数据,以期为相关临床及科研工作者提供参考。
值得一提的是,最新研究表明,对肝脏肿瘤进行射频消融,在肿瘤病灶凝固性坏死的同时也会诱导一些不良反应,如消融区域残留肿瘤组织,消融区域周围正常肝组织甚至远处转移灶的发生、生长及增殖,称为“脱靶效应”(offtarget effect)[12-14]。直肠癌根治术后局部复发的冷冻消融治疗是否存在脱靶效应,目前尚未见文献报道。如果冷冻消融也存在脱靶效应,如何识别、抑制脱靶效应是面临的挑战,也是研究的热点。还有研究者认为,冷冻联合经动脉区域化疗、125I粒子植入放疗及腹腔热灌注化疗等可能会有更好的疗效。此外,针对直肠癌根治术后局部复发,局部治疗结合全身治疗的理念被日渐认可,如冷冻消融联合化疗、免疫治疗,相关研究有待开展。

