实时超声造影在局灶性前列腺癌靶向冷冻消融治疗后随访中的应用价值
谢少伟,董柏君,王艳青,夏建国,李红丽,张时君,杨文琪,薛 蔚,李凤华
1.上海交通大学医学院附属仁济医院超声医学科,上海 200127;2.上海交通大学医学院附属仁济医院泌尿外科,上海 200127
我国前列腺癌发病率呈逐年上升趋势[1]。对局灶性前列腺癌的治疗,目前临床上以根治术为主。但根治术的创伤较大,并发症较多,明显影响患者生活质量;且部分前列腺癌患者年龄较大,合并其他老年性疾病机会较多,无法耐受根治术。近年来,前列腺冷冻消融术因其微创、并发症少,越来越多地应用于前列腺癌治疗并取得了良好疗效,成为前列腺癌治疗的有效选择[2-3]。但对于局部不规则的肿瘤,冰球边缘可能残留小块癌组织,导致局部消融不彻底,存在局部复发的可能。因此,采用有效的影像学方法对前列腺癌靶向冷冻消融术后的消融范围进行随访具有重要临床意义。经直肠超声造影(contrast-enhanced transrectal ultrasound,CETRUS)技术可以提供组织血流灌注的情况,是评估肿瘤局部治疗后疗效的理想影像学方法。本研究回顾性分析15例接受前列腺癌靶向冷冻治疗患者的CETRUS资料,探讨CETRUS在局灶性前列腺癌靶向冷冻消融治疗后随访中的临床应用价值。
1 资料和方法
1.1 研究对象
2014年6月—2015年3月,共15例患者经穿刺病理确诊为局灶性前列腺癌后行靶向冷冻消融治疗。入组标准:前列腺特异性抗原(prostate-specific antigen,PSA)<20 ng/mL;Gleason评分≤7;临床分期cTlc~cT2b期;穿刺针数≥10针,阳性率<50%;肿瘤位于前列腺一侧;盆腔多参数MRI或CT检查和骨扫描检查确认肿瘤位于前列腺内,未突破包膜,并排除淋巴结、骨和其他部位转移;之前未接受其他相关治疗。入组患者年龄75~82岁,平均78.3岁。术前PSA 7.3~19.6 ng/mL,平均11.7 ng/mL。临床分期:cTlc期2例,cT2a期7例,cT2b期6例。活检病理Gleason评分:6分10例,7分5例。
1.2 手术方法
均采用CryoCare氩氦刀系统(美国Endocare公司)进行治疗。术前对患者超声、MRI影像资料及穿刺活检结果进行评估,如影像学检查无明显异常,以穿刺病理为准,确定肿块的位置和范围、冷冻针的数量及进针路径。患者全身麻醉,取截石位暴露会阴部。在经直肠超声探头引导下,于肿瘤附近经会阴置入1~3根冷冻针。然后放置4根测温针,1根位于尿道旁,1根位于直肠前或迪氏筋膜,1根位于同侧前列腺顶部,1根位于同侧神经血管束。插入尿道保护器,尿道保护器内循环水保持恒温42 ℃。接通高压氩气,最低温度为-135~-145 ℃,冷冻10 min。接通高压氦气升温至15~20 ℃,复温5 min。继续重复冷冻-复温1个循环。术中实时监测冷冻针及测温针的温度,同时采用超声实时监控冰球形成范围,监测冰球距膀胱、直肠壁的距离,使冰球完全覆盖肿瘤的同时避免损伤周围脏器。
1.3 超声造影检查仪器与方法
所有患者于术前,术后第1天、6个月、1年及之后每年和生化复发时行经直肠超声检查,包括灰阶、彩色多普勒成像及CETRUS扫查。使用飞利浦iU22超声诊断仪,C10-3v经直肠探头,成像机械指数为0.06。超声造影剂SonoVue购自意大利Bracco公司,剂量为2.4 mL,经肘部浅静脉团注。在注射造影剂的同时行超声造影成像,造影剂到达前列腺后,开始进行前列腺横断面从底部到尖部连续扫查,并同步存储图像。扫查时间约90 s。随访中,若消融灶内出现明显造影剂增强为CETRUS异常。
1.4 PSA检查
术后1个月、3个月及之后每3个月行PSA检测。生化进展以Pheonix标准定义,即生化复发的标准为术后PSA降到最低点后升高2 ng/mL。生化有效率定义为生化无进展人数所占比例。
2 结 果
15例均顺利完成手术。术后随访27.8~35.1个月,中位时间为31.0个月。15例患者均存活,无新发转移病灶。冷冻术后所有患者PSA下降(图1),PSA最低值为0.9~14.8 ng/mL,平均4.2 ng/mL。PSA降至最低值的时间为1~9个月,平均5.7个月,73.3%(11/15)的患者随访无生化复发,CETRUS随访亦未发现异常。
冷冻手术术前超声或MRI检查阳性10例,阴性5例。术后第1天常规灰阶超声示前列腺体积增大,冷冻消融灶呈水肿性改变,消融灶与周围正常组织分界不清,无法清晰区分,彩色多普勒成像未见明显血流信号;CETRUS示冷冻消融灶内造影剂增强缺损区,或仅见个别造影剂微泡进入,边界不清,周围神经血管束增强不明显。术后6个月常规灰阶超声示冷冻侧前列腺体积缩小明显,与周围组织分界不清,内部回声不均匀,部分可出现多发钙化灶,彩色多普勒成像未见明显血流信号;CETRUS示冷冻消融灶造影边界清晰,内未见造影剂微泡进入,可见包膜及周围神经血管束增强。术后1年CETRUS示冷冻消融范围稳定(图2)。
在出现生化复发的4例患者中,2例CETRUS检查发现冷冻消融灶内出现造影剂明显增强,予间歇性内分泌治疗后PSA下降;2例CETRUS检查示冷冻消融灶内未见明显造影剂增强,予主动监测,PSA稳定。
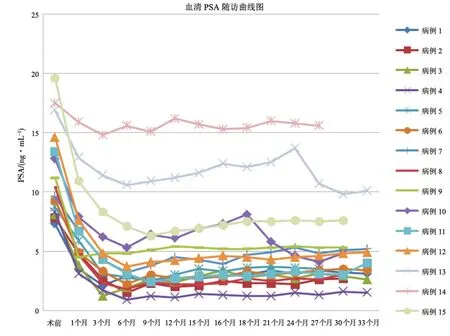
图1 前列腺癌靶向冷冻消融治疗后血清PSA随访曲线图
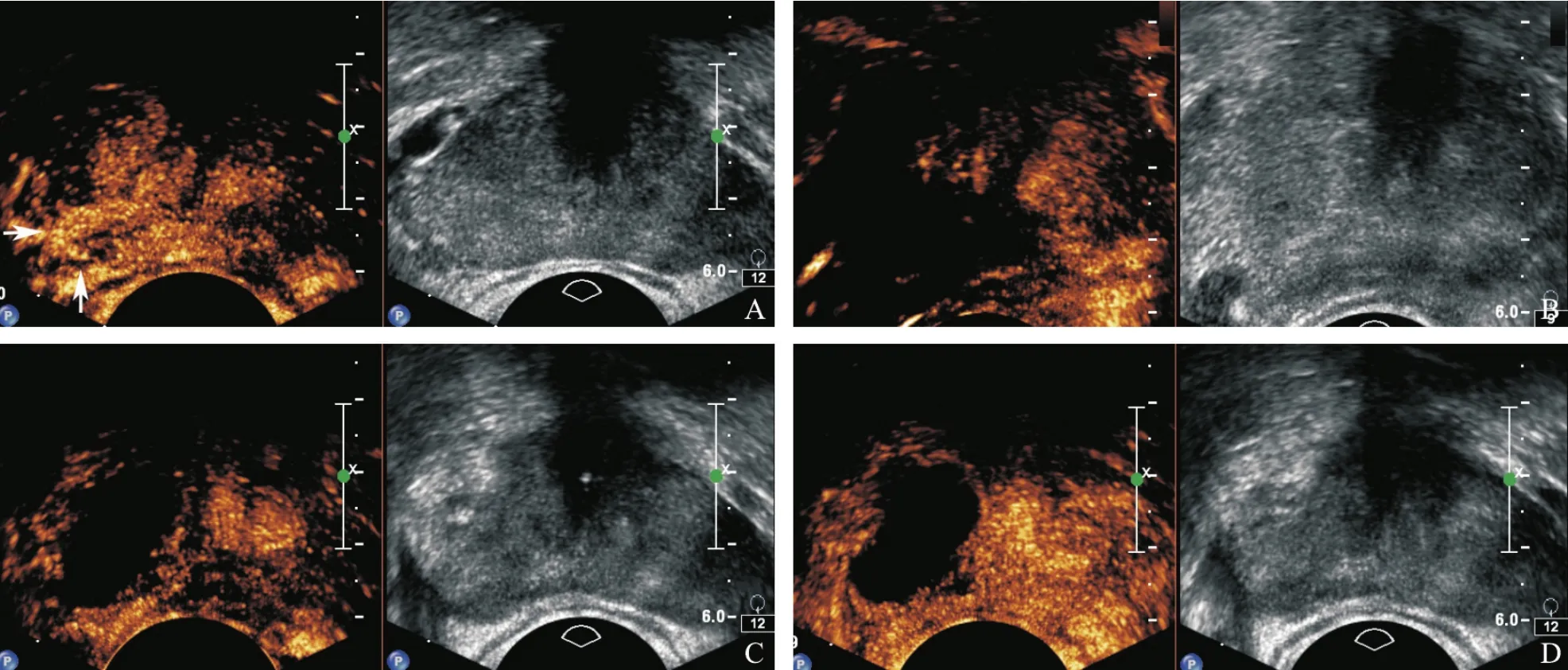
图2 患者男性,73岁,术前PSA 11.2 ng/mL,经会阴前列腺穿刺病理证实右侧外腺3针为Gleason评分7分的前列腺癌
3 讨 论
前列腺癌冷冻消融术是将直肠腔内超声、经皮穿刺介入技术和现代冷冻技术三者结合使用的微创治疗方法,具有操作简单、痛苦小及创伤小等优点,适用于无法行根治性切除患者。其利用低温冷冻肿瘤组织,使组织细胞功能受损后产生结构破坏,冷冻腺体组织和肿瘤组织坏死、脱落,毛细血管和小血管痉挛,造成局部血液循环障碍。冷冻还可直接损伤微血管壁,导致血栓形成,局部组织缺血缺氧,引起组织坏死[4]。局部冷冻消融术后严密随访必不可少,目前大多数研究仍以PSA水平来定义前列腺癌复发,即生化复发。但生化复发并不等同于原位复发,前列腺增生、炎症及新肿瘤病灶出现等同样可以导致术后PSA升高。国外学者经大样本研究发现,术后PSA最低值与肿瘤特异性生存率及肿瘤无远处转移生存率没有明显相关性[5]。因此,能精确评估冷冻消融范围,检出前列腺癌复发病灶并引导穿刺的影像学技术至关重要。
经直肠超声安全、有效、实时、方便,是目前引导前列腺穿刺及微创治疗中使用最多的影像学技术及评价手段之一。但常规二维超声不能反映冷冻消融灶的范围,彩色能量多普勒超声不能显示微血管层面的信息,并不能准确描绘治疗区域的范围。超声造影利用造影剂微气泡较强的背向散射信号,使含有血管的组织回声明显增强,这样冷冻后坏死组织与周围正常组织之间的增强差异可清晰呈现出两者的分界,能很好地评估局部治疗病灶的坏死范围。有关动物前列腺射频消融的研究显示,超声造影评估局部治疗病灶范围大小与病理大小有很好的相关性[6],已在肝癌局部介入治疗效果的评价中体现出重要价值,被认为能与增强CT或MRI相媲美[7-8]。此外,由于前列腺癌患者年龄多较大,合并心脑血管疾病机率较大,相当一部分接受过支架放置手术的患者不能接受MRI检查,超声造影在这方面具有优势。
本研究中,常规灰阶及彩色多普勒超声不能准确评估冷冻消融灶范围,仅能反映局部回声或血流信号的改变。而CETRUS能够更加直观地显示冷冻治疗术后血流缺失的消融灶,与周围残存前列腺组织分界清楚,能很好地描绘出消融灶的范围,具有独特的优势。同时,对前列腺行实时CETRUS扫查不受切面选择的限制,注射1次造影剂即能获取整个前列腺血流灌注的信息,更有利于准确反映消融灶的范围。对于冷冻消融灶的CETRUS图像转归,发现术后第1天即出现造影剂增强缺损区,但与周围的边界不清,消融灶范围不稳定,部分病例消融灶内可见个别造影剂进入,这可能与手术时间较短,消融效果还未稳定有关;6个月后CETRUS检查发现消融灶与周围组织边界清楚,范围稳定,在此基础上进行定期观察随访有利于复发病灶的检出。
冷冻消融术后定期复查超声造影及生化复发后予超声造影检查,可以更早期、更准确地检出消融灶内造影剂异常增强区,发现复发或残留灶。本研究4例生化复发患者中,CETRUS发现2例消融灶内造影剂异常增强,予间歇内分泌治疗后PSA下降;另2例CETRUS检查无异常增强,予主动监测,PSA稳定,证实了CETRUS在前列腺癌随访中的准确性。但本研究未对复发患者行穿刺活检证实,存在不足。
总之,实时CETRUS是临床上局灶性前列腺癌靶向冷冻消融术后随访的有效影像学方法,能准确显示消融灶的范围,可以早期发现术后复发或残留病灶。

