亚麻籽油和低氧处理对大鼠采食量、 葡萄糖和肝脏脂肪利用的影响
赵贵琴,刘雨诗,谢薇薇,白雪莲,陈雪君
(杭州师范大学 生命与环境科学学院,浙江 杭州 310018)
组织低氧是一种常见的生理和病理状态,在人体多种器官发病过程中起关键作用[1]。低氧使体内原有生物氧化失衡,一定范围内,机体可通过加强糖酵解、促进血管再生和红细胞生成等途径降低低氧对细胞造成的氧化损伤[2]。大量研究发现,低氧应激时,葡萄糖是动物组织和细胞供能的优先底物,糖酵解相关的酶可被低氧诱导因子-1(HIF-1)激活,脂肪分解受阻[3]。人类呼吸暂停综合症可诱发非酒精性脂肪肝,说明慢性间隙性低氧抑制机体脂肪利用[4]。但另一些研究则认为,低氧通过调节过氧化物酶体增殖物激活受体(PPARs)等通路,促进游离脂肪酸分解提供能量[5]。低氧还可以通过内分泌等调节途径降低肝脏糖酵解供能比例,增加脂肪酸的氧化利用[6]。适当低氧刺激能促进能量代谢和脂肪分解,改善低氧能量不足[7]。因此,低氧应激时的能量代谢调节是一个复杂的过程,葡萄糖和脂类物质作为供能的底物参与其中,但其作用机制仍不清楚。
亚麻酸(alpha-linolenic acid,ALA)是人体一种必需脂肪酸,属于n-3系列多不饱和脂肪酸(polyunsaturated fatty acid, PUFA),亚麻籽油是ALA 主要天然来源。研究认为,ALA及二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)等n-3 PUFA是脂肪酸代谢中重要的调节因子,能够抑制脂肪合成,促进脂肪分解,具有降低血脂等作用[8]。n-3 PUFA还能上调葡萄糖转运蛋白基因,增加机体对葡萄糖的摄入和利用,参与机体能量代谢调节过程[9]。目前很少有ALA与组织低氧之间的相互作用关系的研究报道。本研究从ALA作为营养调节因子的角度探讨大鼠低氧应激时对葡萄糖和脂肪的利用,研究两者之间可能存在的互作关系,为促进低氧状态下的机体健康提供可能的营养调节途径。
1 材料与方法
1.1 试验动物
60只30日龄的清洁级雄性SD大鼠购自浙江省医学科学院动物中心,初始体重为(69.50±0.36)g,于实验室进行为期1周的适应性饲养,温度(22±1)℃,相对湿度50%~60%,日光灯调节光照时间为7: 00—19: 00。
1.2 动物饲料
基础饲料根据《GB 14924.3—2010 实验动物 配合饲料营养成分》配制,由浙江省医学科学院动物中心生产提供。饲料含18%粗蛋白,4%粗脂肪,能量14 421 kJ·kg-1。试验组动物饲料营养水平与基础日粮相同,仅脂肪来源不同,试验组用亚麻籽油(2%)替代基础日粮中的大豆油(2%)。适应期全部动物饲喂基础饲料。
1.3 处理设计
将60只大鼠随机分成4组,分别为对照常氧(CN)组、对照低氧(CH)组、试验常氧(FN)组和试验低氧(FH)组。对照组饲喂基础日粮,试验组饲喂添加亚麻籽油日粮。常氧组在实验室常压下饲养,气压为101.23 kPa,氧气含量为20.9%。低氧组低氧舱内处理(每天22.5 h),模拟海拔高度3 km,气压67.2 kPa,氧分压15.1%。试验期间每天测体重,记录大鼠摄食量并更换垫料,计算采食量和日增重。4周后,全部动物处死,取全血自然凝血后,4 000 r·min-1离心15 min,分离血清,同时取动物肝脏和腿部肌肉,所有样品置于-80 ℃冰箱备用。
1.4 指标测定
1.4.1 血清和肝脏生化指标
测定血清中能量代谢相关指标,包括葡萄糖、丙酮酸、乳酸、总蛋白、白蛋白、尿素氮、总甘油三酯、高密度脂蛋白、低密度脂蛋白、游离脂肪酸、脂肪酸合成酶(FAS)、激素敏感脂酶(HSL)和脂蛋白脂酶(LPL)。以上测定试剂盒购自南京建成生物工程研究所,在SpectraMax M5型酶标仪上测定。
1.4.2 肝脏和肌肉相关基因mRNA实时荧光定量PCR(qRT-PCR)
肝脏和肌肉组织总RNA提取利用Trzol试剂盒(美国Invitrogen公司),按说明书操作。Oligo-dT随机引物进行逆转录,采用M-MLV cDNA 逆转录试剂盒(美国Promega公司)。qRT-PCR采用实时荧光定量试剂盒(日本TaKaRa公司),在iQTM5多重实时荧光定量PCR仪(美国Bio-Rad公司)上进行。PPARγ和GLUT-4基因引物根据Primer 5.0设计,由上海生物工程技术公司合成,引物序列见表1。以β-actin为参考基因,相对表达量用2-(ΔCt目的基因-ΔCt参考基因)表示。

表1 相关基因的引物序列
1.5 数据处理
所有数据用Statistic 7.0软件进行双因子方差分析, Turkey’s HSD进行组间多重比较。P<0.05为有统计学显著性差异。
2 结果与分析
2.1 采食量和体增重
各处理对大鼠日采食量和体增重的影响见表2。结果表明,低氧可显著降低大鼠日采食量和体增重,但亚麻籽油对两者无显著影响。低氧和亚麻籽油对日采食量和体增重不存在交互作用。

表2 各处理对大鼠日采食量和体增重的影响
注:同列无相同字母表示差异显著(P<0.05)。双因素方差分析,低氧处理P采食量=0.13,P体增重=0.47;亚麻籽油处理P采食量<0.001,P体增重<0.001;低氧×亚麻籽油P采食量=0.64,P体增重=0.58。
2.2 血清糖代谢
表3结果表明,低氧和亚麻籽油对血清葡萄糖、丙酮酸和乳酸均没有显著影响,且两者之间不存在交互作用。
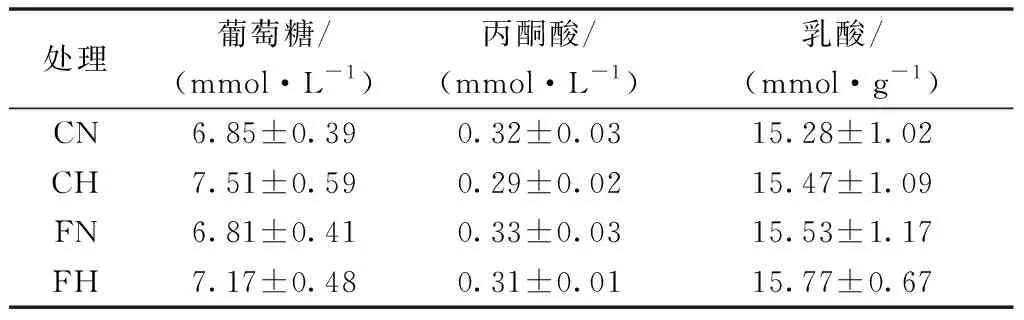
表3 各处理对大鼠血清糖代谢的影响
注:双因素方差分析,低氧处理P葡萄糖=0.26,P丙酮酸=0.10,P乳酸=0.56;亚麻籽油处理P葡萄糖=0.14,P丙酮酸=0.07,P乳酸=0.41;低氧×亚麻籽油P葡萄糖=0.19,P丙酮酸=0.83,P乳酸=0.39。
2.3 血清蛋白质代谢
表4结果表明,低氧对总蛋白和白蛋白含量无显著影响,使尿素氮含量显著升高;亚麻籽油对蛋白质各项代谢指标无影响,但两者对尿素氮具有交互作用。

表4 各处理对血清蛋白质代谢的影响
注:双因素方差分析,低氧处理P总蛋白=0.75,P尿素氮=0.17,P白蛋白=0.08;亚麻籽油处理P总蛋白=0.45,P尿素氮<0.001,P白蛋白=0.44;低氧×亚麻籽油P葡萄糖=0.10,P尿素氮<0.01,P白蛋白=0.06。
2.4 血清脂质代谢
亚麻籽油和低氧对大鼠血清脂质代谢的影响见表5。结果表明,低氧和亚麻籽油对血清甘油三酯(TG)和游离脂肪酸(FFA)均没有显著影响;两者均升高高密度脂蛋白(HDL),降低低密度脂蛋白(LDL),且低氧和亚麻籽油对两者具有交互作用。
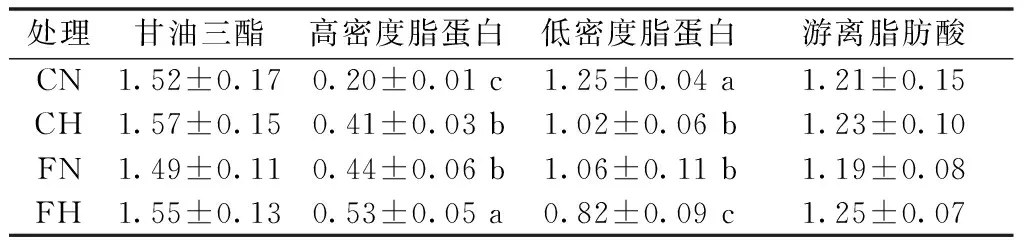
表5 各处理对血清脂质代谢的影响 mmol·L-1
注:双因素方差分析,低氧处理P甘油三酯=0.75,P高密度脂蛋白<0.01,P低密度脂蛋白<0.01,P游离脂肪酸=0.55;亚麻籽油处理P甘油三酯=0.12,P高密度脂蛋白<0.01,P低密度脂蛋白<0.05,P游离脂肪酸=0.12;低氧×亚麻籽油P甘油三酯=0.16,P高密度脂蛋白<0.05,P低密度脂蛋白<0.01,P游离脂肪酸=0.53。
2.5 肝脏脂肪代谢相关酶活性
亚麻籽油和低氧对大鼠肝脏脂肪代谢相关酶活性的影响见表6。结果表明,低氧对大鼠肝脏脂肪合成酶(FAS)和激素敏感脂酶(HSL)无显著影响,使脂蛋白脂酶(LPL)活性显著升高(P<0.01)。亚麻籽油对大鼠肝脏FAS活性无显著影响,但显著升高HSL和LPL活性,且亚麻籽油和低氧对LPL活性存在交互作用。

表6 各处理对大鼠肝脏脂肪代谢相关酶活性的
注:双因素方差分析,低氧处理P脂肪合成酶=0.69,P激素敏感脂酶<0.01,P脂蛋白脂酶<0.01;亚麻籽油处理P脂肪合成酶=0.88,P激素敏感脂酶=0.11,P脂蛋白脂酶<0.01;低氧×亚麻籽油P脂肪合成酶=0.87,P激素敏感脂酶=0.25,P脂蛋白脂酶<0.01。
2.6 肝脏和肌肉有关基因mRNA
低氧和亚麻籽油都显著增加了肝脏PPARγ和骨骼肌GLUT-4 mRNA的表达,且两者对肝脏PPARγmRNA表达有交互作用(表7)。
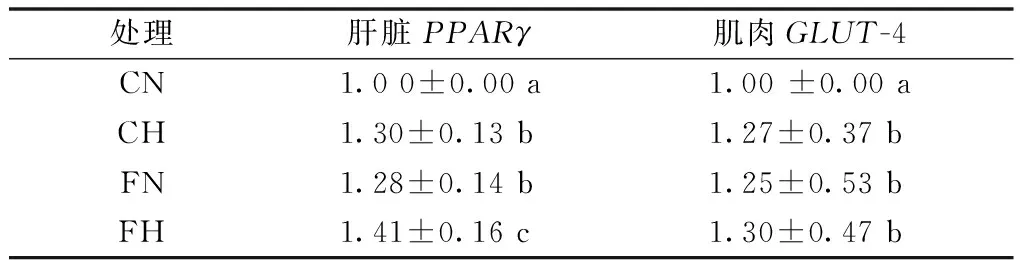
表7 各处理对大鼠肝脏PPARγ、
注:双因素方差分析,低氧处理P肝脏PPARγ<0.05,P肌肉GLUT-4<0.05;亚麻籽油处理P肝脏PPARγ<0.05,P肌肉GLUT-4<0.01;低氧×亚麻籽油P肝脏PPARγ<0.05,P肌肉GLUT-4=0.25。
3 讨论
3.1 亚麻籽油和低氧对大鼠采食量与体增重的影响
正常情况下,动物的采食量由下丘脑摄食中枢调控。在低氧应急状态下,内分泌激素如肾上腺素、甲状腺激素等分泌水平发生改变,一方面降低摄食量,另一方面增加能量消耗,导致体重减轻[10]。动物持续的低氧刺激或人类由平原进入高原地区,会引起食欲下降,体重减轻[11]。本试验结果发现,模拟3 000 m高原低氧处理4周,大鼠平均体增重显著下降,采食量显著降低,尿素氮显著增加。已有研究表明,低氧刺激引起脂肪分解增加,导致大鼠白色脂肪细胞体积变小,总脂肪含量降低体重下降[12]。Hashimoto等[13]研究发现,低氧条件(5%氧气)培养3T3-L1脂肪细胞1周后,脂肪细胞变小,甘油三酯含量降低50%。本研究发现,低氧引起肝脏PPARγmRNA表达增加,LPL活性增加,促进了脂肪的分解。因此,低氧刺激作用下大鼠摄食量减少,组织蛋白质、脂肪分解增加,导致动物平均体增重低于常氧组。本试验条件下,亚麻籽油对体增重和采食量没有影响,和低氧也不存在交互作用,但有促进肝脏PPARγmRNA表达增加,且与低氧具有交互作用,进一步促进脂肪分解。
3.2 低氧和亚麻籽油对大鼠葡萄糖利用的影响
本研究发现,模拟3 000 m高原低氧处理4周和亚麻籽油日粮均显著增加了骨骼肌GLUT-4 mRNA表达,但对血清糖代谢各项指标与对照组相比无显著差异。低氧状态下,大鼠血糖水平、肝脏和骨骼肌对葡萄糖的摄取和利用不同的研究有不同的结果,可能与低氧处理时间、低氧程度、血糖检测时间点等不同相关。机体在低氧条件下,氧气供应不足,氧化还原酶系统活性降低,三羧酸循环受阻,糖酵解增强,脂肪被动员用于肌肉的氧化供能同时血脂浓度降低[14]。 赵成玉等[15]研究发现,在低氧条件下肝脏和胰腺GLUT-4 mRNA 表达明显增加,肝脏和肌肉对葡萄糖的摄取和利用增加,同时糖异生减少,使血糖降低。本研究发现,低氧增加了骨骼肌GLUT-4 mRNA表达,有增加葡萄糖利用的作用,但这种促进作用比较有限,并没有引起血糖的降低。Carreras等[16]研究发现,间歇低氧可以影响 GLUT-4 蛋白由胞质到胞膜的易位过程,使胞膜GLUT-4 蛋白含量下降,从而影响骨骼肌摄取葡萄糖,导致胰岛素抵抗,使葡萄糖的摄取和利用减少,血糖升高[17]。对运动员在模拟3 000 m高原环境训练的研究却得到相反的结果,低氧显著提高血浆胰岛素与胰高血糖素的比例,导致血糖利用增加,而脂类的分解降低、合成增加,血浆游离脂肪酸降低[18]。
3.3 低氧与亚麻籽油对脂肪利用的影响
研究发现,模拟3 000 m高原低氧处理4周对大鼠血浆TG和FFA水平没有显著影响,HDL升高而LDL下降,肝脏LPL活性提高。LPL主要作用是将血浆脂蛋白(主要是乳靡微粒和极低密度脂蛋白)中的甘油三酯降解形成脂肪酸,用于氧化分解,降低LDL,升高HDL[19]。在低氧应激过程中,一些激素或细胞因子起着重要作用,PPAR-γ是具有广泛生理功能的脂肪细胞转录因子,参与多条脂肪代谢通路。本研究发现,低氧促进肝脏PPAR-γmRNA表达的提高,进而影响LPL等下游一系列脂肪代谢相关酶基因。路瑛丽等[7]研究发现,啮齿类动物低氧训练使骨骼肌中PPARs和肉碱酯酰转移酶(CPT1)mRNA的表达升高,增加骨骼肌线粒体中脂肪酸的β-氧化。但是低氧处理对脂质代谢的影响也有不同的结果。对人类呼吸暂停综合症的研究发现,慢性间歇性低氧导致胰岛素抵抗,使血液游离脂肪酸和葡萄糖水平升高,产生氧化应激,最终导致非酒精性脂肪肝[4]。低氧通过降低CPT1 mRNA和蛋白质表达,抑制长链脂肪酸向线粒体转运,减少脂肪β-氧化,导致脂肪在肝细胞沉积,但脂肪合成没有影响[6]。
亚麻籽油促进了大鼠肝脏PPAR-γmRNA表达的提高,进一步使肝脏LPL和HSL活性升高,升高了HDL,降低了LDL,其中对LPL活性的影响与低氧具有交互作用,但对TG和FFA没有显著影响。研究发现,富含DHA的鱼油对脂质代谢的调节是通过PPARs途径,升高动物肝脏和血浆的LPL,从而升高HDL[20-21]。ALA属于n-3系列PUFA,在动物和人体内可以通过碳链延长和去饱和作用合成EPA和DHA,但目前对亚麻籽油调节脂质代谢的研究远不如鱼油多。Fukumitsu 等[22]通过3T3L-1细胞系研究发现,ALA通过SREBP途径抑制FAS活性,减少胆固醇和甘油三酯合成,同时使CPT1 and瘦蛋白水平升高,促进脂肪分解利用,细胞内ATP增加。Barrena 等[23]认为,ALA具有抑制动物高脂饮食引起的糖类和脂类代谢紊乱作用。
综上所述,本试验低氧舱模拟3 000 m高原环境低氧处理大鼠4周,降低大鼠采食量,增加蛋白质和脂肪分解,增加能量消耗、降低体增重。添加亚麻籽油对采食量和蛋白质代谢没有影响,但通过增加PPAR-γmRNA表达,提高LPL和HSL活性增加脂肪利用,改善低氧能量供应。

