外源植物生长调节剂在烟草种子生产上的应用
王 欣,李宗平*,杨丽萍,闫铁军
(1.湖北省烟草科学研究院,湖北 武汉 430030;2.湖北省建始县农业局,湖北 建始 445300;3.湖北中烟工业有限责任公司,湖北 武汉 430040)
目前,烟叶生产使用的种子,包括自交种和雄性不育一代杂交种(简称杂交种)。自交种由留种烟株主茎顶端生长发育的花序上的花朵自交结实产生;杂交种则需人工采集父本花粉,授粉于母本花朵的花柱上,协助其完成授粉受精[1-2]。无论是自交种生产,还是杂交制种,均需烟株花序发育充分、花朵数充足和较高的坐果率,才能获得一定的种子产量。近年来,随着杂交父本花粉采集、储藏等技术的研发成功及介质花粉和打顶留杈技术的应用[3-6],最大限度地扩展父本花序、增加可采撷花朵数量,对提高杂交种种子产量和降低生产成本显得尤为重要。
多数高等植物花芽分化、花序形成及腋芽发育,除与遗传背景、营养状况、环境条件等因素有关外,与植株体内的激素水平也较为密切。细胞分裂素、赤霉素、生长素、乙烯、脱落酸、多胺、水杨酸、玉米赤酶烯酮、寡糖素、多肽、茉莉酸和苯丙氨酸类化合物等都会影响植物的成花过程[7]。同样,高等植物顶端分生组织和侧生分生组织的活性综合调控也离不开植物内源激素的参与。其中,顶端优势是植物分枝调控的核心因素,由于顶芽形成的生长素向下运输,进入侧芽部位,通过抑制植物体内细胞分裂素的合成或促进细胞分裂素的代谢,从而抑制腋芽生长[8]。植物侧枝的发生主要受生长素、细胞分裂素和独脚金内酯等3类激素控制[9]。
20世纪70年代以来,我国相继就赤霉素、乙烯利、缩节胺(矮助壮素)、多效唑等4种植物生长调节物质开展了全国性的开发研究,并取得了显著成果。目前,施用外源植物生长调节剂已成为我国粮棉油、果树、花卉及其他作物高产的重要配套技术[10-11]。在烟叶生产上,利用外源植物生长调节剂,促进烟株生长发育、调节烟叶内含物质的含量等方面的研究较多[12-15],但在烟草种子生产上的应用研究鲜见报道。本研究旨在通过不同类型的外源植物生长调节剂在烟草种子生产上的应用试验,为促进烟株开花结果、腋芽发育、提高种子产质量及杂交种父本花粉供应率提供新的途径。
1 材料与方法
1.1 供试材料
烟草品种:烤烟云烟87、白肋烟B37。
10种外源植物生长调节剂分别为矮壮素(CCC)、6-苄氨基腺嘌呤(6-BA)、吲哚乙酸(IAA)、α-萘乙酸(NAA)、赤霉素(GA3)、腐胺(Put)、尸胺(Cad)、亚精胺(Spd)、精胺(Spm)和维生素E(VE)。
1.2 试验方法
10种外源植物生长调节剂,各设5个水平,以清水处理为对照(CK),具体见表1。田间随机区组排列,3次重复,每小区20株,行株距为1.2 m×0.5 m。在烟株现蕾期~初花期连续施用调节剂3次,每次间隔时间为2~3 d。

表1 不同调节剂的不同浓度试验方案 mg/L
试验Ⅰ中,每小区20株,按现行GB/T 24308─2009《烟草种子繁育技术规程》标准进行操作[16],主茎顶端花序留果,其他腋芽、花枝及时抹除。盛花期后进行疏花疏果,留果数120个。蒴果成熟后各小区采摘蒴果,单存单放,考察其种子产量、蒴果粒数、千粒重和发芽率[17]。
试验Ⅱ中,每小区20株,从中心花开放1周后开始采撷花朵,连续15 d,统计每小区的单株主花序开花总数;施用调节剂2周后调查各处理烟株腋芽、烟杈生长情况,开花后开始采撷花朵,连续15 d,统计每小区的单株杈花枝开花总数。按李宗平等[18]介绍的方法进行花粉活力检测。
各处理取2个品种的平均值进行统计分析。利用DPS 7.0软件进行差异显著性检测。
2 结果与分析
2.1 不同植物生长调节剂对烟株花序发育及花粉活力的影响
2.1.1 对烟株主茎花序的花朵发育及花粉活力的影响 普通烟草(NicotianatabacumL.)属管状花目,两性完全花,有限的复聚伞花序,花序顶生。烟株主茎顶芽分化第一个花芽,形成第一朵花,随后在第一朵花附近的腋芽和副芽发育出2~3个花枝,花枝顶端又分化出顶芽和“第一朵花”,在“第一朵花”附近腋芽和副芽再次发育出2~3个花枝,不断循环分化;在顶芽分化成花和花枝后,顶芽下方的腋芽也自上而下逐个分化成为花枝,每个花枝按前述方式发展成为复聚伞花序。通常将由主茎顶端及以下2~3个在原生位置发育的既定腋芽形成的花枝及花朵称为“主花序”[1,19]。“主花序”的花朵是常规种生产和杂交制种的主要收获对象及其父本花粉的主要来源[16,20]。
由表2可知,除GA3不利于花朵发育外,6-BA、VE、Spd、Spm、Put、Cad、CCC不同浓度调节剂均可不同程度地促进花朵发育。20~200 mg/mL 6-BA的增花效果均达极显著或显著水平,最佳浓度为50 mg/mL;VE、Spd、Spm、Put、Cad低浓度有显著的增花效果,随着浓度的增大,增花效果逐渐下降。IAA、NAA低浓度有显著的增花作用,但随着浓度的增大,则会极显著地减少花朵数量,不利于花朵发育。从花粉活力情况来看,不同浓度调节剂对主茎花序上花朵的花粉活力的影响均不显著。其中GA3不同浓度处理的花粉活力均低于对照;IAA、NAA调节剂随着浓度的增大,花粉活力低于对照的幅度呈逐步增大的趋势。
2.1.2 对烟株侧花枝、花朵发育及花粉活力的影响 一般情况下,在烟株“主花序”以下的每个叶腋间潜育3~4个“不定芽”,其中1个主芽,2~3个副芽。在顶端优势的抑制作用解除之前,通常处于潜伏状态,抑制作用解除后迅速从上而下逐渐萌发,形成烟杈,最后发展为花枝[1]。由叶腋中分化出的花枝、花序称为“侧花枝”或“杈花枝”“侧花序”。有研究表明,烟株底部有0.3~8.5个、上部有2.1~10.7个腋芽有能力发育成烟杈[21]。

表2 不同浓度调节剂对花朵发育及花粉活力的影响
注:*、**分别表示同列数据与对照(CK)的差异达到显著、极显著水平。下同。
由表3可知,10种调节剂均具有显著或极显著的促进腋芽向侧花枝发育的作用。按侧花枝数量以及与对照的增长率影响排序为IAA>GA3>Put>NAA>VE>Spd>6-BA>Cad>CCC>Spm;IAA、NAA、GA3、Put和Spm调节剂的侧花枝数量随着施用浓度增加呈升高趋势,Cad则呈下降趋势,VE、Spd、6-BA和CCC呈先升高后降低趋势。整体来看,各种调节剂对侧花序花朵发育和花粉活力的影响趋势与对主花序花朵发育及花粉活力的影响一致。
各调节剂不同浓度在试验中的具体表现为:(1)CCC:在浓度为800 mg/L时,侧花枝、花朵数最多;浓度达1000~1200 mg/L时,烟株明显矮化、叶片深绿皱缩、花序紧缩,出现花柄腐烂现象。(2)6-BA:侧花枝生长旺盛,花朵极显著高于对照,随浓度的变化而影响不大,烟株其他无异常变化,最佳浓度为50~100 mg/L。(3)IAA:在浓度为150~200 mg/L时,侧花枝数最多,同时主茎上多处出现气生根群;花朵发育最佳浓度在20 mg/L以下,随浓度提升,花朵数量剧减。(4)NAA:在浓度为50~200 mg/L时,侧花枝最多,主茎上多处出现气生根群,叶片翻卷严重,花蕾数量减少且花蕾发育不良,大量萎缩;花朵发育最佳浓度在10 mg/L以下。(5)GA3:侧花枝伸长快,当浓度达150~200 mg/L时,侧花枝数最多,同时出现烟叶叶色发白,花枝细长,花蕾细长,大多花蕾不能正常开花等不良现象,所有处理的花朵数均较对照少,且已开放花朵的花粉活力也有所下降。(6)Put、Cad、Spd、Spm和VE:侧花枝数量随浓度增加呈上升趋势,但花朵数量则随浓度增加呈下降趋势。
2.2 不同植物生长调节剂对种子产量、质量的影响
由表4可看出,10种植物生长调节剂对烟株单果种子粒数均有显著影响。Put、VE、Spd、Spm、CCC、6-BA、Cad均可以提高单果种子粒数,与对照的增长幅度随着浓度加大而呈先上升后下降趋势;与对照相比,Put浓度为30 mg/L时增长76.14%,VE浓度为50 mg/L时增长46.69%,Spd浓度为30 mg/L时增长41.87%,Spm浓度为30 mg/L时增长20.03%,CCC浓度为800 mg/L时增长21.77%,6-BA浓度为50 mg/L时增长8.86%。IAA、NAA和GA3则会减少单果粒数,与对照的减少幅度随浓度的加大而加大,最大降幅分别为34.17%、58.30%和66.03%。
10种调节剂的不同处理对种子千粒重均有一定程度的影响。CCC、6-BA、Put、VE、Spd可提高千粒重,IAA和Cad对千粒重的影响较小,GA3和高浓度的NAA则会减少千粒重。CCC、6-BA、多胺类(Put、Cad、Spd、Spm)和VE均可提高种子产量,随调节剂浓度加大与对照的增长幅度表现为先上升后下降的趋势;低浓度NAA、IAA可提高种子产量,GA3则会减少种子产量,且随浓度加大与对照的减少幅度加大;与对照相比,CCC浓度为800 mg/L时种子产量增长59.71%,6-BA浓度为50 mg/L时增长62.42%,Put浓度为30~50 mg/L时增长120%以上,VE浓度为30~50 mg/L时增长110%以上。

表3 不同植物生长调节剂对烟株腋芽发育的影响
续表3:

调节剂浓度/(mg/L)顶端主花枝花序花朵数/朵比CK±/%花粉活力/%侧花枝花序侧花枝数/个比CK±/%平均花朵数/朵比CK±/%花粉活力/%VE30632**64.58 98.026.70**76.32 376.95**58.05 98.0950620**61.46 98.587.70**102.63 371.01**55.56 96.3590588**53.13 97.297.57**99.21 350.62**47.01 98.0215044716.41 98.656.63**74.47 282.6718.52 96.6220043613.54 98.626.60**73.68 273.9214.85 97.60清水(CK)/384/98.403.80/238.50/97.25
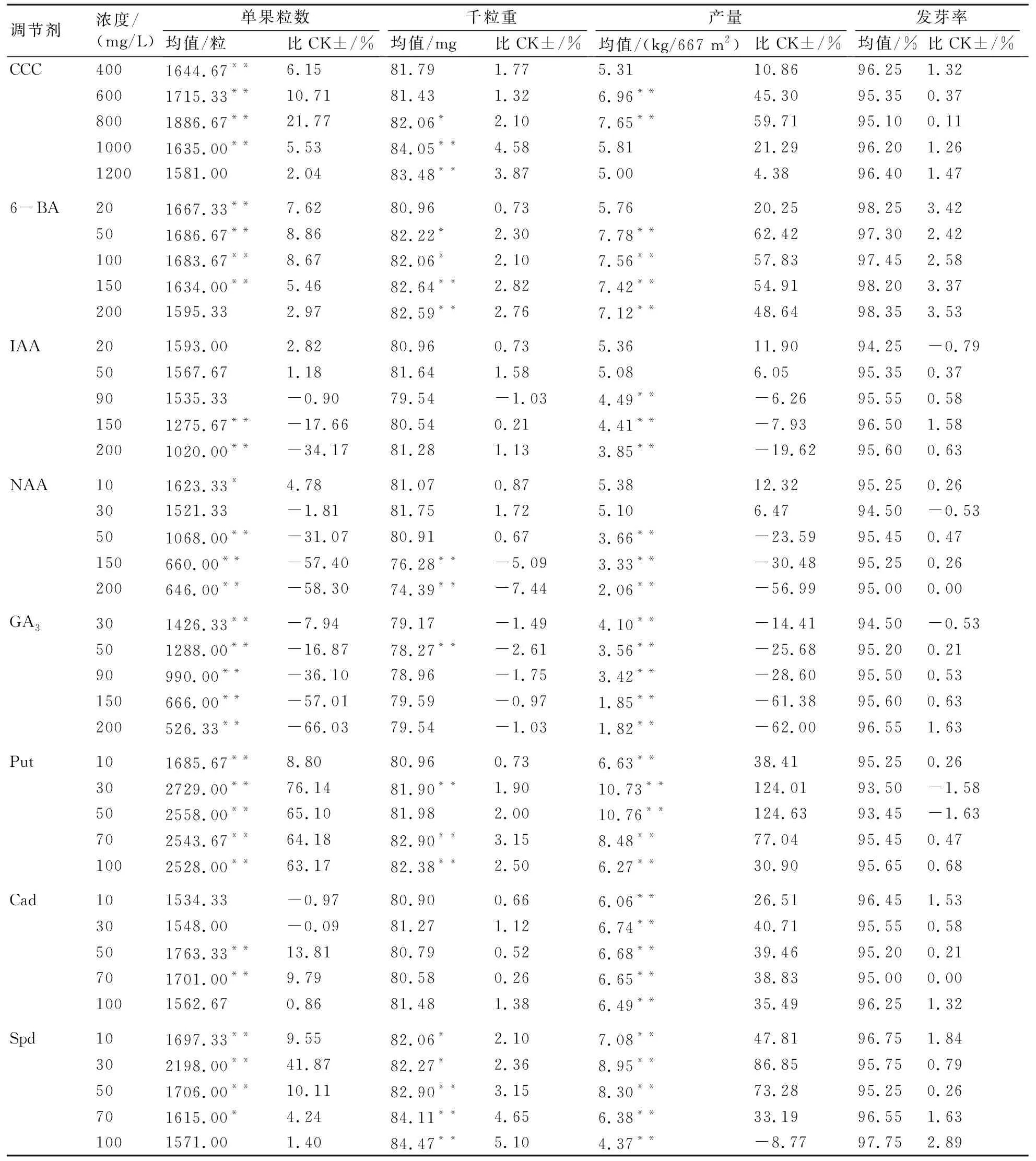
表4 不同外源激素对烟草种子产量、质量的影响
续表4:

调节剂浓度/(mg/L)单果粒数均值/粒比CK±/%千粒重均值/mg比CK±/%产量均值/(kg/667 m2)比CK±/%发芽率均值/%比CK±/%Spm101733.00**11.85 79.90-0.58 6.87**43.42 94.52-0.51 301859.67**20.03 80.60**0.29 7.53**57.20 95.050.05 501782.00**15.02 82.64**2.82 7.64**59.50 95.000.00 701628.33**5.10 81.371.24 6.90**44.05 95.250.26 1001586.332.39 81.691.64 6.74**40.71 95.450.47 VE301998.00**28.96 81.060.86 10.51**119.42 96.251.32 502272.67**46.69 82.69**2.89 10.52**119.62 96.501.58 902257.67**45.72 84.69**5.38 9.12**90.40 97.252.37 1501645.67**6.22 84.69**5.38 9.03**88.52 97.652.79 2001588.002.50 82.58**2.75 5.4313.36 98.503.68 对照(CK)/1549.33/80.37/4.79/95.00/
烟草种子质量主要包括种子纯度、净度、发芽率、水分、色泽和饱满度等指标,其中发芽率、色泽和饱满度是种子生命活力的考核指标,直接关系到种子的使用价值和烟叶生产[2]。本试验中,10种调节剂对种子色泽和饱满度无明显影响,均表现为深褐色、油亮、色泽一致、饱满、均匀;对种子发芽率均具有一定的积极作用,其中以VE、6-BA、CCC较明显,但与对照的差异均不显著。
3 讨论
有研究认为,GA3参与植物成花的转导过程,具有代替光诱导和低温诱导促进花芽分化和促进果实的产生的作用[22]。在烟株体内只有当促进茎内形成的赤霉素和直接促进开花的开花素结合在一起时,烟株才能开花[21]。也有研究认为GA3对花诱导和花发育既有促进作用,也有抑制作用[23],较低水平的GA3有利于植物的花芽分化[24]。王春茂等[25]认为GA3是主要的抑制成花激素。IAA同样可能在促进成花和抑制成花2个方面均起作用,主要取决于IAA的浓度,低水平IAA能够促进花芽发育,而高水平的IAA抑制花芽发育[26]。细胞分裂素对花芽分化有促进作用[27],刘进平[28]认为施用细胞分裂素可促进腋芽生长。Put、Spm、Spd、Cad属多胺类物质,通过调节植物对生长素和细胞分裂素的敏感性影响了植物的生长发育,有刺激细胞分裂、促进生长、花芽形成与开花、果实生长、调节与光敏素有关的生长和形态等生理作用[10,29-30]。本试验结果与前人的研究结论基本一致。
各调节剂对烟草蒴果内种子粒数、千粒重、种子产量、花药活力和种子质量影响的报道较少。本研究结果表明,Put、Spd、Spm、CCC、6-BA、Cad均提高单果种子粒数,IAA、NAA和GA3则会减少单果粒数;CCC、6-BA、Put、VE、Spd可提高千粒重,GA3和高浓度的NAA则会减少千粒重。CCC、6-BA、Put、Cad、Spd、Spm、VE和低浓度NAA、IAA可提高种子产量;GA3则会减少种子产量。目前,各调节剂对花药活力和种子质量影响相对较小或没有,尚需在烟株授粉受精、胚胎发育等多方面进一步深入研究论证。
VE广泛分布在植物所有绿色组织中,主要由光合器官产生,在植物中除存在于种子油体(脂体)外,其他的大部分存在于质体中。VE不但参与细胞的抗氧化,而且在植物生长发育、光合同化物运输、对逆境响应以及信号转导等方面也有重要功能[31],但鲜见有促进植物生殖生长等方面的报道。本研究发现VE具有显著的增花、促进腋芽、侧花枝发育,提高单果种子粒数、千粒重、种子产量的作用,其机理尚需进一步研究。
4 结论
6-BA、CCC的不同浓度处理均具有增花的显著作用;低浓度的Spd、SPm、Put、Cad、IAA、NAA同样具有显著的增花效果。10种调节剂均具有显著或极显著促进腋芽向侧花枝发育作用,尤其是IAA、GA3、Put、NAA;但GA3对花朵发育十分不利。
在烟草种子生产上,可采用600~800 mg/L CCC、20~50 mg/L 6-BA、30~50 mg/L VE和30 mg/L的Put、Spd和Cad作保花保果剂,在烟株现蕾~初花期,连续施药3次,以抑制烟株营养生长,促进生殖生长,提高单果种子粒数和种子产量;用20 mg/L IAA或10 mg/L NAA、20~50 mg/L 6-BA或30~50 mg/L VE、30 mg/L Spm在杂交父本盛花期连续施药3次,以促进腋芽发育成侧花枝,增加开花数量。

