用正交试验法优化香水百合试管鳞茎的诱导
祁宏英,徐洪国,杨伟丽
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006;2.抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006)
香水百合(Liliumoriental hybrid ‘Casa Blanca’)为百合科(Liliaceae)百合属(Lilium)多年生鳞茎类球根花卉,是重要的切花和盆花植物[1]。香水百合花色艳丽,芳香宜人,被誉为百合中的“女王”,是盆栽和点缀花园、庭院的名贵花卉,也是世界各地广泛应用的切花材料[2-3]。香水百合通常采用分鳞茎、分珠芽、扦插的无性繁殖方法进行繁殖,但是采用传统繁殖方法极易感病,导致鳞茎逐年变小退化,繁殖系数也比较低,所以在短期内难以满足市场需求,目前国内百合切花生产所用的优质种球仍依赖从国外进口[1,4]。百合组培苗具有繁殖系数高、繁殖周期短等优点,刚好弥补了种球繁育的不足,而且容易保持原品种的优良观赏特性,对保护百合品种资源具有重要的理论意义和实践意义。百合的再生能力强,鳞片、叶片、花丝、花药、花瓣、珠芽、种子、胚等离体培养前人均有报道。崔祺等[5]报道淡黄花百合种子萌发的适宜培养基为MS+0.01 mg/L NAA+60 g/L蔗糖,适于‘索邦’、‘雷山3号’鳞片诱导不定芽的培养基分别为MS+2.0 mg/L 6-BA+0.3 mg/L NAA和MS+0.5 mg/L 6-BA+0.2 mg/L NAA;刘雅莉等[6]以花梗、花托、花瓣和花丝为外植体均可直接诱导产生不定芽,诱导不定芽的适宜培养基为N6+BA 1.0 mg/L +KT 1.0 mg/L+NAA 1.0 mg/L;农艳丰等[7](2014)对OT型百合的花蕾和半开花的不同部位进行了愈伤组织诱导,诱导从易到难表现为子房>柱头>花药>花托>花丝、花瓣,其中子房和柱头的愈伤组织诱导率均超过50.0%。王雅楠等[8]认为新疆百合鳞片最适的诱导培养基为MS+1 mg/L 6-BA+1 mg/L NAA;不同部位鳞片的诱导率为内层>中层>外层、中部>下部>上部;最适增殖培养基为MS+0.5 mg/L 6-BA+0.05 mg/L NAA,增殖系数达3.46;最适生根培养基为1/2 MS+0.2 mg/L NAA+0.2 mg/L,生根率达100%。谢松林等[9]对百合杂种幼胚进行了离体培养,胚、胚乳及胚珠3种外植体的离体培养萌发率分别为100.0%、21.5%和1.0%,认为胚、胚乳及胚珠培养是从幼胚获得百合杂种植株的高效途径。牛俊乐等[10]利用无菌叶片、花器官培养获得的无菌小鱗片及叶片为材料建立了无性快繁体系。
正交试验方法是利用正交表进行科学的安排与分析多因素试验的方法。其主要优点是能在很多试验方案中挑选出代表性强的少数几个试验方案,并且通过对这少数试验方案实验结果的分析,推断出最优方案。目前关于百合快繁的研究虽然很多,但多数都是单独研究外植体的,或者培养基的筛选,将外植体和激素浓度组合在一起进行探讨的相对较少。影响百合鳞茎试管苗诱导的因素有很多,培养条件的筛选工作量较大。为了降低实验次数,节约实验成本,我们以香水百合的鳞片为外植体,采用正交设计L9(34)对香水百合小鳞茎的诱导因子进行了研究,以期建立百合小鳞茎大量繁殖的技术流程,为国内百合商品种球的大量生产提供理论依据,为百合的遗传转化和基因工程育种提供技术支持。
1 材料与方法
1.1 试验材料
香水百合(Liliumoriental hybrid ‘Casa Blanca’ )。
1.2 外植体的选取及消毒
选取无病虫害、外观整齐干净、光滑的香水百合的鳞茎,用流水冲洗60 min左右,直到把鳞茎表面的泥土污垢冲干净为止。在无菌操作台上先把鳞茎分成外层、中层和内层,放于标记好的锥形瓶中,用75%的酒精浸泡1 min,然后用0.1%的升汞浸泡10 min,期间不断摇晃锥形瓶,使其消毒充分均匀;最后用无菌水冲洗3~4次。
1.3 试验设计
采用L9(34)正交试验设计(表1、表2),在接种操作中把分拨下来的鳞片按形态学上、中、下3部分切成0.5 cm× 0.5 cm的小块,分别接种到添加了不同浓度激素组合的MS(蔗糖含量为3%,琼脂含量为0.7%)初代培养基上,且在整个培养的过程中香水百合的鳞片都是以内侧的一面向上接种到培养基中[11],每瓶接种5块,每个处理接种6瓶,3次重复。每周观察外植体的变化,培养30 d后统计鳞片分化试管鳞茎数,计算分化数和分化率。
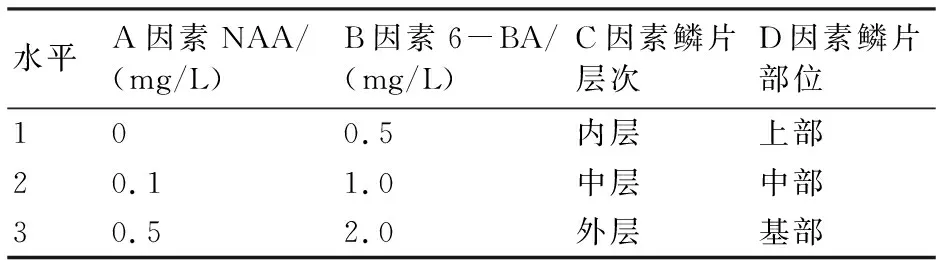
表1 试管鳞茎诱导正交试验因素及其水平

表2 试管鳞茎诱导正交试验设计
1.4 数据处理方法
用SPSS 19.0统计分析软件对试验数据进行方差分析。
2 结果与分析
2.1 香水百合试管鳞茎诱导正交试验结果
正交试验各处理均重复3次,取其平均值,并将各项数据进行统计学分析。根据试验结果求出每个因素每一水平下的分化数平均值Ki,并求出同一因素不同水平间平均值的极差R。从表3中的R值可以看出,各因素对诱导试管鳞茎的影响从大到小依次为NAA>6-BA>鳞片层次>鳞片部位。Ki值反映了不同因素各水平对试管鳞茎诱导的影响情况,Ki值越大,诱导效果越好。根据表3中4个因素各水平下的Ki值,可知香水百合试管鳞茎诱导的最优条件组合为A2B3C2D2,即基本培养基+0.1 mg/L NAA+2.0 mg/L 6-BA+中层鳞片+鳞片中部部位的组合。该最佳组合并没有在正交表中出现,但与6号处理接近,仅鳞片层次不同,平均再生芽数达到了4.56。
2.2 正交试验结果的方差分析
用SPSS软件对正交试验中香水百合鳞片分化试管鳞茎的平均数进行方差分析。表4中的F值表明:除鳞片部位外,其余的因素(NAA浓度、6-BA浓度、鳞片层次)各水平对试管鳞茎平均分化数的影响均达到了极显著水平(P<0.01),可进一步进行因素内多重比较分析;其中NAA浓度对试验结果的影响最大。多重比较分析结果表明:0.1 mg/L NAA的诱导效果最佳,显著优于其他2个浓度水平下的;6-BA浓度对试验结果的影响仅次于NAA,其最佳浓度为2.0 mg/L;鳞片部位对分化数结果的影响并不显著,无统计意义,因此3个部位的鳞片都可以作为香水百合的外植体。

表3 香水百合试管鳞茎诱导正交试验结果及分析
注:Ki为各因素在各个水平下的分化数平均值;R为极差。

表4 香水百合试管鳞茎诱导正交试验的方差分析结果
注:“**”代表达到0.01显著水平。
2.3 香水百合试管鳞茎最佳诱导条件的验证
利用正交试验法得到香水百合试管鳞茎诱导的最佳条件为基本培养基+0.1 mg/L NAA +2.0 mg/L 6-BA+中层鳞片+鳞片中部部位的组合。在此条件下进行诱导香水百合试管鳞茎的验证试验,结果诱导率达到100%,平均分化数达到4.89。
3 讨论
诱导鳞片外植体形成试管鳞茎时,内层鳞片的分化效果较好,这与大多数学者的研究结果[8-9]一致。鳞片部位在本试验中对小鳞茎分化数结果的影响并不显著,这与赵静等[13]的研究结果有所不同,可能与材料特性有关。在试管鳞茎的诱导中一般使用细胞分裂素与生长素的配比,但过高浓度的生长素容易使试管鳞茎的诱导力降低,产生大量愈伤组织或不定根;一般认为MS培养基较适于百合的离体培养,添加外源激素以6-BA和NAA配比为佳。本试验结果表明,香水百合组织培养的最佳分化培养基为MS+6-BA 2.0 mg/L+NAA 0.1 mg/L,在此条件下可得到很高的分化率和分化数。
正交试验法是一种高效率、快速、经济的实验设计方法[14]。该方法在植物组织培养中有着重要的应用价值,在百合组织培养中也有所应用[2,15-16]。但多数学者仅依据极差值对正交试验数据进行分析,而未进行方差分析。方差分析法不仅是对正交试验结果进行准确分析的保证,而且也是检验该试验结果是否可靠的重要方法[17]。本文通过正交试验一次性对香水百合试管鳞茎诱导过程中最主要的4个因素(NAA、6-BA、鳞片层次和鳞片部位)进行了有重复的极差分析和方差分析研究,探究了不同因素的影响大小,并筛选出香水百合试管鳞茎诱导的最佳组合条件,这为下一步开展香水百合再生体系的构建和进行遗传转化奠定了理论基础。

